吴 竞,李鹏飞,丘余良,许勇镇
(1.福建中医药大学附属人民医院,福建 福州 350004;2.北京中医药大学厦门医院,福建 厦门 361015)
糖尿病肾脏病(diabetic kidney disease,DKD)是糖尿病的常见并发症,其主要病理改变之一为肾小球系膜细胞增生、系膜基质增生,已成为我国终末期肾脏病构成的重要因素[1-3]。我国2 型DKD 患者占糖尿病患者总人数的30%~50%[4]。目前DKD的治疗主要以控制血压、血糖、血脂、蛋白尿为主,但这并不能完全阻止DKD 进展,目前仍缺乏能有效防治或逆转DKD 病程的药物及方案。
细胞焦亡作为新发现的程序性细胞死亡方式,在DKD 发病中发挥着重要作用[5]。DKD 患者高糖、高胰岛素、氧化应激、微炎症等因素均可诱导NOD 样受体热蛋白结构域3(NLRP3)炎症小体的活化,继而介导半胱氨酸蛋白酶-1(Caspase-1)的成熟,促进IL-1β 及IL-18 等炎性因子的释放,激发细胞炎性反应及细胞焦亡,导致肾脏纤维化[6]。
益肾降糖饮是福建中医药大学附属人民医院阮诗玮教授创立,针对DKD 气阴两虚证有确切疗效[7-10]。本研究观察益肾降糖饮含药血清对于高糖高胰岛素培养下人肾小球系膜细胞焦亡相关蛋白表达的影响,进而阐明其临床防治DKD 的分子机制。
1 实验材料
1.1 实验动物 60 只SPF 级健康雄性SD 大鼠,6~8 周龄,体质量(200±20 g),购自杭州医学院,生产许可证号码:SCXK(浙)2019-00052,饲养于福建中医药大学实验动物中心SPF 级动物实验室。饲养条件:环境安静,自由摄食饮水,温度为20~25 ℃,相对湿度为50%~60%,光照明暗循环各12 h。本实验方案经福建中医药大学实验动物伦理委员会审核批准(审批号:FJTCM IACUC 2021156)。
1.2 实验细胞 人肾小球系膜细胞(human mesangial cells,HMC)由北京北纳创联生物技术研究院提供(货号:bncc341777)。
1.3 实验药物 益肾降糖饮为福建中医药大学附属人民医院院内制剂(批号:闽药制字Z06106053)。药物组成:何首乌40 g,玄参40 g,生地黄40 g,太子参40 g,黄芪40 g,山药60 g,肉苁蓉40 g,僵蚕40 g,当归40 g,赤芍40 g,苍术20 g,马齿苋60 g,黄芩20 g,鲜石橄榄60 g。
1.4 实验试剂 DMEM 培养基(批号:11965092)、FBS(批号:10270-106)、PBS(批号:10010023)均购自美国Gibco 公司;RIPA 裂解液(批号:P0013B)、PMSF(批号:ST505)、BCA 蛋白浓度测定试剂盒(批号:P0010)、5×SDS-PAGE 蛋白上样缓冲液(批号:P0015L)、SDS-PAGE 凝胶配制试剂盒(批号:P0012A)、转印缓冲液(批号:P0021)、电泳液(批号:P0014B)、ECL 化学发光试剂盒(批号:P0018FS)均购自上海碧云天生物技术有限公司;预染蛋白marker(美国Invitrogen 公司,批号:26617);PVDF 膜(德国Millipore公司,批号:IEVH00005)、Caspase-1 antibody(批号:22915-1-AP);NLRP3 antibody(批号:19771-1-AP)、GAPDH antibody(批号:60004-1-Ig)均购自Proteintech 公司。
1.5 实验仪器 冷冻离心机(湖南湘仪实验室仪器开发有限公司);制冰机(常熟市雪科电器有限公司);电泳仪、化学放光仪(上海天能科技有限公司);纯水仪(南京智拓仪器仪表有限公司);定量PCR 仪、普通PCR 仪(美国ABI 公司);酶标仪、细胞培养箱(美国Thermo 公司);超净工作台(苏州安泰空气技术有限公司)。
2 实验方法
2.1 益肾降糖饮汤药的制备 本次研究所需益肾降糖饮由福建中医药大学附属人民医院制剂室自制提供,规格:250 mL/瓶。
2.2 益肾降糖饮含药血清和空白血清制备 60 只SPF 级雄性SD 大鼠按照随机数字表法分为空白组和低、中、高剂量组,每组15 只。低、中、高剂量组的给药量依据人与大鼠体表面积换算方法,分别为人等效剂量的2.5、5、10 倍。大鼠适应性饲养7 d后,空白组给予生理盐水34 mL/(kg·d)灌胃,低、中、高剂量组分别给予浓度为0.39、0.78、1.56 g/mL益肾降糖饮混悬液34 mL/(kg·d)灌胃,每天2 次,持续7 d。最后1 次灌胃1 h 后,以20%乌拉坦溶液腹腔注射麻醉,腹主动脉采血,4 ℃静置1 h 后离心机离心提取含药血清和空白血清。收集的血清56 ℃下灭活补体30 min,放入-80 ℃冰箱保存。
2.3 模型制备和分组
2.3.1 HMC 复苏、传代 从液氮中取出人肾小球系膜细胞株,迅速复苏接种于含10%胎牛血清的DMEM(10% FBS、1%双抗)培养基中,以后每1~2 d完全更换培养液1 次,待细胞长满后用0.25%胰酶消化,进行细胞传代,取对数增长期,第3~4 代的细胞进行实验。
2.3.2 建立体外HMC 模型并分组干预 取生长状态良好、密度适中的HMC 分为空白组,模型组,低、中、高剂量组。空白组采用10%的大鼠空白血清DMEM培养基;模型组在4.5 mg/mL葡萄糖、10 μg/mL胰岛素诱导后,加浓度为10%大鼠空白血清干预;低、中、高剂量组在4.5 mg/mL 葡萄糖、10 μg/mL 胰岛素诱导后,分别加浓度为10%的大鼠含浓度为0.39、0.78、1.56 g/mL 的益肾降糖饮含药血清干预。5 组细胞置于37 ℃、5%CO2的细胞培养箱中,培养48 h。
2.4 观察指标
2.4.1 qPCR 检测5组细胞NLPR3、Caspase-1 mRNA相对表达水平 提取5 组细胞中RNA,反转录试剂盒进行反转录获得cDNA,再运用qPCR 分别检测Caspase-1、NLPR3、GAPDH mRNA 相对表达水平,引物序列见表1。反应条件为:95 ℃预变性3 min,再以95 ℃,30 s→55 ℃,60 s→72 ℃,30 s 的条件循环扩增35 次。qPCR 是在美国Applied Biosystems公司的StepOne™ Real-Time PCR仪上完成,每个样品均作3 个复孔,使用EnTurbo™ SYBR Green PCR Super-Mix 试剂盒进行(ELK Biotechnology,EQ001),实验结果采用2-△△Ct的方法进行分析。
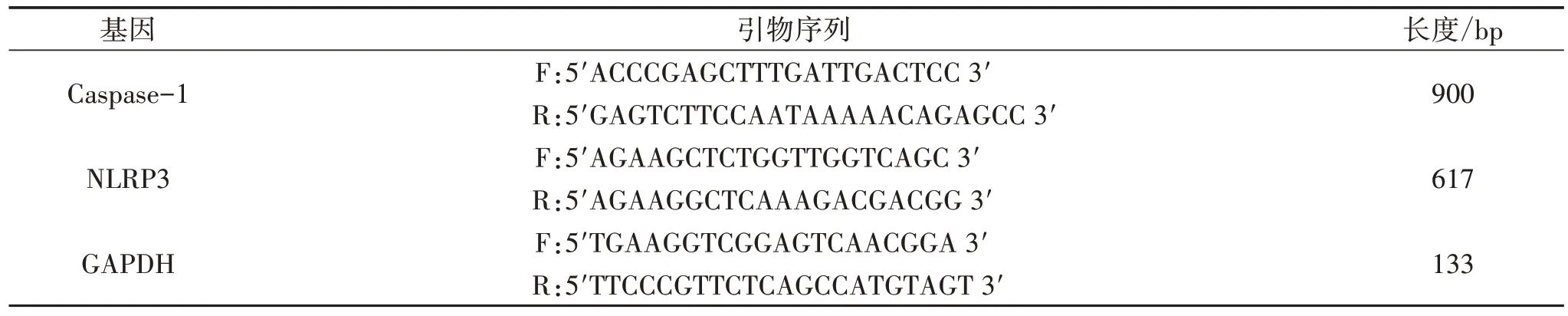
表1 引物序列
2.4.2 Western blot 检测5 组细胞NLPR3、Caspase-1蛋白表达量 收集5 组HMC 蛋白,进行4 次SDSPAGE 电泳、转膜、封闭、一抗孵育、二抗孵育,然后显色、拍照。结果采用ImageJ 软件分析相对灰度值,并进行统计。
2.5 统计学方法 所有数据采用SPSS 23.0 进行统计分析。计量资料符合正态分布以(±s)表示,多组比较采用单因素方差分析,事后两两比较采用LSD 方法。P<0.05 表示差异具有统计学意义。
3 结 果
3.1 5组细胞Caspase-1、NLRP3 mRNA 相对表达水平比较 见表2。
表2 5 组细胞Caspase-1、NLRP3 mRNA相对表达水平比较(±s)

表2 5 组细胞Caspase-1、NLRP3 mRNA相对表达水平比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05。
NLRP3 1.12±0.19 3.28±0.581)2.52±0.332)2.11±0.262)3)1.64±0.302)3)组别空白组模型组低剂量组中剂量组高剂量组Caspase-1 0.99±0.17 3.07±0.311)2.32±0.282)1.73±0.252)3)1.46±0.222)3)
3.2 5组细胞Caspase-1、NLRP3蛋白表达量比较 见图1、表3。

图1 5 组细胞Caspase-1、NLRP3 蛋白条带图
表3 5 组细胞Caspase-1、NLRP3蛋白表达量比较(±s)

表3 5 组细胞Caspase-1、NLRP3蛋白表达量比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05。
NLRP3 0.56±0.04 1.16±0.051)1.05±0.072)0.59±0.042)3)0.45±0.032)3)组别空白组模型组低剂量组中剂量组高剂量组Caspase-1 0.51±0.04 0.66±0.041)0.61±0.07 0.50±0.022)3)0.22±0.042)3)
4 讨 论
细胞焦亡是一种促炎程序性细胞死亡方式,由Caspase-1 依赖性介导,释放大量炎性因子,诱发炎症反应[11],其主要特点是细胞质膜完整性丧失,细胞内物质流出[12]。细胞焦亡时,内源性和外源性刺激信号刺激炎症小体,介导Caspase-1 的成熟和释放,切割下游GSDMD 蛋白,在膜内侧聚集形成孔道,水分子侵入细胞,导致细胞破裂,细胞内物质流出,继而进一步放大局部和全身炎症反应[13]。
近年来,糖尿病也被认为是一种免疫炎症性疾病[14],而DKD 也被证实与细胞焦亡、炎症反应及氧化应激关系密切[15]。WANG 等[16]发现,对于高糖处理的大鼠系膜细胞,其NLRP3、Caspase-1、IL-1β 表达水平均升高,TXNIP/NLRP3 炎症小体通路活化;沉默TXNIP 可抑制高糖诱导的TXNIP/NLRP3 炎症小体通路活性,减轻系膜细胞增殖、氧化应激以及细胞外基质沉积。SAMRA 等[17]发现,对于STZ 诱导的糖尿病动物模型,其肾组织NLRP3 表达水平增加,IL-1β 表达水平升高。FENG 等[18]通过免疫组化检测发现,DKD 大鼠肾脏组织中炎症小体NLRP3 及炎症因子IL-1β 高表达,且经高糖培养HMC 后发现NLRP3、Caspase-1 等焦亡相关蛋白阳性率增加,与剂量与时间呈正相关。糖尿病大鼠高血糖、血脂异常、高尿酸等因素协和作用,导致炎症小体组分NLRP3、Caspase-1 高表达,引起细胞焦亡,产生肾脏损伤及肾脏纤维化[19]。因此,糖尿病肾脏病发生、发展中均伴随着NLRP3 炎症小体的活化,其活化因素包括了高糖、氧化应激、微炎症等多个方面。
阮诗玮教授认为DKD 基本病机为气阴两虚证,结合多年临床经验,创立了DKD 气阴两虚证基本方——益肾降糖饮,并开展为本院院内制剂。我科通过不同的切入点,设计并完成系列临床试验,结果表明该方治疗糖尿病肾脏病疗效确切,具有抑制炎症反应、减少蛋白尿及延缓肾功能进展的临床疗效[7-10]。王宝萍[20]研究发现DKD 患者血IL-18、尿IL-18 均高于健康组,且益肾降糖饮能显着降低气阴两虚证DKD 患者血IL-18、尿IL-18 水平,疗效优于单纯西药治疗。
本研究结果表明:糖尿病高糖及高胰岛素状态可以增加细胞焦亡蛋白NLRP3、Caspase-1 的表达,细胞内的炎症反应促进了系膜细胞焦亡的发生。益肾降糖饮可以通过调控NLRP3、Caspase-1以抑制肾小球系膜细胞焦亡。本研究初步阐明了益肾降糖饮改善DKD 患者蛋白尿及肾功能的可能机制,为下一步动物造模体内实验提供体外初步的实验证据,对于指导糖尿病肾脏病的诊疗具有重要意义。



