陈雅鑫,张怡评,杨 婷,洪 专
(1.福建农林大学,福建 福州 350001;2.自然资源部第三海洋研究所/海洋生物资源开发利用工程技术创新中心,福建 厦门 361005)
昆布始载于汉末《名医别录》,具有消痰、软坚散结、利水消肿等功效。历代古籍有昆布用于治疗肥胖及糖尿病的记载,如唐代《食疗本草》云:“昆布下气,久服瘦人”;《玉楸药解》记载昆布能“破积软坚,止消渴,化痰水”[1]。研究发现,昆布中含有一种天然的类胡萝卜素——岩藻黄质(fucoxanthin,FX),由于其具有特殊的化学结构,因此具有众多显着生物活性,如TSUKUI T等[2]研究表明,从昆布中提取的岩藻黄质可通过提高白色脂肪组织中线粒体解耦联蛋白-1(UCP1)的表达,促进脂肪分解达到减肥降脂效果。ZHANG Y P等[3]对昆布(海带)中分离纯化的岩藻黄质分别进行4种自由基清除活性研究,结果表明岩藻黄质及其异构体清除自由基的活性均呈剂量依赖性,且活性强于生育酚,具有较强的抗氧化活性。此外,岩藻黄素还可以调节肝脏中的葡萄糖激酶和磷酸烯醇丙酮酸羧激酶mRNA的表达,可显着降低血糖[4],并且能诱导MCF-7和Caco-2的凋亡,对于一些肿瘤细胞具有潜在抗增殖和诱导凋亡作用[5]。这些生物活性均表明岩藻黄质具有良好的保健品或药物开发应用前景。
有研究显示,岩藻黄质在常态下遇光、热、氧容易分解,稳定性较差[6],并且其疏水特性[7],导致岩藻黄质在水溶性基材如饮料、色素中的应用有限;此外,岩藻黄质在人体胃液中的低pH环境下极其容易分解[8],导致肠道不能完全代谢吸收,阻碍了其生物功能的发挥,生物利用度低。这些现存问题都极大限制了岩藻黄质功能性食品或药品的实际生产应用,也证实了对岩藻黄质采取一定保护措施,提高其稳定性和生物利用度的必要性。
稳态化制剂是指经过物理或化学等方法处理后,得到的稳定性有所提高的系列产品。目前,国内陆续推出的岩藻黄质制剂主要有油剂、软胶囊、片剂3种,这些传统剂型虽然可以在一定程度上改善岩藻黄质的稳定性和生物利用度,但最终效果皆有一定缺陷。随着现代制剂技术的发展,微胶囊、脂质体、纳米乳液这3种新型药物载体在岩藻黄质上的应用逐渐成为国内外学者的研究热点。本研究主要对近些年来国内外在岩藻黄质的稳态化制剂方面的研究进展进行综述,并且具体阐述新型技术在岩藻黄质上的应用,拟为制备高稳定性和高生物利用度的岩藻黄质制剂提供理论依据。
1 岩藻黄质体内代谢
岩藻黄质的吸收和代谢与其生物利用度密切相关。了解岩藻黄质的代谢过程对提高其稳定性和生物利用度至关重要。(见图1)
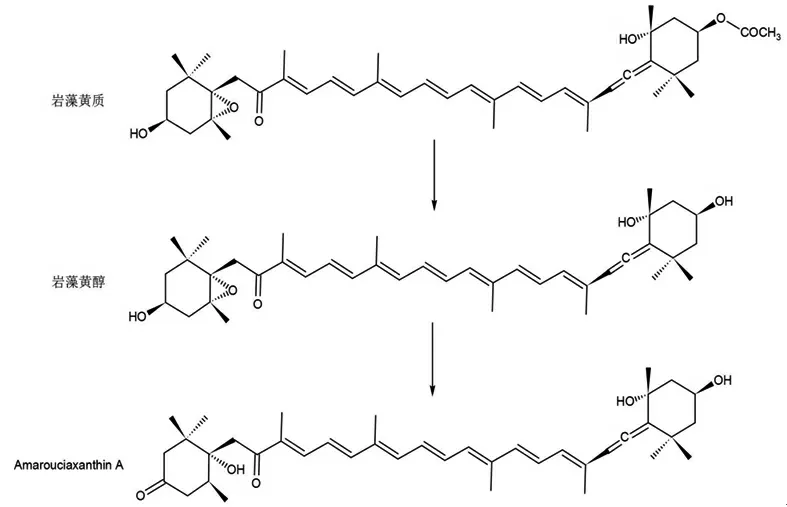
图1 岩藻黄质的体内代谢转化过程
岩藻黄醇和岩藻黄质A(Amarouciaxanthin A,AXA)是岩藻黄质的主要代谢产物[9]。在给药后2 h内,岩藻黄质在胃肠道的脂肪酶和胆固醇酶酶解作用下脱乙酰化,形成初级代谢物岩藻黄醇,随后进入血液循环中[10],而部分则通过肝脏微粒体和HepG2细胞中脱氢或异构化进一步生物转化为岩藻黄质A[11],此时主要累及在脂肪组织中。且HASHIMOTO T等[12]体外研究表明,岩藻黄醇是人体的主要活性代谢物。
KADEKARU T等[13]进行的大鼠实验研究表明,连续服用岩藻黄质4周(纯度为95%)未发现任何毒性作用;在急性毒性试验中,口服岩藻黄质4周后没有显示出任何相关的毒性效应,且其代谢产物在体内无明显不良反应[14],表明岩藻黄质是一种安全的药物成分。然而,与其他类胡萝卜素一样,岩藻黄质的有效吸收依赖于肠道阶段中脂肪的乳化作用和胶束化的形成过程。由于暴露于口腔唾液淀粉酶及胃液中低pH值环境下[15],岩藻黄质往往会在初始消化阶段中随时被降解,通过异构化形成一些顺式异构体,而KAWEE-AI A等[16]的研究表明,当顺式异构体比例增加时,岩藻黄质的生物活性随之降低。
药物与适宜载体经过一定的分散技术制得具有一定粒径的药物制剂,可改善药物的稳定性,起到延缓药物释放,甚至药物控释等作用[1]。因此,选择合适的给药系统即载体类型,是提高岩藻黄质稳定性和生物利用度的重要因素。
2 传统剂型与局限性
目前最常见的岩藻黄质功能性食品剂型主要有油剂、软胶囊、片剂3种。油剂的制备物主要是油悬浮物,即岩藻黄质微晶体在食用植物油中形成的具有一定黏性和流动性的悬浮体系;另一种是油树脂,即天然类胡萝卜素萃取物除去溶剂后残留的组分[17]。这两种剂型都具有较大的黏性,流动性较差,不适合人体直接服用,活性成分极易被环境因素破坏,且储存与携带不方便,这些因素皆限制了油剂的广泛使用。因此,这两种油剂一般被制成软胶囊,但是口服的岩藻黄质软胶囊由于肝脏的“首过效应”,生物利用度很低[18]。
岩藻黄质片剂主要是通过有机溶剂浸提藻类原料,之后合并提取液进行分离、纯化获得纯度较高的岩藻黄质粉,再进一步压片制备而成[19]。尽管该剂型克服了油剂给服用者带来的不适感及携带不便等问题,但是其主要缺陷是在口腔易挥发特殊气味,因此,仍然有一些关于传统片剂剂型的改进方法,例如在片剂外包裹吸水性聚合物形成包衣片,掩盖药物的不良气味的同时还能增加核心物质稳定性[20];或者加工成分散片,在温水中可快速形成均匀的混悬液,可克服婴幼儿及老年人对普通片剂吞咽困难的问题,但仍存在由于分散片吸湿性较强,对于包装和储藏要求较高等缺点[21]。
此外,还有一些提高岩藻黄质稳定性的加工方法:在溶剂中添加适量的抗氧化剂,以增强岩藻黄质的稳定性,但是对于岩藻黄质的异构化反应作用不明显[22];溶剂采用高度不饱和的油脂,也能显着提高岩藻黄质的稳定性[23]。上述传统剂型和加工方法虽然能在一定程度上改善岩藻黄质制剂,但稳定性和生物利用度仍需要进一步提高,需要研制更好的剂型产品。
3 新型制剂技术
随着技术与设备的发展,出现了很多新的制剂技术和新剂型,将难溶于水的岩藻黄质的研究提高到新的水平。药物粒径和溶解性是进一步提高岩藻黄质稳定性和生物利用度的重要因素,新型制剂技术可改善这两大特性,包括微胶囊技术、脂质纳米粒技术和纳米乳液技术。
3.1 微胶囊技术 微胶囊技术指的是利用成膜材料,把化合物置于其中,形成纳米到上千微米直径的小容器[24]。随着科技的进步,关于活性物质的微胶囊化研究日益增加。微胶囊的应用,不仅能显着改善化合物的外观和性能,而且能有效提高活性化合物的体内生物利用度,具有更高的稳定性和递送效率[25-27]。壁材选择是微胶囊化技术的关键,关于岩藻黄质的包埋壁材必须安全、无毒[28],且具有较好亲水性。目前动植物蛋白、亲水性水溶胶、碳水化合物等壁材都已成功应用于岩藻黄质的微胶囊化[29]。
3.1.1 蛋白质类 蛋白质类壁材具有亲水和疏水基团,可促进乳状液的形成,并可在油滴附近形成一层保护膜,从而提高乳状液的稳定性[30]。天然乳清蛋白与岩藻黄质之间的结合原理已被ZHU J X等[31]证明为主要由非共价作用(包括范德华力、氢键、疏水作用力等)引起的,最终可形成围绕活性物质的保护层,并且乳清蛋白被证实是亲脂性保健食品的合适且有效载体[32]。此外,JAIN A等[33]利用酪蛋白和玉米醇溶蛋白结合来包埋岩藻黄质,结果发现明显增加了岩藻黄质的稳定性,可见酪蛋白两亲性的特性使之成为理想的载体,缺点是该种壁材在低pH值环境下容易沉淀析出,从而影响其生物利用度[34]。
3.1.2 亲水性水溶胶类 亲水性水溶胶包括海藻胶提取物如海藻酸盐,微生物发酵代谢物如黄原胶,以及植物分泌物如果胶、阿拉伯胶等,其中阿拉伯胶已被广泛用于制造适合封装疏水性活性成分的核壳微球。以阿拉伯胶和大豆分离蛋白为壁料来封装类胡萝卜素,可增强该类胡萝卜素的稳定性[35]。QUAN J等[36]将通过鱼明胶-阿拉伯胶包埋岩藻黄质的微球,作为一种含有岩藻黄质的口服药,可提高在模拟胃肠道条件下岩藻黄质持续释放性能及稳定性,其原因可能是鱼明胶与阿拉伯胶具有正负相反电荷,而能自发在岩藻黄质油核周边聚合而成硬化凝聚层,达到保护活性物质和控制释放目的。
3.1.3 碳水化合物 碳水化合物类微胶囊壁材有助于形成致密玻璃体,有良好成膜性,因此制成品黏度较低。相比于蛋白质类和亲水性类壁材,更有利于后续的物理化学性质评估,常用的碳水化合物有淀粉、糊精、壳聚糖等。OLIYAEI N等[37]将岩藻黄质经高岭土纳米管(HNT)包埋,并将负载岩藻黄质的HNT包埋到多孔淀粉(PS)中,由于PS良好的多孔结构可有效阻止岩藻黄质流失,结果获得了最佳的包埋效率(94.05%),而热重分析曲线显示,用HNT/PS对岩藻黄质进行双包埋,其释放也比其他方法更持久(6 h释放27.09%),且具有更高的热稳定性。此外,WANG Y F[38]等以多孔淀粉和明胶为壁材,采用喷雾干燥法制备了岩藻黄质微胶囊,结果表明新载体混合物中岩藻黄质微胶囊的耐热性、pH值、光稳定性和氧稳定性也有较大提高,其保留率比游离岩藻黄质提高15%~50%。
除淀粉外,其他碳水化合物壁材,如壳聚糖需要与胶体、蛋白等复配使用,以满足包埋需要。体外生物利用度研究发现聚合物CS通过包埋为岩藻黄质提供了保护,其在小鼠体内的生物利用度和组织蓄积通过壳聚糖的纳米封装得到改善。RAVI H等[39]研究发现水溶性壳聚糖纳米胶囊可提高岩藻黄质的体内外生物利用度至27.7%,说明壳聚糖可作为增强岩藻黄质生物利用度的新型载体。
3.2 脂质纳米粒技术 脂质纳米粒技术是指由油脂组成的直径为纳米级的微小球型结构。油脂载体毒性小,生物相容性高,更适合维护和精确递送活性化合物[40];固定的囊泡结构,在血液循环中不被破坏或生物降解[41];油脂载体具有易于修饰以获得所需的功能和靶向性,并可通过简单的化学反应与修饰的分子结合[42]等优点,新型的岩藻黄质油脂载体可分为纳米脂质体和固体脂质纳米粒两种[43-56]。
3.2.1 纳米脂质体 纳米脂质体主要是由双层两亲性磷脂包合活性化合物的球型囊泡载体构成的,双分子层的类脂分为亲水性的头部和亲油性的尾部,亲水性的头部形成膜的内外表面层,而亲油性的尾部处于膜的中间,因此在亲脂基内部或者脂质双分子层中,可用来包裹脂溶性药物[51]。纳米脂质体平均直径范围为50~150 nm。与传统包埋法相比,纳米脂质体的表面积更大,需要更高的能量来生产,但同时其包埋物往往具有更高的生物相容性和生物利用度。现已开发一种蛋黄和磷脂酰胆碱的纳米脂质体系统,用于封装1%或2%的浓度的岩藻黄质,并已显示具有延长稳定性的特点[52]。研究表明,由扇贝磷脂制备的负载岩藻黄质的纳米脂质体可增加肥胖小鼠模型附睾脂肪中UCP1 mRNA的表达[53]。胆固醇是另一种用来制备脂质体的脂质,可增加膜的硬度,降低生物活性物质的释放速率[54]。
纳米脂质体的最常用制备方法有薄膜蒸发法、乙醇注入法、逆相蒸发法等。以薄膜蒸发法为基础的制备工艺首采用有机溶媒溶解磷脂,通常是氯仿或氯仿和甲醇的混合物,然后旋转蒸发去溶媒形成干燥的磷脂膜,最后水化磷脂膜形成多层脂质体。此方法的缺点是使用毒性较大的有机溶媒,且难以完全除去,此外,形成的多层脂质体层与层之间药物浓度不均一,需反复冻融处理[55]。以乙醇注入法为基础的制备工艺虽然可以大规模生产,但是该方法通常需要在高温条件下(60℃左右)制备,容易引起芯材在加工过程中的氧化、水解甚至失去活性[55]。逆相蒸发法制备工艺简单,适用于大规模工业生产。其具体做法是将类脂溶于乙醇或乙醇混合物有机溶剂中,然后直接加入水溶性介质以形成油包水型的乳液,之后真空下蒸发(冷冻干燥)溶剂,此时的芯材和壁材大部分转移到水相中并沉淀析出,可制得脂质体混悬液。此法包埋率高,可形成大的单层球,且颗粒较均匀、稳定[56]。
3.2.2 固体脂质纳米粒 固体脂质纳米粒(SLN)是由脂质(类固醇、脂肪酸、部分甘油酯、蜡、甘油三酸酯)组成的胶体系统,它们在室温下为固体[57]。固体脂质纳米粒是继乳液、聚合物微粒、脂质体后,近几年发展起来的一种新型毫微粒封装系统。既具备聚合物微粒稳定性高,释放性慢的优势,又兼具脂质体的低毒性,能大规模生产的优点,且具有更好的生物相容性及良好的靶向性[58],因此是一种极有发展前景的新型给药系统的载体。
关于固体脂质纳米粒的研究已有不少报道,研究显示采用棕榈酸十六烷基酯(CP)-菜籽油(CO)混合固体脂质核复合凝聚壳构成的岩藻黄质纳米粒,在模拟胃肠条件下具有更好地缓释能力,且其稳定性也更强[36]。RUKTANONCHAI U等[59]制备了由不同比例的棕榈酸鲸蜡酯和γ-谷维素组成的固体脂质纳米颗粒,研究发现随着核心结构变得更加致密,核心化合物的迁移可能会更加受阻,从而抑制过分释放。此外,WANG X X等[60]开发负载岩藻黄质的棕榈硬脂精纳米固体脂质体,与游离岩藻黄质相比,前者在光、温度和湿度方面表现出更高的稳定性和更强的释放性能。因此,采用固体脂质核作为岩藻黄质的稳态化载体是十分具有应用前景的。
固体脂质纳米粒的常用制备方法有高压均质法、微乳化法、溶剂蒸发法等[61],其原理大致与纳米脂质体的制备方法相似。不同于纳米脂质体的是,由于固体脂质的疏水特性,通常还需要在外层包裹水溶性壁材,以维持其在体系中的稳定性。复合凝聚法是制备微胶囊的一种常见方法,原理是将两种带相反电荷的壁材做包埋物,芯材分散于其中后,通过改变体系的pH值,使两壁材正负电荷交联形成一种复合物,导致溶解度下降而凝聚析出形成微胶囊,该方法最常使用的壁材是明胶和阿拉伯胶。利用复凝聚法与固体脂质制备相结合即可以保护岩藻黄质免受环境影响,防止氧化,又有利于岩藻黄质的贮藏,且得到的微胶囊形态为均匀的球形,结构完整,不易发生破裂及芯材外露的情况[62]。通常制备中还需要加入固化剂类如甲醛、戊二醛等,由于醛交联剂毒性较大,采用单宁酸作为固化剂可以克服传统方法的毒性及对岩藻黄质的破坏性[61]。
3.3 纳米乳液技术 纳米乳液平均半径非常小(50~500 nm)也被称为亚微米乳液和微型乳液。根据结构特点,纳米乳液可以分为单乳液(O/W或W/O)和双重乳液(W/O/W或O/W/O)[33,63]。
该载体的优势除了可以改善化合物的质地、口感等感官属性,还可以增强活性化合物在不同食物的溶解度和生物利用度,同时利用该技术开发新型功能性食品逐渐成为研究热点[63-65]。SALVIA-TRUJILLO L等[66]通过研究载体油组合物[中链甘油三酯(MCT)与长链甘油三酯(LCT)]和总载体油浓度(质量分数为1%或4%)在模拟消化过程中对物理稳定性、脂质消化率和类胡萝卜素负载纳米乳液生物可利用性的影响,得出通过使用低脂LCT纳米乳液或高脂MCT纳米乳液可提高类胡萝卜素的生物可利用性。而且,不同的乳剂在效率封装和释放特性上会表现出差异:通过不同表面活性剂(乳清分离蛋白、改性卵磷脂和阿拉伯胶)制得岩藻黄质的乳状液,并对其性能进行评价,结果发现天然乳化剂对岩藻黄质稳定性及消化特性影响最显着[67]。
尽管岩藻黄质纳米乳液混合体系更为均一稳定,产品外形也能达到消费者满意的感官需求,具有较好的应用前景,但由于其对设备要求高,所制备的产品成本偏高,并且许多乳化剂达不到食品级[68],制约了岩藻黄质纳米乳广泛应用。
4 总结与展望
上述类型制剂尚未被大规模生产,主要是制备所需材料的安全性,工业化生产方法包括工艺方案、参数的确认,药物释放机制,体内药物动力学,以及药效学等方面的探讨和研究还不够深入,这些仍需要不断完善来克服目前岩藻黄质包埋制剂所存在的问题[69]。
笔者对岩藻黄质在微胶囊、脂质体、纳米乳液这3种稳态化剂型的研究现状进行了归纳总结,并针对不同制剂提出适合规模化生产的方法。接下来需要进一步研究最适合岩藻黄质制品产业化的制备工艺条件,更深入地对岩藻黄质稳态化产品进行后续稳定性、生物利用度、及生物活性与活性机理等方面的持续研究。不同包埋方法在体内生物利用度方面的差异较大,因此不同岩藻黄质的包埋产品生物利用度的差异性研究也将成为下一步研究的重点。



