赵 元,黄晨存,黄诗怡,袁志鹰,许光明
(湖南中医药大学药学院,湖南 长沙 410208)
玄参为玄参科植物玄参(Scrophularia ningpoensis Hemsl.)的干燥根,且为药食两用的药材。环烯醚萜类和苯丙素苷类是玄参属植物的主要化学成分,药理研究表明其具有降血压、抗血小板聚集、增强免疫功能、降血糖、抗氧化和抗肿瘤等作用[1]。2020年版《中华人民共和国药典》规定玄参主要成分为哈巴苷、哈巴俄苷[2]。玄参目前的药用部位是其块根部分。玄参种芽为玄参生长的地下根芽,现作为繁育或栽培用的繁殖组织。玄参种芽的产量大,但用于繁育的量不多,造成了大量玄参种芽的资源浪费[3-4]。前期研究[5-8]发现,玄参种芽中的化学成分与市面流通的玄参药材的药用化学成分高度相似,故可从化学成分入手,对玄参种芽进行相关研究,开发玄参种芽资源。目前,市面上玄参中哈巴苷等有效成分的提取主要使用传统的热水煎煮法或回流提取[9-10],该方法耗时长、需高温处理且提取效率低,且哈巴俄苷具有热不稳定性[11-12]。因此,笔者拟采用超声辅助提取玄参种芽的有效成分,参考文献[13-14]选择不同料液比、浸泡时间和提取液浓度采用单因素试验结合响应面分析法优化玄参种芽提取工艺,通过HPLC法测定其含量[15-16],得出玄参种芽最佳提取工艺,从而提高玄参种芽的提取效率,为后续玄参种芽研究提供理论依据与基础。
1 仪器与试药
1.1 仪器 Waters e2695型高效液相色谱仪(美国Waters公司);Kromasil C18柱(250 mm×4.6 mm,5 μm)(瑞典Nouryon公司);ISO9001型电子天平(北京赛多利斯仪器系统有限公司);040SD型超声波清洗机(深圳市超洁科技实业有限公司);GM-0.33A型隔膜真空泵(上海申生科技有限公司);WGL-125B型电热鼓风干燥箱(天津市泰斯特仪器有限公司)。
1.2 药物与试剂 玄参种芽采自湖南新邵常春藤种植基地,经湖南中医药大学药学院中药鉴定教研室周小江教授鉴定为玄参科植物玄参(Scrophularia ningpoensis Hemsl.);哈巴苷对照品(批号:DST220312-058,纯度≥98%)、哈巴俄苷对照品(批号:DST220113-059,纯度≥98%)均购自四川省维克奇生物科技有限公司;甲醇(色谱纯)、乙腈(色谱纯)、磷酸(分析纯)均购于美国TEDIA公司;实验用水为超纯水。
2 方法与结果
2.1 哈巴苷、哈巴俄苷的含量测定
2.1.1 色谱条件 Kromasil C18柱(250 mm×4.6 mm,5 μm);流动相为0.1%磷酸水溶液(B)-乙腈(A),梯度洗脱,洗脱程序为0~5 min,5%A~20%A;5~10 min,20%A~25%A;10~20 min,25%A~33%A;20~25 min,33%A~50%A;25~30 min,50%A~80%A;30~35 min,80%A;35~40 min,80%A~95%A;40 ~50 min,95%A~5%A;体积流量为1 mL/min;检测波长为210nm;柱温为30 ℃;进样量为20 μL。色谱图见图1。
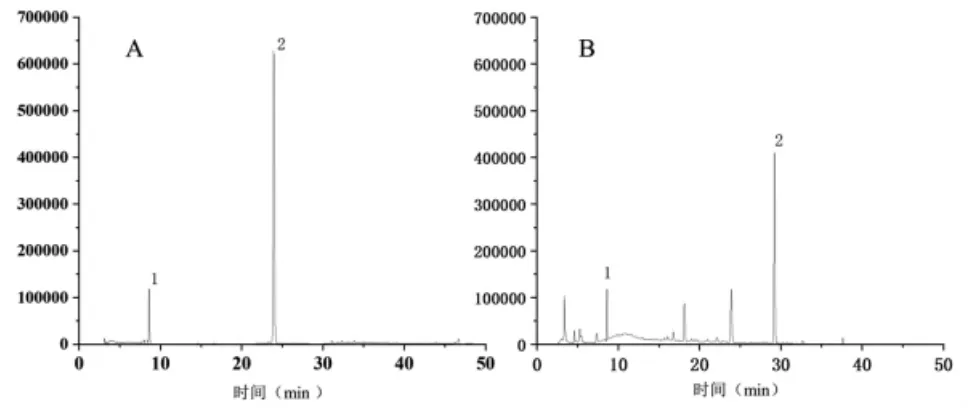
图1 HPLC 图
2.1.2 溶液的制备
2.1.2.1 混合对照品溶液的制备 分别精密称定哈巴苷对照品、哈巴俄苷对照品适量,加入甲醇配制成哈巴苷、哈巴俄苷质量浓度分别为0.500、0.340 mg/mL的混合对照品溶液。
2.1.2.2 供试品溶液的制备 玄参种芽采收后洗净表面泥沙,进行发汗处理,将处理过后的玄参种芽粉碎成粉,精密称取1.000 0 g,置于具塞锥形瓶中,分别加入不同浓度甲醇,密塞,称定质量,浸泡一定时间,超声处理(功率:500 W,频率:40 kHz)30 min,放冷,再称定质量,用甲醇补足减失质量,摇匀,滤过,取续滤液,即得。
2.1.3 线性关系考察 取“2.1.2.1”项下的混合对照品溶液用甲醇稀释至不同浓度梯度,经0.22 μm微孔滤膜过滤后,取20 μL,按照“2.1.1”项色谱条件进样分析,以浓度为横坐标(x),对应的高效液相色谱峰面积为纵坐标(y),绘制标准曲线。结果哈巴苷、哈巴俄苷的回归方程分别为y=5 354 876x+37 356(r=0.999 6)、y=29 309 518x+2 563(r=0.999 6)。表明哈巴苷、哈巴俄苷分别在15.63~500.00 μg/mL、10.63~340.00 μg/mL范围内线性关系良好。
2.1.4 精密度试验 精密吸取供试品溶液20 μL,连续进样6次,测定各对照品峰面积。结果哈巴苷、哈巴俄苷峰面积的RSD分别为0.80%、1.98%,表明仪器精密度良好。
2.1.5 稳定性试验 取供试品溶液20 μL,分别于0、2、4、8、16、24 h按“2.1.1”项下色谱条件进行分析,测定各对照品峰面积。结果哈巴苷、哈巴俄苷峰面积的RSD分别为1.27%、1.87%,表明供试品溶液在24 h内稳定性良好。
2.1.6 重复性试验 平行制备6份供试品溶液,每次进样20 μL,按“2.1.1”项下色谱条件进行分析,测定各对照品峰面积。结果哈巴苷、哈巴俄苷峰面积RSD分别为1.05%、1.49%,表明方法重复性良好。
2.1.7 加样回收率试验 分别取6份同一批已知含量样品0.500 0 g,加入混合对照品溶液,按“2.1.2.2”项下方法制备,按“2.1.1”项下色谱条件测定,计算加样回收率。结果哈巴苷、哈巴俄苷平均回收率分别为100.24%、100.56%,RSD分别为1.98%、1.19%,表明方法准确度良好。(见表1)
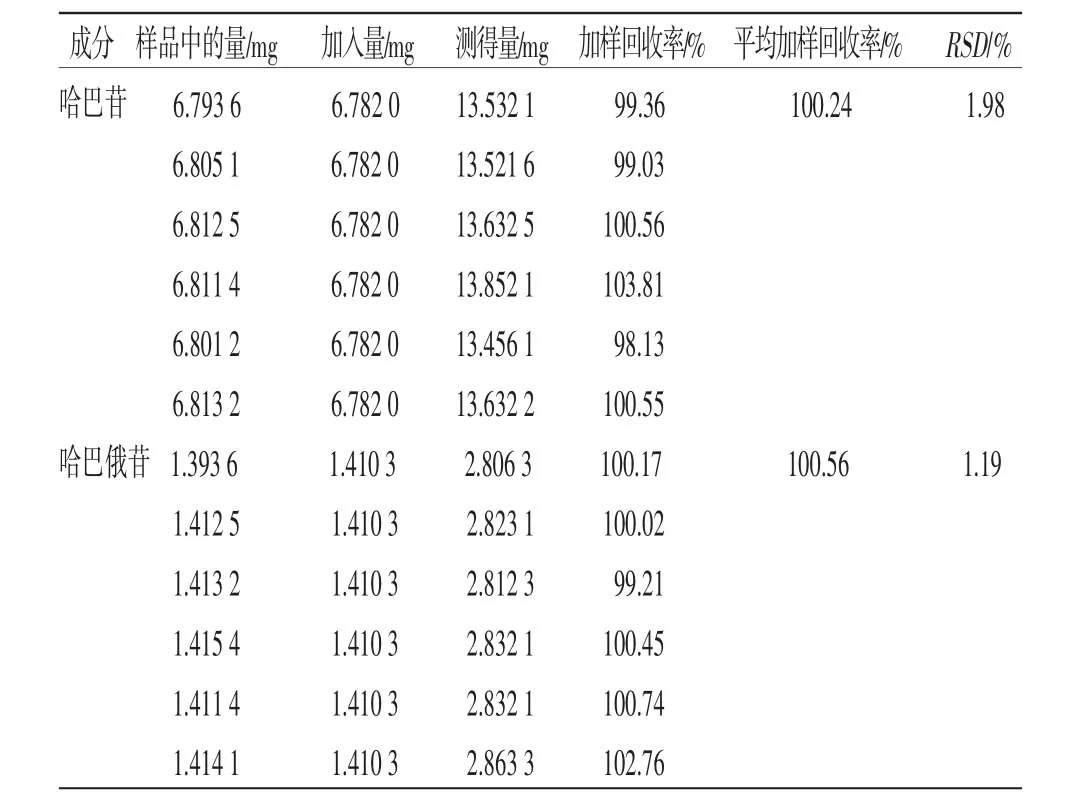
表1 加样回收率试验结果 (n=6)
2.2 单因素试验 固定料液比为1∶50(g/mL),浸泡时间为30 min,考察不同甲醇浓度(30%、40%、50%、60%、70%)对玄参种芽提取的影响,筛选出最佳甲醇浓度;然后将其作为最佳条件固定,再分别考察料液比[1∶25、1∶50、1∶75、1∶100、1∶125(g/mL)]、浸泡时间(10、20、30、40、50 min)对玄参种芽提取的影响。每次改变1个因素,考察完1个因素后,将其最佳条件作为下1个因素的固定条件,直至完成全部单因素试验。
2.2.1 甲醇浓度对提取的影响 经不同浓度甲醇提取后,哈巴苷、哈巴俄苷的含量随甲醇浓度的升高均呈现先升高后降低趋势,且分别在40%甲醇、60%甲醇时达到最高值;哈巴苷与哈巴俄苷总含量随甲醇浓度的升高也呈现先升高后降低趋势,并在40%甲醇时达到最高值。故选择35%、40%、45%甲醇进行响应面试验。(见图2A)
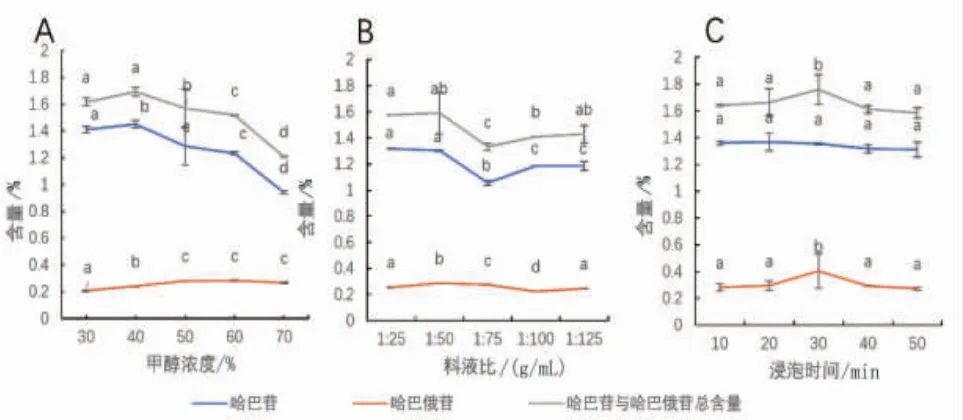
图2 甲醇浓度(A)、料液比(B)及浸泡时间(C)对提取的影响图
2.2.2 料液比对提取的影响 经不同体积甲醇提取后,哈巴苷、哈巴俄苷的含量分别在料液比1∶25、1∶50时达到最高值;哈巴苷与哈巴俄苷总含量随料液比的升高呈现先升高后降低再升高的变化趋势,即1∶50>1∶25>1∶125>1∶100>1∶75,故选择1∶40、1∶50、1∶60料液比(g/mL)进行响应面试验。(见图2B)
2.2.3 浸泡时间对提取的影响 经不同时间浸泡提取后,哈巴苷、哈巴俄苷的含量分别在20 min、30 min达到最高值;哈巴苷与哈巴俄苷总含量随料液比的增加呈现先升高后降低的变化趋势,即30 min>20 min>10 min>40 min>50 min,故选择浸泡时间25、30、35 min进行响应面试验。(见图2C)
2.3 Box-Behnken响应面试验
2.3.1 响应面设计 根据响应面试验设计(Box-Behnken design,BBD)原理,在单因素试验基础上,利用Design Expert 10设计实验,以料液比(A)、甲醇浓度(B)、浸泡时间(C)作为自变量,以哈巴苷、哈巴俄苷总含量为考察指标,建立3因素3水平共17个实验组合响应面分析试验数学模型对玄参种芽超声提取工艺进行优化[18]。设计因素与水平见表2,Box-Behnken结果见表3。

表2 Box-Behnken 设计因素水平
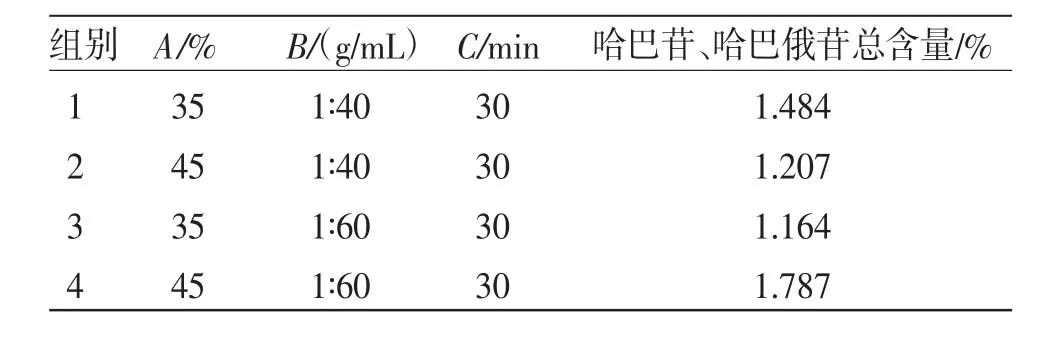
表3 Box-Behnken 响应面设计及结果
2.3.2 模型拟合及分析 运用Design Expert软件对以上结果进行方差分析,得回归方程:Y=1.72+0.069A+0.071B-0.063C+0.22AB-0.061AC+0.14BC-0.11A2-0.20B2+0.029C2,r=0.983 8。模型的方差分析结果见表4。线性模型F=23.53,P=0.000 2,表明该回归方程差异性显着。失拟项P=0.582 8,说明该实验设计数据可靠。方差分析结果表明,在所选的各因素水平范围内,按照对哈巴苷、哈巴俄苷总含量影响大小排序为A>C>B,除C2外,均达到显着水平,其中甲醇浓度和浸泡时间为极显着。
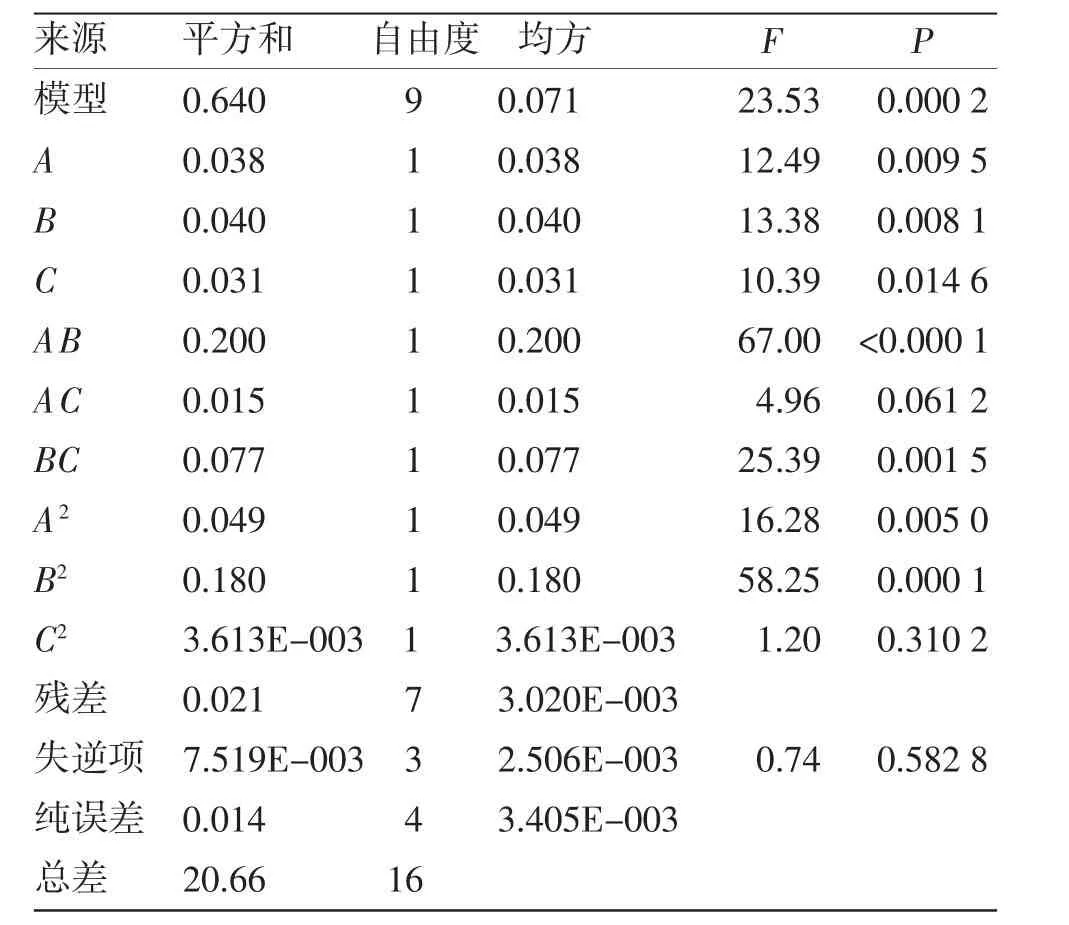
表4 模型方差分析
2.3.3 响应面优化结果 通过Design Expert 12.0软件绘制各指标与响应值交互项的响应面图,可直观评价各因素对玄参种芽中哈巴苷、哈巴俄苷总含量的影响。结果显示随着各因素的增加哈巴苷、哈巴俄苷总含量均呈现先增加后逐渐减少的趋势。甲醇浓度和浸泡时间的曲面较陡峭,提示甲醇浓度和浸泡时间对哈巴苷、哈巴俄苷总含量影响较明显。这与二次回归模型中的方差分析结果一致。(见图3~5)
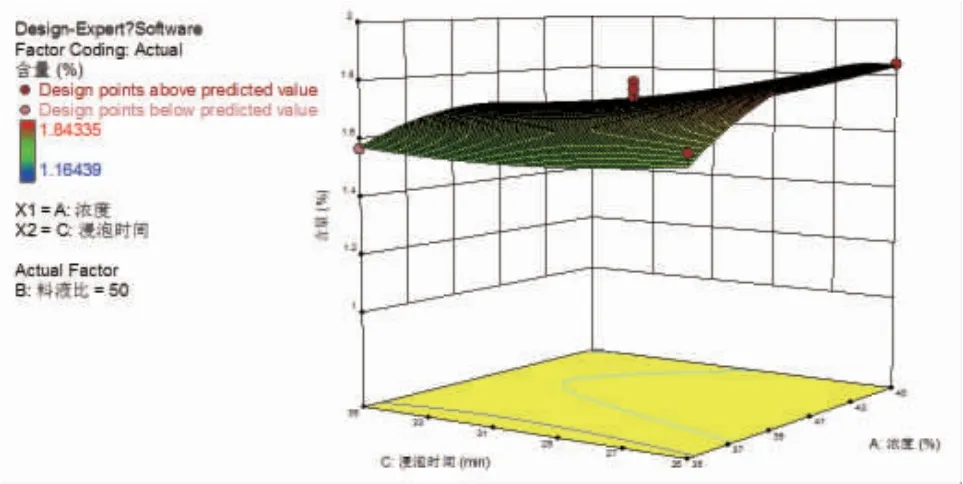
图4 甲醇浓度与浸泡时间的交互作用响应面图
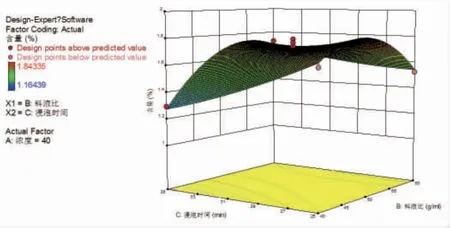
图5 料液比与浸泡时间的交互作用响应面图
2.3.4 验证试验 通过响应面模型分析,预测最优玄参种芽提取工艺为甲醇浓度44.34%、料液比1∶51、浸泡时间25.41 min,哈巴苷、哈巴俄苷总含量为1.84%。
为检验以上响应面分析数据的可靠性,同时为了操作方便,本研究参数采用甲醇浓度44%、料液比1:50、浸泡时间25 min,进行3组平行试验。结果实际测得哈巴苷、哈巴俄苷总含量分别为1.81%、1.86%、1.78%,RSD均小于2%。提示应用响应面分析法优化得到的玄参种芽最佳提取条件准确、可靠,提取工艺具有良好的可行性及重复性。
3 讨论
玄参具有清热凉血、滋阴降火、解毒散结之效,并在四妙勇安汤、增液承气汤、清营汤等多个方剂中有重要应用。玄参种芽产量高,仅用于繁育,资源浪费严重,极具开发价值。本课题组在玄参种芽与玄参化学成分研究的基础上,对玄参种芽提取工艺进行研究。
单因素试验可以看出:哈巴苷、哈巴俄苷总含量在甲醇浓度40%时达到最大值。环烯醚萜类成分在40%的甲醇溶液中的溶解性最好。当料液比较小时,玄参种芽提取不完全,这在一定程度上降低了哈巴苷、哈巴俄苷的含量;而料液比过大时,由于传质阻力,过量的溶剂不再起到提取的作用,反而会降低哈巴苷、哈巴俄苷的含量。随着浸泡时间的延长,哈巴苷、哈巴俄苷总含量呈现先升高后降低的变化趋势;当浸泡30 min时,超声提取所得的哈巴苷、哈巴俄苷总含量最高;随着浸泡时间的延长,哈巴苷、哈巴俄苷总含量下降,如浸泡50 min后哈巴苷、哈巴俄苷总含量为最高总含量的90%左右。这可能是由于浸泡时间过短,玄参种芽粉末不能很好地分散,甚至聚集在溶剂中,因接触面积的减少而影响了哈巴苷、哈巴俄苷的含量;浸泡时间过长会使玄参粉末中的糖类、蛋白质等扩散出来,形成胶团依附于粉末表面,阻碍了环烯醚萜类的溶出,导致哈巴苷、哈巴俄苷含量降低。
本研究以玄参种芽为研究对象,以2020年版《中华人民共和国药典》[2]规定玄参主要成分哈巴苷、哈巴俄苷含量为指标,在单因素试验基础上,通过Box-Behnken设计试验方案[18-19]研究3个影响因素间的交互作用,再进行回归分析[20-21],从而得到影响因素的最佳组合与响应值的最优值[22-23]。玄参种芽哈巴苷、哈巴俄苷最佳提取工艺为甲醇浓度44%、料液比1∶51、浸泡25 min。该工艺稳定可靠,有助于玄参种芽的提取,从中获取哈巴苷、哈巴俄苷等有效成分,可为玄参种芽资源开发提供理论依据[24-25]。



