刘 倩,黄艺晓,臧二欢,张明旭,李旻辉,2,3
(1.包头医学院,内蒙古 包头 014040;2.内蒙古自治区中医医院,内蒙古 呼和浩特 010020;3.内蒙古自治区中蒙医药研究院,内蒙古 呼和浩特 010010)
小秦艽(Gentiana dahurica Fisch.)又名达乌里龙胆、达乌里秦艽,为龙胆科(Gentianaceae)龙胆属[Gentiana(Tourn.)L.]植物。其作为药材秦艽的基原植物收录于2020年版《中华人民共和国药典》[1]中。小秦艽根略成纺锤形或圆柱形,长8~20 cm,直径0.2~1.0 cm;表面棕黄色或棕褐色,有纵向或扭曲的纵沟纹;主根通常为一个或分成数枝[2]。小秦艽具有祛风湿、清湿热、止痹痛、退虚热的功效,如与石膏、知母、花粉、枳实等配伍,可清热除烦,润肠通便[3],有极高的药用价值。小秦艽作为蒙医临床常用药,在内蒙古地区分布较广,但因其种子萌发率低和过度采挖,资源储备情况不容乐观[4-6]。目前其正面临着野生资源急速萎缩、栖息地被破坏、种植地不合理[7]及遗传多样性丧失等问题。小秦艽早在1987年被认证为三级国家重点保护野生药材物种,故加强小秦艽种质资源的研究及保护,以实现资源的可持续开发利用已刻不容缓。
近年来,随着分子生物学的快速发展,DNA分子标记技术在药用植物研究领域得到广泛应用[8-9],而核糖体DNA的内转录间隔区(internal transcribed spacer,ITS)是植物类DNA条形码鉴定的热门候选序列[10]。ITS由核DNA中nrDNA的18S与5.8S、26S间的两个基因间区(ITS1、ITS2)组成[11-12]。ITS区不加入成熟核糖体,表现出了极为广泛的序列多态性[13],同时其在长度上具有较好的保守性,适合于植物属、种级的系统发育和分类研究[14]。以ITS区作为分子鉴定手段,研究药用植物的遗传进化已有较为成熟的体系[15-16]。裴香萍等[17]通过ITS序列构建系统发育树对酸枣仁药材进行鉴定,结果表明不同来源的酸枣仁聚为一支,伪品枳椇子单独聚为一支,呈现出明显的单系性,且各正品酸枣仁与伪品枳椇子间的遗传距离明显大于酸枣仁各正品之间的遗传距离。因此,通过ITS序列进行建树能够成功鉴别酸枣仁及其伪品枳椇子。邱智敏等[18]通过分析和比较秋茄树的ITS序列,研究不同引种居群间的遗传分化和变异情况,揭示秋茄树的遗传多样性水平随纬度升高而增加,由此可阐明不同地理区域环境对秋茄树适应性分化的影响。本实验利用ITS序列分析内蒙古不同产地、不同生长环境的小秦艽样品的遗传多样性,以期对小秦艽种质资源的保护和发展提供一定的参考价值。
1 材料
1.1 小秦艽样品 采集内蒙古不同产地的野生小秦艽样品共62份,经内蒙古科技大学包头医学院张春红教授鉴定为龙胆科龙胆属植物小秦艽(Gentiana dahurica Fisch.),采集的新鲜样品经硅胶干燥后保存待测。样品采集信息见表1。
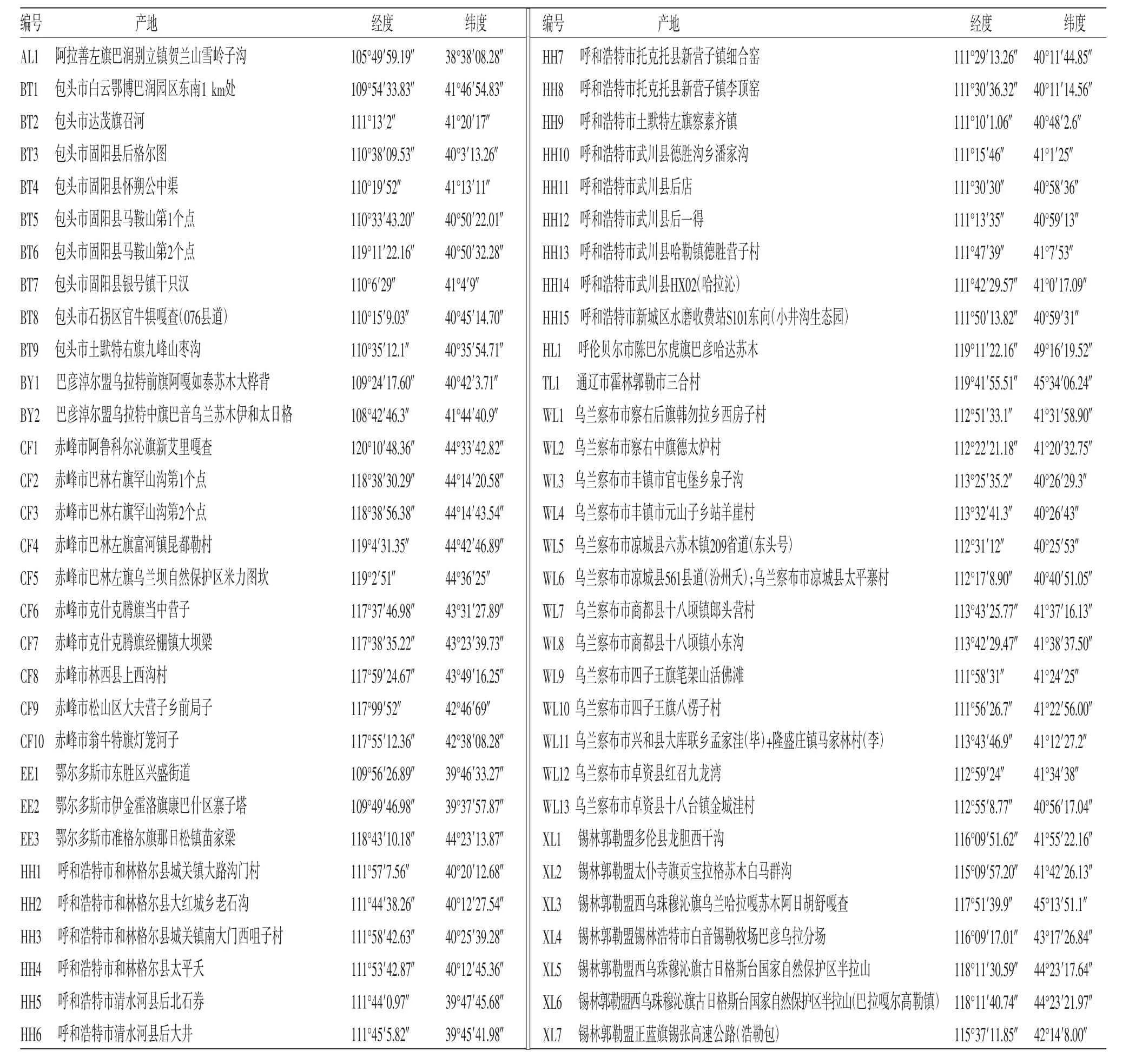
表1 小秦艽样品采集地信息
1.2 试剂 植物基因组DNA提取试剂盒(离心柱型)(批号:W9909)、TIANSeq高保真PCR反应预混液(NG219)(批号:X0725)、50×TAE Buffer(批号:X0414)均购自天根生化(北京)科技有限公司;GelStain核酸染色剂(10 000×水溶液)(批号:20210702)购自宝日医生物技术(北京)有限公司;Agarose琼脂糖(EZ3454B228)购自广州赛国生物科技有限公司;DL1000 DNA Marker(批号:3591A)购自TaKaRa公司;巯基乙醇(批号:M8210)、氯仿(批号:20220114)均购自福晨(天津)化学试剂有限公司;无水乙醇(批号:20211018)购自天津市风船化学试剂科技有限公司。
1.3 仪器 Tone 96G型PCR扩增仪(德国耶拿分析仪器股份公司);H3018DR型高速冷冻离心机(上海知信实验仪器技术有限公司);JX-10型干式恒温器金属浴(上海净信实业发展有限公司);OD-1000分光光度计(One Drop)、GoodSee-5型薄层色谱成像仪(上海科哲生化科技有限公司);1704482水平电泳仪(BIO-RAD);AL204型电子天平(梅特勒-托利多公司);KJXH-Ⅱ型旋涡混合器(江苏康捷医疗器械有限公司)。
2 方法
2.1 DNA提取 取小秦艽样品(全草)约35 mg,加入液氮充分碾磨;采用植物基因组DNA提取试剂盒提取总DNA。
2.2 DNA浓度检测 取1 μL已提取的DNA溶液样品,用分光光度计测定所提取的DNA的浓度。
2.3 PCR扩增
2.3.1 引物 本研究使用的引物ITS2(5’-ATGCGATACTTGGTGTGAAT-3’)和ITS3(5’-GACGCTTCTCCAGACTACAAT-3’)由生工生物工程(上海)股份有限公司定制合成。引物稀释至10 μmol/L。
2.3.2 反应体系 反应体系体积为25 μL,其中DNA模板1 μL,正、反引物各1 μL,TIANSeq高保真PCR反应预混液(NG219)12.5 μL,并用ddH2O补足剩余体积。
2.3.3 循环参数 通过前期实验对反应条件的多次考察,最终确定94 ℃预变性2 min;98 ℃变性10 s,58 ℃延伸30 s,68 ℃复性15 s,共35个循环;68 ℃5 min;4 ℃保存30 min。
2.4 电泳 取1.0 g Agarose溶解于100 mL的1×TAE Buffer,于60 ℃加入10 μL的GelStain核酸染色剂(10 000×水溶液),混匀,冷却;用1%的琼脂糖凝胶,取PCR产物和Marker各5 μL,点样,于160 V、400 mA条件下电泳35 min。
2.5 PCR产物测序 将PCR产物测序,产物均由生工生物工程(上海)股份有限公司测序,每个样品均采用正、反双向测序。
2.6 构建系统发育树 用Bio Edit软件查看测序峰图,核对前后截取位点;再用CLC Sequence Viewer 8软件查看结果序列并转化格式;最后用MEGA(Molecular Evolutionary Genetics Analysis)11.0软件进行多重序列比对,根据Kimura-2-parameter(K2P)计算遗传距离,采用邻位相接法(NJ法)利用样品ITS2序列构建系统发育树。
2.7 龙胆苦苷含量测定 前期课题组对相似采样点的小秦艽样品进行含量测定分析,方法依照2020年版《中华人民共和国药典》一部秦艽中龙胆苦苷高效液相色谱法含量测定的要求。
3 结果
3.1 各样品DNA浓度 采集的各样品提取的DNA浓度见表2。

表2 DNA 浓度检测表
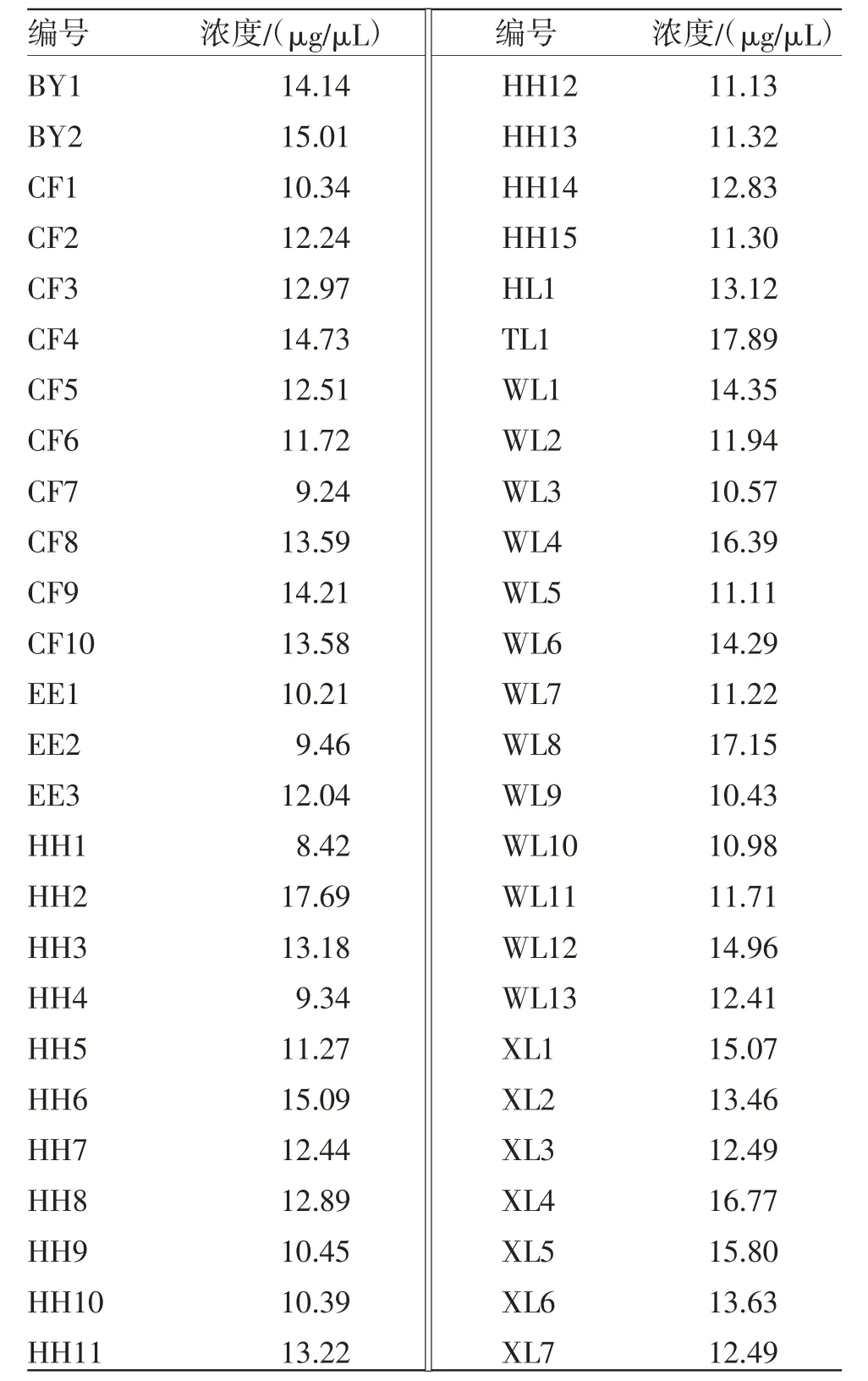
续表2:
3.2 PCR产物凝胶电泳 采集的各样品PCR产物凝胶电泳图见图1。

图1 小秦艽样品凝胶电泳图
3.3 序列分析 测得的62条序列中恒定位点(C)、变异位点(V)、简约信息位点(Pi)和单态位点(S)的个数分别为318、129、75和54,其中变异位点占28.79%(129/448)。根据MEGA11.0软件分析结果显示,所有样品总位点数(Number Sites)为448。
3.4 遗传距离 通过MEGA 11.0软件检测不同产地的小秦艽ITS2基因序列的遗传距离,种内遗传距离范围为0.000 0~0.263 2,平均种内遗传距离为0.049 4。
3.5 系统发育分析 根据NJ树结果显示,62份小秦艽样品分为两支,编号为BT1(采自包头市白云鄂博巴润园区东南1 km处)和BY1(采自巴彦淖尔盟乌拉特前旗阿嘎如泰苏木大桦背)的样品聚为一个小分支,其余60份样品聚为一个大的分支。通过ITS2序列构建的系统发育树见图2。
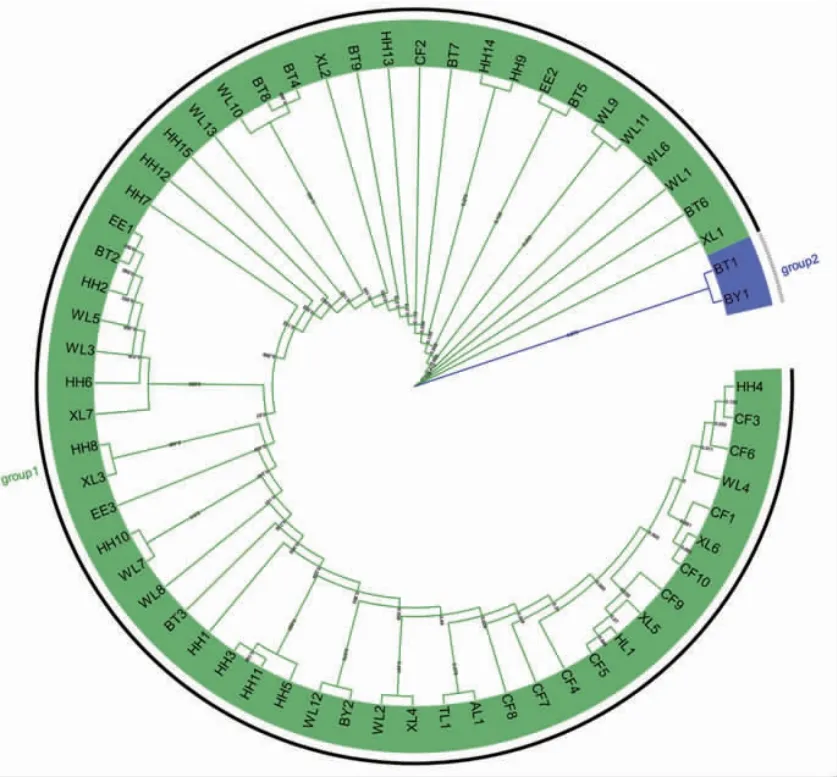
图2 ITS2 序列构建系统发育树
3.6 样品龙胆苦苷含量比较分析 根据课题组小秦艽前期实验研究中相似采样点样品的主要有效成分龙胆苦苷含量,比较发现聚在小分支上的BTI和BY1有相似的龙胆苦苷含量;同样的,聚在另一大支上的WL1、CF9、XL6、XL2、BT9、XL1、HH13、BT5、BT4、WL3、HH14、WL9、WL2和CF1的龙胆苦苷含量相似。具体样品含量见表3。

表3 小秦艽样品中龙胆苦苷含量
4 讨论
本实验研究了62份内蒙古不同产地的小秦艽样品的ITS序列,探索其在不同地理环境下的遗传变异情况。从NJ树上来看,编号为BT1(采自包头市白云鄂博巴润园区东南1 km处)和BY1(采自巴彦淖尔盟乌拉特前旗阿嘎如泰苏木大桦背)的样品聚为一支,说明有较近的亲缘关系。深入分析这两份样品的序列,可以发现BTI和BY1有46个相同的变异位点,占各自变异位点的48.4%(46/95)和85.2%(46/54);二者有3个特征变异位点,分别为104 bp-G,155 bp-G,251 bp-A。在相似的遗传变异条件下,以张明旭等[5]内蒙古不同产地小秦艽中主要有效成分龙胆苦苷含量测定结果为参考,发现BTI和BY1有相似的龙胆苦苷含量;同样的,聚为另一大支的小秦艽样品中WL1、CF9、XL6、XL2、BT9、XL1、HH13、BT5、BT4、WL3、HH14、WL9、WL2和CF1的龙胆苦苷含量相似。然而,影响贡献率较大的生态因子在各个样品中存在显着差异,进一步排除生态环境对于龙胆苦苷含量的影响,由此推测小秦艽主要有效成分龙胆苦苷的含量可能与遗传变异过程相关。
样品BT1和HH4(采自呼和浩特市和林格尔县太平夭),BT1和AL1(采自阿拉善左旗巴润别立镇贺兰山雪岭子沟)遗传距离最大,均为0.236 2,说明其存在明显的遗传变异差异。考虑地理距离较大的原因,推测地理环境因素在一定程度上影响了小秦艽的生物进化过程。这样的推测也被研究证实,如张明旭等[7]采用增强回归树模型对内蒙古小秦艽的生态适宜区进行了模拟,研究影响其生长的生态因子,结果表明,海拔和土壤类型对于小秦艽的生长分布有显着的影响。根据系统发育树,可看出在同一地域生长的样品并不一定包含在同一个分支内,不同地域生长的样品也可能包含在同一个分支中,表明不同的小秦艽样品之间存在遗传的变异,但是差异并不显着。不同产地的小秦艽样品存在一定程度的基因交流,但并不完全按照地理分布聚类。除了地理因素之外,还有许多因素影响着生物的遗传与进化,还需进一步的研究和探索[19]。
遗传多样性使物种进化潜力和生物多样性得到了相对有效的保障。一般情况下,遗传变异越丰富,适应环境的能力就越强,越容易扩展其分布范围[20]。在漫长的演化过程中,多种因素会影响物种的遗传多样性,自然选择及繁育系统等都是导致种群遗传变异的重要因素之一[21]。因此,选择DNA分子技术—ITS序列有助于研究药用植物小秦艽种质资源遗传多样性,了解种内遗传变异的大小及其与环境的关系,从而保护及发展小秦艽种源优势。



