岳思恩,狄 岩,陈晓珩
(北京中医药大学东直门医院,北京 100700)
桥本甲状腺炎(Hashimoto thyroiditis,HT)也称为慢性淋巴细胞性甲状腺炎,是最普遍的器官特异性自身免疫性疾病[1]。HT的特点是甲状腺组织淋巴细胞浸润并伴有特异性抗体的产生,其中甲状腺过氧化物酶抗体(Thyroid peroxidase antibody,TPOAb)和甲状腺球蛋白抗体(Thyroglobulin antibody,TGAb)是最重要的致病抗体[2]。HT会引起甲状腺组织的慢性炎症,疾病后期常伴有甲状腺功能改变[3]。目前主要采用糖皮质激素、左旋甲状腺素和特定饮食治疗HT,但其有效性遭到质疑。因此,开发新的药物改善HT过程中的甲状腺功能和病理形态具有重要意义[4]。活血消瘿方(Huoxue Xiaoying Fang,HXXYF)是活血化瘀、散结消瘿的有效方[5]。已有研究[6]显示,活血消瘿片可降低桥本甲状腺炎伴结节患者TPOAb和TGAb水平,疗效较好。但关于HXXYF对HT大鼠甲状腺功能和病理形态的影响尚不清楚。相关研究显示,抑制Notch通路来调节调节性T细胞(regulatory T cell,Treg)/辅助性T细胞17(Thelper17cell,Th17)平衡可对HT小鼠发挥保护作用[7]。但HXXYF能否通过调控Notch/Treg/Th17通路影响HT大鼠甲状腺功能和病理形态尚不明确。因此,本研究主要探究HXXYF对HT大鼠甲状腺功能和病理形态的影响及其作用机制。
1 材料与方法
1.1 实验动物 SPF级雌性SD大鼠共84只,8周龄,体质量为230~240 g,购自北京华阜康生物科技股份有限公司,动物生产许可证号:SCXK(京)2019-0008。本实验严格遵守本院动物饲养标准,实验动物使用许可证号:SYXK(京)2020-0013,并通过伦理委员会审批(批号:2021-00926)。
1.2 药物与试剂 HXXYF由北京中医药大学东直门医院药剂科提供,主要由土鳖虫10 g、蜣螂虫10 g、桃仁10 g、蜈蚣5 g、猫爪草10 g、柴胡10 g、王不留行10 g、莪术10 g等组成,将上述药物用250 mL水浸泡30 min后煎煮至200 mL,滤出滤渣收集滤液150mL,再向滤渣中加入200mL水煎煮至150mL,合并两次滤液,用生理盐水稀释成生药质量浓度为2.112 g/mL保存于4 ℃冰箱,用于后续实验。
碘化钠(上海金穗生物科技有限公司,批号:J43587);猪甲状腺球蛋白(上海经科化学科技有限公司,批号:JKH0040);弗氏完全佐剂(批号:F5881)、弗氏不完全佐剂(批号:F5506)均购自上海瓦兰生物科技有限公司;左旋甲状腺素钠(levothyroxine sodium,LTSD)(武汉峰耀同辉化学制品有限公司,批号:S20193);Notch激活剂Jagged1(美国MCE公司,批号:HYP1846A);大鼠游离三碘甲状腺原氨酸(free triiodothyronine,FT3)(批号:EK-R38601)、游离甲状腺素(Free Thyroxine,FT4)(批号:EK-R38599)、促甲状腺激素(Thyroid-stimulating hormone,TSH)(批号:EK-R37067)、TPOAb(批号:EK-R37527)、TGAb(批号:EK-R37664)、白细胞介素(interleukin,IL)-17ELISA试剂盒(批号:EK-R36872)、IL-10 ELISA试剂盒(批号:EK-R36786)均购自上海酶研生物科技有限公司;大鼠外周血淋巴细胞分离试剂盒(武汉赛奥斯生物科技有限公司,批号:MED-1019);流式抗体Rat-APC-IL-17(批号:73812-80-50)、Rat-FITC-CD4(批号:11-0040-85)、Rat-PEFoxp3(批号:61-5773-82)均购自北京孚博生物科技有限公司;兔源一抗叉头框蛋白P3(Forkhead Box Protein P3,Foxp3)(批号:ab215206)、Notch1(批号:ab167441)、GAPDH(批号:ab8245)、辣根过氧化物酶(HRP)标记的山羊抗兔二抗(批号:ab6721)均购自英国Abcam公司;维甲酸相关孤核受体γt(retinoic acid-related orphan receptor γt,RORγt)(北京百奥莱博科技有限公司,批号:K24419-OBS)。
1.3 主要仪器 iMark型酶标仪(美国伯乐公司);BD FACS Calibur型流式细胞仪(美国BD公司);CX53型光学显微镜(日本奥林巴斯公司);DYCZ24DN型蛋白电泳仪(北京六一仪器厂)。
1.4 分组与造模 按照随机数字表法将84只大鼠随机分为对照组(NC组)、模型组(Model组)、低剂量HXXYF组(HXXYFL组)、高剂量HXXYF组(HXXYF-H组)、左旋甲状腺素钠组(LTSD组)、Jagged1(Notch激活剂)组、HXXYF-H+Jagged1组,每组12只。除NC组外,其他组大鼠均构建HT模型,在第1周时向大鼠足垫处注射0.2 mL弗氏完全佐剂乳化的猪甲状腺球蛋白(4 mg/mL),2次/周以进行初次免疫,并在第2周和第4周分别一次性注射等剂量的不完全弗氏佐剂乳化的猪甲状腺球蛋白加强免疫[8]。根据TPOAb、TGAb水平变化确定造模是否成功[9]。全部造模成功后,进行给药处理。
1.5 实验给药 NC组大鼠饮用双蒸水,其他组大鼠均饮用0.05%碘化钠溶液直至造模结束。除NC组外,其他组大鼠均参照“1.4”所述方法构建HT模型,建模结束后,进行给药处理,HXXYF-L组、HXXYF-H组[10]、LTSD组[7]大鼠分别灌胃给予0.5g/kg HXXYF、2 g/kg HXXYF、0.1 mg/kg LTSD,且均腹腔注射等体积的生理盐水;Jagged1组[11]大鼠腹腔注射0.67 mg/kg Jagged1,且灌胃给予等体积的生理盐水;HXXYF-H+Jagged1组大鼠灌胃给予2 g/kg HXXYF且腹腔注射0.67 mg/kg Jagged1;NC组、Model组大鼠均灌胃给予等体积的生理盐水且腹腔注射等体积的生理盐水。给药1次/d,持续4周。
1.6 观察指标 末次处理24 h后,收集各组大鼠3 mL血液,经离心得血清,用于FT3、FT4、TSH、TPOAb、TGAb、IL-17、IL-10水平的检测;收集各组大鼠2mL外周血用于Treg、Th17比例的检测。血液收集完毕后,麻醉并处死大鼠,收集大鼠甲状腺组织,分为两部分,每部分包含每组6只大鼠甲状腺组织,一部分固定于4%多聚甲醛中用于HE染色,另一部分冻存于-80 ℃冰箱用于Western blotting实验。
1.6.1 ELISA法检测大鼠血清中FT3、FT4、TSH、TPOAb、TGAb、IL-17、IL-10水平 严格按照试剂盒说明书检测大鼠血清中FT3、FT4、TSH、TPOAb、TGAb、IL-17、IL-10水平。
1.6.2 流式细胞术检测各组大鼠外周血中Treg、Th17比例 利用大鼠外周血淋巴细胞分离试剂盒分离外周血单核细胞,且调整单核细胞密度为106个/mL。将50 μL单核细胞悬液加入流式管中,加入Rat-PE-Foxp3、Rat-FITC-CD4抗体来标记Treg细胞,在室温下避光孵育30 min,经洗涤、离心、重悬后,利用流式细胞仪分析Treg比例;将50 μL单核细胞悬液加入流式管中,并向流式管中加入Rat-APC-IL-17、Rat-FITC-CD4抗体来标记Th17细胞,在室温下避光孵育30 min,经洗涤、离心、重悬后,利用流式细胞仪检测Th17比例。
1.6.3 HE染色检测大鼠甲状腺组织病理变化 将固定于4%多聚甲醛中的甲状腺组织包埋在石蜡中,经脱蜡、水化后,切成4 μm厚的切片,将切片用HE染色后,利用显微镜观察切片病理变化。
1.6.4 Western blotting法检测甲状腺组织中Foxp3、RORγt、Notch1蛋白表达 在RIPA裂解缓冲液中裂解并提取甲状腺组织匀浆总蛋白,将蛋白质进行定量、电泳后,转移到PVDF膜,将膜用5%脱脂牛奶封闭后,将膜与一抗Foxp3(1∶2 000)、RORγt(1∶2 000)、Notch1(1∶2 000)、GAPDH(1∶2 000)在4 ℃下孵育过夜,然后与HRP标记的山羊抗兔二抗在常温下孵育1 h,加入ECL试剂可视化蛋白,使用Quantity One软件对蛋白条带光密度进行量化。
1.7 统计学方法 使用SPSS 22.0软件进行统计分析,符合正态分布且方差齐的数据以“均数±标准差”()表示,使用单因素方差分析进行多组间数据比较,进一步两组间比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 HXXYF对各组大鼠甲状腺功能的影响 与NC组比较,Model组大鼠血清中FT3、FT4水平降低(P<0.05),TSH水平升高(P<0.05);与Model组比较,HXXYF-L组、HXXYF-H组、LTSD组大鼠血清中FT3、FT4水平升高(P<0.05),TSH水平降低(P<0.05);与Model组比较,Jagged1组大鼠血清中FT3、FT4水平降低(P<0.05),TSH水平升高(P<0.05);与HXXYF-H组比较,HXXYFH+Jagged1组大鼠血清中FT3、FT4水平降低(P<0.05),TSH水平升高(P<0.05)。(见表1)
表1 各组大鼠血清中FT3、FT4、TSH 水平比较 ()
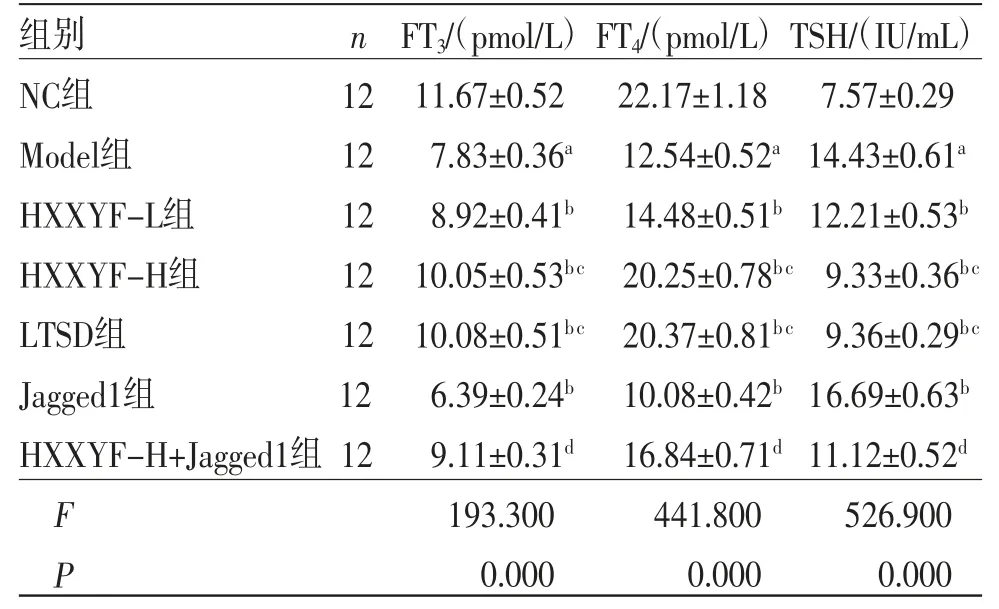
表1 各组大鼠血清中FT3、FT4、TSH 水平比较 ()
注:与NC组比较,aP<0.05;与Model组比较,bP<0.05;与HXXYF-L组比较,cP<0.05;与HXXYF-H组比较,dP<0.05。
?
2.2 HXXYF对各组大鼠甲状腺抗体分泌及炎性因子分泌的影响 与NC组比较,Model组大鼠血清中TPOAb、TGAb、IL-17水平升高(P<0.05),IL-10水平降低(P<0.05);与Model组比较,HXXYF-L 组、HXXYF-H 组、LTSD 组大鼠血清中TPOAb、TGAb、IL-17水平降低(P<0.05),IL-10水平升高(P<0.05);与Model组比较,Jagged1组大鼠血清中TPOAb、TGAb、IL-17水平升高(P<0.05),IL-10水平降低(P<0.05);与HXXYF-H组比较,HXXYF-H+Jagged1组大鼠血清中TPOAb、TGAb、IL-17水平升高(P<0.05),IL-10水平降低(P<0.05)。(见表2)
表2 各组大鼠血清中TPOAb、TGAb、IL-17、IL-10水平比较 ()
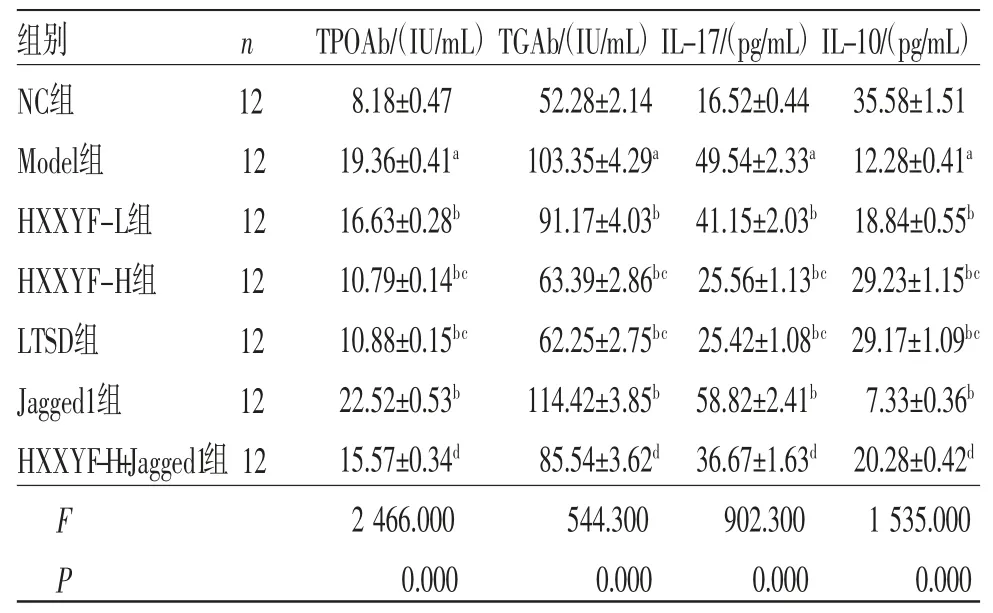
表2 各组大鼠血清中TPOAb、TGAb、IL-17、IL-10水平比较 ()
注:与NC组比较,aP<0.05;与Model组比较,bP<0.05;与HXXYF-L组比较,cP<0.05;与HXXYF-H组比较,dP<0.05。
?
2.3 HXXYF对各组大鼠外周血中Treg、Th17比例的影响 与NC组比较,Model组大鼠外周血中Treg比例降低(P<0.05),Th17比例升高(P<0.05);与Model组比较,HXXYF-L组、HXXYF-H组、LTSD组大鼠外周血中Treg比例均升高(P<0.05),Th17比例均降低(P<0.05);与Model组比较,Jagged1组大鼠外周血中Treg比例降低(P<0.05),Th17比例升高(P<0.05);与HXXYF-H组比较,HXXYF-H+Jagged1组大鼠外周血中Treg比例降低(P<0.05),Th17比例升高(P<0.05)。(见图1、表3)
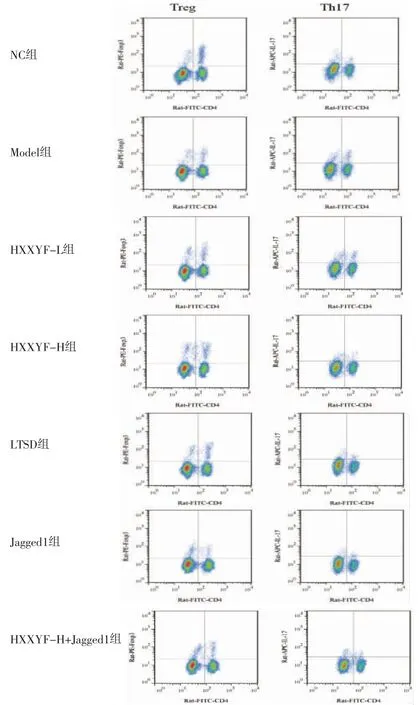
图1 各组大鼠外周血中Treg、Th17 流式图
表3 各组大鼠外周血中Treg、Th17比例比较 ()

表3 各组大鼠外周血中Treg、Th17比例比较 ()
注:与NC组比较,aP<0.05;与Model组比较,bP<0.05;与HXXYF-L组比较,cP<0.05;与HXXYF-H组比较,dP<0.05。
?
2.4 HXXYF对各组大鼠甲状腺组织病理变化的影响 NC组大鼠甲状腺滤泡完整且分布均匀,甲状腺组织中几乎没有炎症细胞浸润;Model组大鼠甲状腺滤泡紊乱,甲状腺滤泡周围可见大量炎症细胞浸润;与Model组比较,HXXYF-L组、HXXYF-H组、LTSD组大鼠甲状腺组织病理损伤减轻;与Model组比较,Jagged1组大鼠甲状腺组织病理损伤更为严重;与HXXYF-H组比较,HXXYF-H+Jagged1组大鼠甲状腺组织病理损伤加重。(见图2)
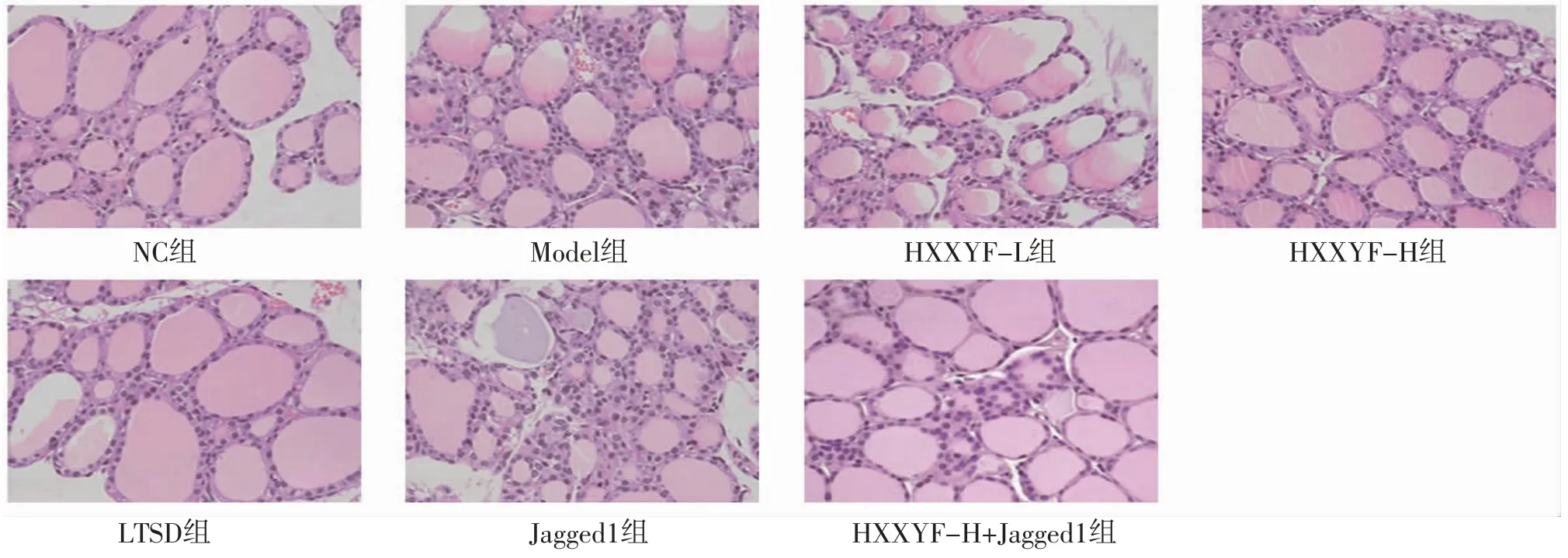
图2 各组大鼠甲状腺组织病理切片图 (HE,×200)
2.5 HXXYF对各组大鼠甲状腺组织中Foxp3、RORγt、Notch1蛋白表达的影响 与NC组比较,Model组大鼠甲状腺组织中Foxp3蛋白表达降低(P<0.05),RORγt、Notch1蛋白表达升高(P<0.05);与Model组比较,HXXYF-L组、HXXYF-H组、LTSD组大鼠甲状腺组织中Foxp3蛋白表达均升高(P<0.05),RORγt、Notch1蛋白表达均降低(P<0.05);与Model组比较,Jagged1组大鼠甲状腺组织中Foxp3蛋白表达降低(P<0.05),RORγt、Notch1蛋白表达均升高(P<0.05);与HXXYF-H组比较,HXXYF-H+Jagged1组大鼠甲状腺组织中Foxp3蛋白表达降低(P<0.05),RORγt、Notch1蛋白表达均升高(P<0.05)。(见图3、表4)
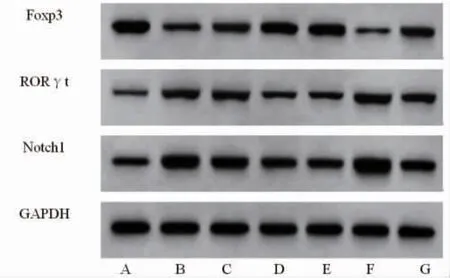
图3 各组大鼠甲状腺组织中Foxp3、RORγt、Notch1蛋白表达Western blotting 图
表4 各组大鼠甲状腺组织中Foxp3、RORγt、Notch1 蛋白表达比较 ()
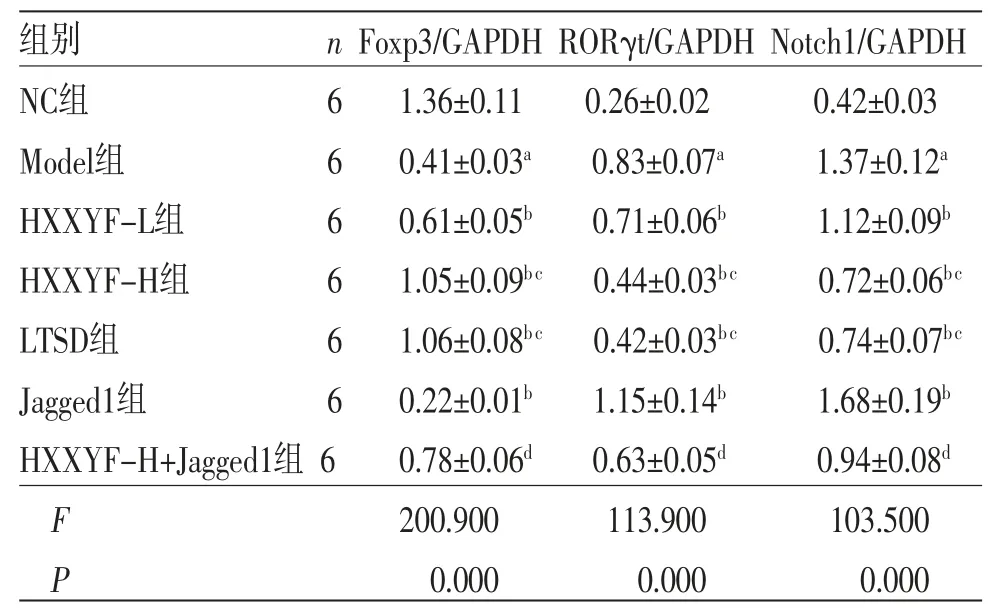
表4 各组大鼠甲状腺组织中Foxp3、RORγt、Notch1 蛋白表达比较 ()
注:与NC组比较,aP<0.05;与Model组比较,bP<0.05;与HXXYF-L组比较,cP<0.05;与HXXYF-H组比较,dP<0.05。
?
3 讨论
HT是最常见的自身免疫性甲状腺疾病,目前尚无有效的预防和治疗方法。HT通常可以通过左旋甲状腺素治疗,其可减少甲状腺体积并补充激素的不足。尽管进行了甲状腺激素替代治疗,一些HT患者仍会持续出现降低生活质量的症状[12]。甲状腺抗体TPOAb和TGAb被认为是预测HT和甲状腺功能减退症发展的最可靠的预后因素[13]。本研究显示,与NC组比较,Model组大鼠血清中TPOAb、TGAb水平均升高,提示HT大鼠模型构建成功。TSH是一种可参与调节甲状腺细胞增殖及甲状腺激素合成的激素。研究[14]表明,FT3、FT4、TSH是评估甲状腺功能的有效指标。本研究显示,与NC组比较,Model组大鼠血清中FT3、FT4水平降低,TSH水平升高,表明HT大鼠甲状腺功能异常;此外,本研究还发现,Model组大鼠甲状腺组织病理损伤程度明显高于NC组,表明HT大鼠甲状腺病理损伤严重,提示HT大鼠甲状腺功能及病理形态异常。
HXXYF是由王不留行、柴胡、莪术、桃仁、土鳖虫、蜣螂虫、猫爪草、蜈蚣等中药组成的中药复方制剂。已有研究[15]报道,HXXYF治疗结节性甲状腺肿具有一定的优势。HXXYF治疗HT具有较好的临床疗效,且能明显降低患者血清中炎症因子水平[16]。而关于HXXYF对HT大鼠甲状腺功能及病理形态的影响尚不明确。本研究显示,HXXYF可改善HT大鼠甲状腺功能及病理形态,且HXXYF剂量越高,改善作用越明显。而HXXYF-H组与LTSD组比较,其对HT大鼠甲状腺功能及病理形态的改善作用差异无统计学意义(P>0.05),提示HXXYF可能成为治疗HT的潜在有效药物。
Notch信号通路可以通过调节Treg/Th17细胞因子的水平来介导免疫炎症反应,从而参与多种自身免疫性疾病[17]。以Foxp3为关键调节因子的Treg是一种具有独特功能的CD4+T细胞亚群,Treg主要分泌IL-10,Treg数量的减少或功能障碍导致免疫系统不能对自身抗原的刺激产生良好的免疫耐受性,从而导致自身免疫疾病的发生[18-19]。以RORγt为关键调节因子的Th17主要分泌IL-17,其主要功能是聚集炎症细胞,如中性粒细胞,引起细胞浸润和组织破坏[20]。在正常情况下,Treg和Th17处于免疫平衡状态。然而,当Treg的数量不足或其功能有缺陷时,它们的免疫抑制能力下降,导致Th17过度增殖,这可引起多种自身免疫性疾病。本研究显示,与NC组比较,Model组Treg比例、Foxp3蛋白表达、IL-10水平降低,Th17比例、RORγt蛋白表达、IL-17水平升高,表明Treg/Th17细胞轴的免疫失衡参与了HT的发展。此外,与Model组比较,Jagged1组大鼠甲状腺组织中Foxp3蛋白表达降低,RORγt、Notch1蛋白表达升高,证实Notch/Treg/Th17通路确实参与了HT过程中的甲状腺功能及病理形态异常。此外,本研究还发现HXXYF可上调甲状腺组织中Foxp3蛋白表达,下调RORγt、Notch1蛋白表达,且HXXYF剂量越高,对应的作用越明显。推测HXXYF可能通过抑制Notch通路来调节Treg/Th17平衡进而改善HT大鼠甲状腺功能和病理形态。为了验证该推测,本研究在高剂量HXXYF作用的基础上再加上Notch激活剂Jagged1来干预HT大鼠,结果显示,Jagged1减弱了高剂量HXXYF对HT大鼠甲状腺功能和病理形态的改善作用,这证实了猜想是正确的。
综上所述,HXXYF可能通过抑制Notch通路来调节Treg/Th17平衡,进而改善HT大鼠甲状腺功能和病理形态。HXXYF可能成为治疗HT的潜在有效药物。



