姜淑君,邹 欣,董 慧,李井彬,周俪姗,陆付耳,魏世超,徐丽君
(1.华中科技大学同济医学院附属同济医院,湖北 武汉 430030;2.华中科技大学同济医学院附属武汉儿童医院/武汉市妇幼保健院,湖北 武汉 430016)
糖尿病是由胰岛素分泌不足和胰岛素敏感性降低导致的,以高血糖为特点的代谢性疾病[1]。持续的高血糖会导致严重的并发症,包括肾脏疾病、心血管疾病、糖尿病视网膜病变[2]。糖尿病的患病率在世界范围内迅速上升,国际糖尿病联合会(IDF)的最新调查显示糖尿病影响着全球4.5亿多人。预计到2045年,这一数字将达到6.93亿[3]。2型糖尿病在中医学中属于“消渴”范畴,黄连用于治疗消渴病已有两千多年的历史。
黄连是一种常见的中草药,主要成分有小檗碱、黄连碱、甲基黄连碱、巴马亭、药根碱、表小檗碱、木兰花碱等[4-5]。现代药理学研究表明黄连中某些成分具有降血糖、调节血脂作用[6-7]。课题组前期研究发现小檗碱可以改善胰岛素抵抗,促进胰岛素释放[8]。古代医籍中黄连丸剂治疗消渴病应用广泛。前期研究通过对古方的总结,发现黄连在治疗消渴病时大多制成药丸或粉末[9],而很少使用汤剂。有学者认为,黄连在制成汤剂时,部分有效成分可能被破坏、转化或沉淀[10]。为了探索中国古代医家将黄连制成丸剂治疗消渴病的科学依据,本研究比较了黄连丸剂、黄连汤剂和小檗碱在降血糖、调节血脂和改善胰岛素抵抗方面的作用。
1 材料
1.1 主要试剂 黄连饮片(批号:20201221)购自武汉中药材加工厂,经湖北中医药大学中药学院中药鉴定研究室张秀桥教授鉴定为正品。黄连对照药材(批号:121752-201801)为湖北中医药大学标本库标本;盐酸小檗碱(批号:180711)购自成都亚邦药业有限公司;盐酸小檗碱对照品(批号:110713-201613)购自中国食品药品检定研究院;链脲佐菌素(批号:S0130)购自Sigma-Aldrich有限公司;血清胰岛素放射免疫分析试剂盒(批号:110220)购自北京北方生物技术研究院;甘油三酯(TG)试剂盒(批号:2022040210)、胆固醇(TC)试剂盒(批号:2022032245)、高密度脂蛋白胆固醇(HDL-C)试剂盒(批号:2022042232)、低密度脂蛋白胆固醇(LDL-C)试剂盒(批号:2022040642)、游离脂肪酸(FFA)试剂盒(批号:2022061122)、葡萄糖试剂盒(批号:2022032132)均购自东鸥生物工程有限公司;血糖试纸(批号:473076)购自Hoffmann-La Roche有限公司。
1.2 主要仪器 Waters600高效液相色谱仪(美国Waters公司);ND2000超微量分光光度计(美国Thermo Scientific公司);RCZ-12A智能药物溶出度仪(上海锐析仪器设备有限公司);L3180半自动生化分析仪(上海科华验系统有限公司);723PC可见分光光度计(上海舜华仪器有限公司)。
1.3 实验动物 46只健康SPF级雄性Wistar大鼠,体质量200~220 g,购自湖北省实验动物研究中心,实验动物生产许可证号:SCXK(湖北)2021-0027,饲养在同济医院实验动物中心SPF级环境中。在控制温度(22±1)℃和湿度(45%~55%)的条件下,所有动物都能自由获得食物和水,光照周期为12 h。所有的研究均按照美国国立卫生研究院(NIH)的出版物和华中科技大学的实验动物使用和护理原则进行。
2 方法
2.1 色谱条件 色谱柱型号:Waters XTerra@RP(250 mm×4.6 mm,5 μm);柱温:30 ℃;流动相:乙腈50 mmol/L,磷酸二氢钾溶液(用磷酸调节pH为3.0)(体积比为45∶55),含25 mmol/L SDS;流速:0.5 mL/min;检测波长:345mm;进样量:20 μL。
2.2 溶液的制备 胃液中黄连丸剂、黄连汤剂和小檗碱含量的指纹图谱:取25 g黄连粉末(采用120目筛过滤)和黄连汤剂,分别放入1 000 mL烧杯中。根据2020年版《中华人民共和国药典》采用搅拌篮法,模拟900 mL胃液[V(动物胃液)∶V(人工胃液)=1∶1]作为黄连粉末或黄连汤剂的溶出介质,温度控制在37 ℃,转速50 r/min。黄连粉末或黄连汤剂溶解30 min后室温冷却,添加模拟胃液将黄连粉末或黄连汤剂稀释至1 000 mL,混合均匀后用0.45 μm微孔滤器过滤,然后收集滤液进行高效液相色谱分析[11]。
2.3 药物准备 将黄连磨碎筛成粉,放入干燥器中保存。在丸剂的制造过程中,粉末是丸剂之前的形式。在动物实验中,药丸大多被磨成粉末,制成易于灌胃的悬浮液。因此,在本研究用粉末代替丸剂。将1.1 kg黄连粉末溶于600 mL 5%羧甲基纤维素钠(CMC-Na)中制成悬浮液用于灌胃。取同批次1.1 kg黄连捣成粗粒(大小与大豆相近,使有效成分容易煮出),用蒸馏水煎煮3次,煎煮时保持水位高出药物上端位5 cm。取汤液浓缩至579 mL,4 ℃保存。根据文献[12]和预实验,确定小檗碱对2型糖尿病大鼠的有效治疗剂量为156 mg/kg,本实验将其确定为小檗碱高剂量组。根据黄连丸剂的有效治疗剂量及多次试验验证,黄连的治疗量确定为黄连粉末在模拟胃液中能溶解出78 mg小檗碱的用量。因此,本实验将78 mg/kg确定为小檗碱低剂量组。通过指纹图谱得出1 g黄连粉末中能溶出66.8 mg小檗碱,由此可计算出胃液中能溶解出78 mg小檗碱需要1.17 g黄连粉末,从而确定黄连丸剂和黄连汤剂的治疗剂量为1.17 g/kg。黄连丸剂组大鼠用上述制备好的黄连粉末悬浮液(1.1 kg黄连粉溶于600 mL 5%羧甲基纤维素钠)灌胃,按1.17 g/kg的治疗剂量,得出黄连丸剂组的灌胃剂量为0.64 mL/kg。黄连汤剂组大鼠用上述制备好的黄连汤剂浓缩液(1.1 kg浓缩成579 mL)灌胃,按1.17 g/kg的治疗剂量,可计算出黄连汤剂组的灌胃剂量为0.62 mL/kg。
2.4 造模与分组 所有大鼠普通饲料适应性喂养1周后,随机取6只大鼠作为对照组,其余40只大鼠给予高脂饮食(15%猪油、15%糖、2%胆固醇和0.5%胆盐组成)喂养4周后,禁食12 h,尾静脉注射26 mg/kg的链脲佐菌素(STZ)。1周后采用口服糖耐量试验(OGTT)筛查糖尿病大鼠,以空腹血糖>7 mmol/L或餐后2 h血糖>11.1 mmol/L视为造模成功。将造模成功的30只大鼠按照随机数字表法分为模型组、小檗碱高剂量组、小檗碱低剂量组、黄连丸剂组、黄连汤剂组,每组6只。
2.5 实验给药 小檗碱高剂量组大鼠予高剂量小檗碱混悬液灌胃,156 mg/(kg·d);小檗碱低剂量组大鼠予低剂量小檗碱混悬液灌胃,78 mg/(kg·d);黄连丸剂组大鼠予黄连粉末混悬液灌胃,0.64 mL/(kg·d);黄连汤剂组大鼠予黄连煎剂浓缩液灌胃,0.62 mL/(kg·d)。1次/d,连续给药63 d。
2.6 观察指标
2.6.1 口服糖耐量试验(OGTT) 给药63 d后,大鼠禁食12 h。根据体质量按2.2 g/kg给予50%葡萄糖溶液灌胃。分别在0、1、2 h用血糖试纸检测尾静脉血糖。根据获得的葡萄糖水平数据绘制成图表,并计算OGTT的曲线下面积(AUC)。
2.6.2 空腹血糖、空腹胰岛素和胰岛素敏感性指标(ISI) 给药后第0、9、18、27、36、45、54、63天,大鼠禁食12 h,采集大鼠眼眶血,采用半自动生化分析仪检测空腹血糖(FBG)水平。用放射免疫分析试剂盒测定空腹胰岛素(FINS)水平。ISI=ln[1/(FBG值×FINS值)]。
2.6.3 血脂 给药结束后各组大鼠禁食12 h,腹腔内注射0.4%戊巴比妥钠(50 mg/kg)麻醉。从腹主动脉采集血液样本,置于离心机中4 ℃,3 000 r/min离心15 min(离心半径为9.6 cm),取上清液,使用试剂盒检测血清总胆固醇(TC)、总甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)和游离脂肪酸(FFA)的含量。
2.7 统计学方法 采用SPSS 26.0软件进行统计分析,计量资料符合正态分布且方差齐,以“均数±标准差”()表示。采用单因素方差分析,两两比较采用Dunnett's t检验;重复测量计量资料比较采用重复测量资料的方差分析。P<0.05为差异有统计学意义。
3 结果
3.1 黄连丸剂和黄连汤剂在模拟胃液中的HPLC分析结果小檗碱标准品色谱图如图1A所示;黄连丸剂和黄连汤剂在模拟胃液中的色谱图如图1B、图1C所示;模拟胃液的色谱图如图1D(图中标注色谱峰,校正色谱峰坐标)。黄连丸剂和黄连汤剂中均含有小檗碱成分。
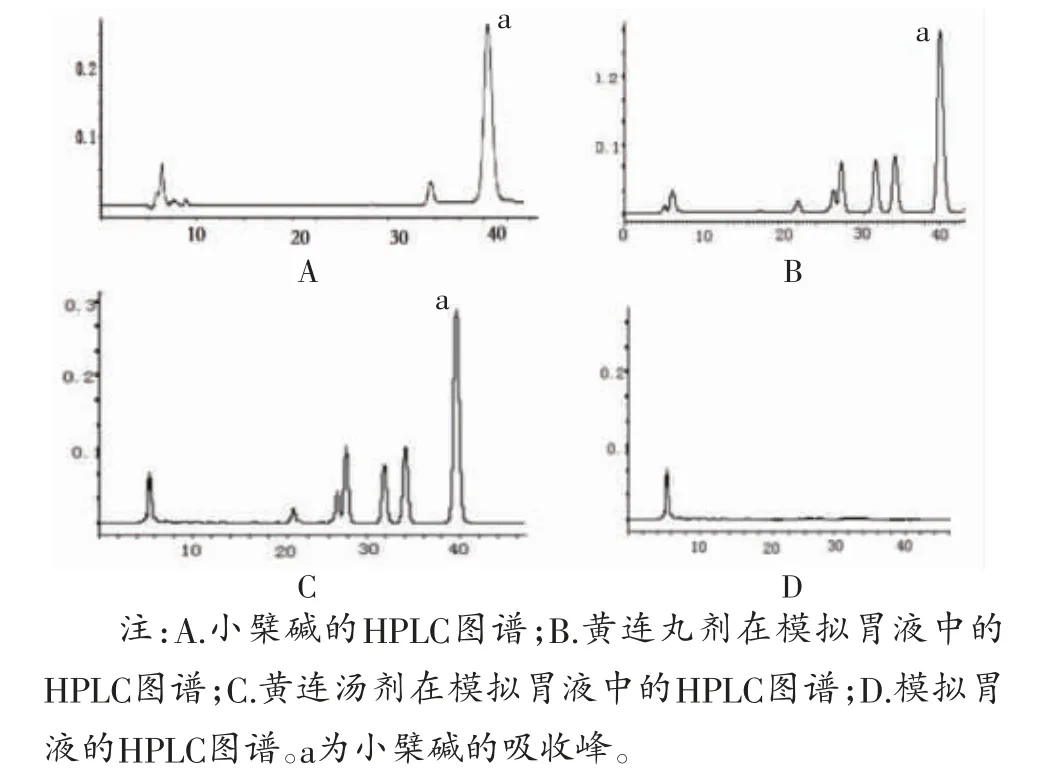
图1 各治疗药物HPLC 图谱
3.2 黄连丸剂和黄连汤剂在模拟胃液中小檗碱的含量 黄连丸剂和黄连汤剂在模拟胃液中小檗碱的含量见表1。黄连丸剂在模拟胃液中小檗碱的平均溶出量为66.8 mg/g,黄连汤剂在模拟胃液中小檗碱的平均溶出量为38.3 mg/g。(见表1)
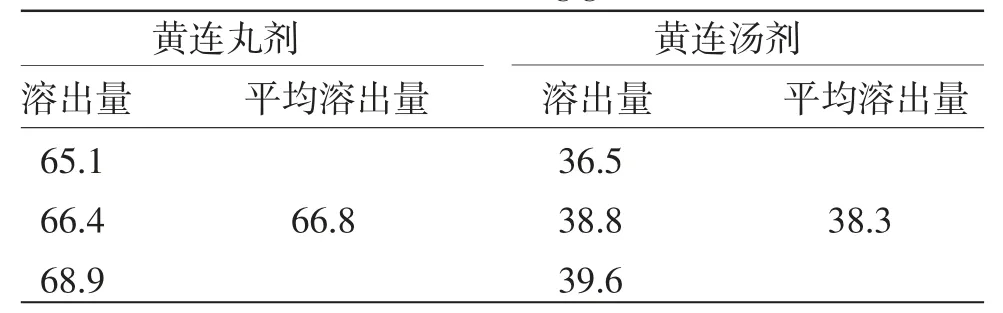
表1 黄连丸剂和黄连汤剂在模拟胃液中小檗碱的溶出量/(mg/g)
3.3 各组大鼠给药63 d后OGTT比较 模型组大鼠FBG、餐后1 h血糖和餐后2 h血糖均高于对照组(P<0.01)。黄连丸剂组、黄连汤剂组和小檗碱高剂量组大鼠FBG、餐后1 h血糖和餐后2 h血糖均低于模型组(P<0.01),而小檗碱低剂量组大鼠各时间点血糖与模型组比较,差异无统计学意义(P>0.05)。黄连丸剂组大鼠FBG、餐后1 h血糖均低于黄连汤剂组(P<0.05)。两组餐后2 h血糖比较,差异无统计学意义(P>0.05)。黄连丸剂组大鼠FBG、餐后1 h血糖和餐后2 h血糖均低于小檗碱高剂量组(P<0.05或P<0.01)。(见表2)黄连丸剂组OGTT曲线下面积(AUC)均小于黄连汤剂组和小檗碱低、高剂量组(P<0.05或P<0.01)。(见图2)提示黄连丸剂的降糖作用明显优于黄连汤剂和低、高剂量小檗碱。
表2 各组大鼠给药63 d 后OGTT 比较 (,mmol/L)

表2 各组大鼠给药63 d 后OGTT 比较 (,mmol/L)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.01;与黄连丸剂组比较,cP<0.05,dP<0.01。
?
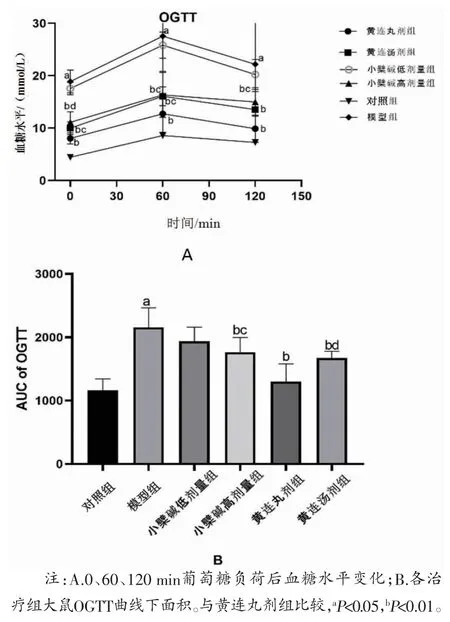
图2 各给药组大鼠给药63 d 后OGTT 及AUC 比较(,n=6)
3.4 各组大鼠FBG比较 所有大鼠不同时间点FBG比较,差异有统计学意义(P<0.05),即存在时间效应;6组大鼠FBG总体比较,差异有统计学意义(P<0.05),即存在分组效应。对照组FBG维持在稳定正常水平,而模型组大鼠FBG水平持续高于正常水平。小檗碱低剂量组大鼠各时间点FBG水平无明显改善,其他给药组大鼠FBG水平均有不同程度改善。此外,黄连丸剂组大鼠FBG水平从第9天开始显着低于模型组(P<0.05或P<0.01),黄连汤剂组和小檗碱高剂量组从第18天开始低于模型组(P<0.05)。从第45天开始,黄连丸剂组大鼠FBG水平的改善效果优于黄连汤剂组和小檗碱高剂量组(P<0.05)。时间因素与分组因素间存在交互效应(P<0.05),即各组大鼠FBG降低幅度不一致。(见表3、图3)
表3 各组大鼠FBG 比较 (,mmol/L)

表3 各组大鼠FBG 比较 (,mmol/L)
注:F时间主效应=3.103,P时间主效应=0.009;F分组主效应=91.350,P分组主效应=0.000;F交互效应=6.152,P交互效应=0.001;与对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01;与黄连丸剂组比较,dP<0.05。
?
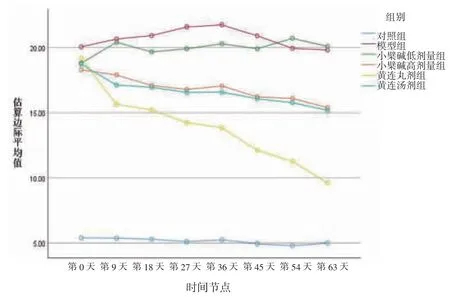
图3 FBG 交互效应轮廓图
3.5 各组大鼠FINS比较 所有大鼠不同时间点FINS比较,差异有统计学意义(P<0.05),即存在时间效应;6组大鼠FINS总体比较,差异有统计学意义(P<0.05),即存在分组效应。模型组大鼠各时间点FINS水平高于对照组。黄连丸剂组大鼠FINS水平从第27天开始显着下降,而黄连汤剂组FINS水平从第45天开始下降,小檗碱高剂量组FINS水平从第54天开始下降,但小檗碱低剂量组大鼠FINS水平无明显改善。此外,第63天,黄连丸剂组大鼠FINS水平明显低于黄连汤剂组和小檗碱高剂量组。时间因素与分组因素间存在交互效应(P<0.05),即各组大鼠FINS降低幅度不一致。(见表4、图4)
表4 各组大鼠FINS 比较 (,mIU/L)

表4 各组大鼠FINS 比较 (,mIU/L)
注:F时间主效应=19.001,P时间主效应=0.001;F分组主效应=49.957,P分组主效应=0.000;F交互效应=69.928,P交互效应=0.012;与对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01;与黄连丸剂组比较,dP<0.05。
?
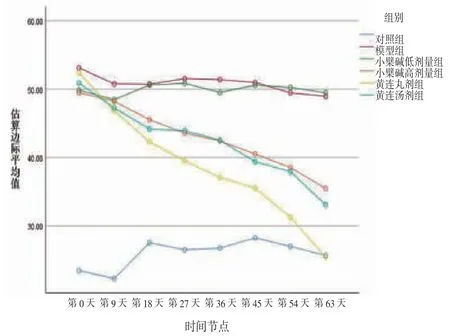
图4 FINS 交互效应轮廓图
3.6 各组大鼠ISI比较 所有大鼠不同时间点ISI比较,差异有统计学意义(P<0.05),即存在时间效应;6组大鼠ISI总体比较,差异有统计学意义(P<0.05),即存在分组效应。模型组大鼠ISI水平低于对照组,提示糖尿病大鼠胰岛功能受损。黄连丸剂组大鼠从第9天开始ISI高于模型组,黄连汤剂组大鼠从第18天开始ISI高于模型组,小檗碱高剂量组大鼠从第27天开始ISI高于模型组(P<0.05或P<0.01)。此外,从第45天开始黄连丸剂组大鼠ISI水平高于黄连汤剂组(P<0.01),从第54天开始黄连丸剂组大鼠ISI水平高于小檗碱高剂量组(P<0.01),说明黄连丸剂组大鼠ISI的改善效果较黄连汤剂组和小檗碱高剂量组更快、更好。时间因素与分组因素间存在交互效应(P<0.05),即各组大鼠ISI上升幅度不一致。(见表5、图5)
表5 各组大鼠ISI 比较 ()
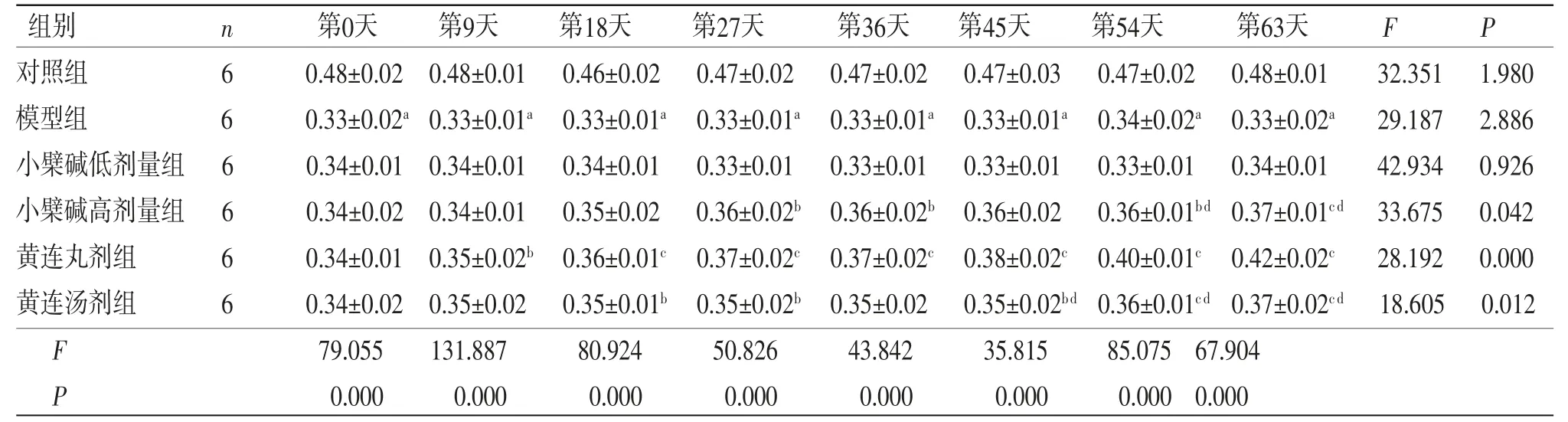
表5 各组大鼠ISI 比较 ()
注:F时间主效应=45.785,P时间主效应=0.038;F分组主效应=8.525,P分组主效应=0.02;F交互效应=2.381,P交互效应=0.002;与对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01;与黄连丸剂组比较,dP<0.01。
?

图5 ISI 交互效应轮廓图
3.7 各组大鼠血脂比较 给药63 d后模型组大鼠TG、TC、LDL-C、FFA高于对照组,HDL-C低于对照组,差异均有统计学意义(P<0.01)。黄连丸剂组、黄连汤剂组和小檗碱高剂量组大鼠TG、TC、LDL-C和FFA水平均低于模型组(P<0.01或P<0.05);黄连丸剂组大鼠HDL-C水平高于模型组(P<0.01)。表明黄连丸剂、黄连汤剂和高剂量小檗碱均能降低糖尿病大鼠TG、TC、LDL-C和FFA水平,黄连丸剂能升高糖尿病大鼠HDL-C水平。低剂量小檗碱对血脂无明显改善作用。黄连丸剂组、黄连汤剂组和小檗碱高剂量组之间比较,差异无统计学意义(P>0.05)。(见表6)
表6 各组大鼠给药63 d 后血脂水平比较 ()

表6 各组大鼠给药63 d 后血脂水平比较 ()
注:与对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01。
?
4 讨论
2型糖尿病(T2DM)是一种以血糖水平升高为特征的慢性代谢性疾病。随着人们生活方式的改变,如体育锻炼的减少和肥胖的增加,糖尿病的发病率正在逐年升高。胰岛腺β细胞的自身免疫破坏导致胰岛素分泌不足及机体细胞对胰岛素的内源性抵抗是糖尿病发生的主要原因[1]。黄连为毛茛科植物黄连、云南黄连、三角叶黄连的根茎,味苦、性寒,入心、肝、胃、大肠经,具有清热燥湿、泻火解毒的功效。黄连药材中含有生物碱、香豆素、木脂素、甾体、黄酮、萜类、有机酸、挥发油、多糖等多种化学成分,从而表现出广泛的药理活性,如降血糖、调节血脂、抗炎、抗菌、抗心律失常、抗肿瘤等[13]。其中,黄连用于糖尿病的治疗已有悠久的历史且有自身独特的优势[14]。中医古籍中有超过3.2万份方剂涉及黄连,黄连通常以粉末、丸剂、汤剂或片剂的形式出现。其中,丸剂是历代医家用黄连治疗糖尿病的主要剂型。黄连中主要成分是生物碱类化合物,其中小檗碱(黄连素)含量最高。研究证实小檗碱对糖脂代谢具有良好的改善作用[15]。
根据文献和课题组前期研究,小檗碱对2型糖尿病大鼠的治疗剂量为156 mg/kg[12]。因此,本研究将156 mg/kg小檗碱治疗量定为小檗碱高剂量。黄连粉末在模拟胃液中能溶解出78 mg小檗碱的黄连量为1.17 g。研究表明黄连丸剂对糖尿病大鼠的有效治疗剂量为1 g/kg[16]。因此,根据黄连丸剂的有效治疗剂量及多次试验验证,本研究确定治疗剂量为1.17 g/kg。为了进一步说明在降血糖、调节血脂及改善胰岛素敏感性方面黄连中除了小檗碱以外还有其他成分发挥作用,本研究将78mg/kg小檗碱治疗量确定为小檗碱低剂量。本研究结果表明,低剂量小檗碱对血糖、胰岛素敏感性和血脂水平均无明显改善作用,而黄连在降血糖、调节血脂、增强胰岛素敏感性方面具有明显作用。黄连丸剂组与小檗碱低剂量组的小檗碱含量是相同的,提示黄连中除了小檗碱具有降糖作用外,还有其他成分与小檗碱协同调节血糖和血脂的代谢。有研究发现黄连中的药根碱、黄连碱、阿魏酸、巴马汀等也具有降血糖、调节血脂的作用[17-18]。因此,黄连治疗2型糖尿病的作用可能与多种效应物质的多靶点协同作用有关。
为了进一步验证前人用黄连丸剂代替黄连汤剂治疗糖尿病的合理性,本研究比较了黄连丸剂和黄连汤剂对糖尿病大鼠糖脂代谢的作用。结果表明,黄连丸剂改善血糖、胰岛素敏感性的效果优于黄连汤剂。药丸多由药粉与蜂蜜或水混合制成,其制作过程基本为常温,其化学物质也以原始状态保留于药物粉末中。而汤剂是加水煎煮,其中的化学物质通过100 ℃的水而溶解提取。在此过程中,因水的容量有限,其溶出的化学成分有限,特别是有效成分的不足或有效成分群组成不科学而导致疗效不足。而且中药中化学成分复杂,在100 ℃的介质水中会发生很多种化学反应,其中,不乏H+或OH-的迁移而导致其原本的化学结构或空间结构发生改变[19]。所以,煎煮提取某些药物的有效成分时,很难达到完全提取,而且在提取的过程中有效成分可能会因为结构改变而有所损失。这与本研究结果一致,模拟胃液中黄连的主要有效成分小檗碱在黄连丸剂中的溶出量明显高于汤剂中的溶出量。研究表明,药物起效的决定因素包括两部分:首先,药物必须达到一定的浓度才能产生药理作用。其次,药物的特定化学结构与受体相互作用形成复合物后,才能诱发化学和物理变化[20]。特定化学结构通过结构互补与作用位点的大分子产生特殊的亲和力,立体化学结构可影响药物作用效果。综上所述,黄连丸剂因其化学结构完整、有效成分比例合理而对糖尿病大鼠血糖及胰岛素敏感性的改善具有更快、更好的作用。
因此在治疗糖尿病时黄连应制成丸剂,不宜制成汤剂入药。本研究结果验证了中医古方中黄连以丸剂形式治疗糖尿病的合理性。黄连丸剂的结构和有效物质的比例,以及糖尿病多靶点治疗的机制和特点还有待进一步探索。



