朱敏杰
邯郸市中心医院,河北 邯郸 056001
继发性细胞凋亡是肾缺血再灌注损伤的重要病理机制[1],因此以抑制细胞凋亡为靶点研究新型药物或许是降低肾缺血再灌注损伤的有效途径。大蒜素能通过降低氧化应激损伤和抑制细胞凋亡对肝脏、脑组织缺血再灌注损伤起到一定的保护作用[2-3];吴建伟等[4]研究发现大蒜素能有效降低肾缺血再灌注大鼠氧化应激损伤、改善肾功能,但大蒜素是否对肾缺血再灌注损伤大鼠细胞凋亡具有影响尚未见报道。本研究通过建立肾缺血再灌注大鼠模型,探讨大蒜素对肾缺血再灌注损伤大鼠细胞凋亡的影响及其作用机制。
1 材料与方法
1.1 药物与试剂 大蒜素注射液(上海禾丰制药有限公司产品,批号:140617,规格:60mg∶5mL);血清中尿素氮(BUN)、血肌酐(SCr)及尿酸(UA)试剂盒(深圳迈瑞生物医疗电子股份有限公司);苏木精-君红(HE)、末端脱氧核苷酸酰基转移酶介导dUTP切口末端标记(TUNEL)试剂盒(北京博奥森公司);bcl-2相关X蛋白(Bax)、B细胞淋巴瘤因子2(bcl-2)、核因子 κB(NF-κB)单抗(碧云天生物技术有限公司);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)及丙二醛(MDA)试剂盒(南京建成生物工程研究所)。
1.2 实验动物 清洁级雄性SD大鼠,体质量180~220 g,由河北省实验动物中心提供,实验动物许可证号:SCXK(冀)2013-1-003。
1.3 实验方法
1.3.1 模型的制备与分组 将SD大鼠80只按随机数字表法随机分为假手术组、模型组及大蒜素低、中、高(5、10、20 mg/kg)剂量组,每组16只,于手术造模前7天开始腹腔注射给药,1次/d。参照Chatterjee等[5]报道方法制备肾脏缺血再灌注损伤大鼠模型;假手术组大鼠除不夹闭肾蒂血管外,其余手术操作同模型组。再灌注6小时后,取材并进行各指标检测。
1.3.2 肾脏指数的计算 称取大鼠体质量,麻醉后摘取肾脏组织并称取左侧肾脏重量,计算肾脏指数,

1.3.3 血清 BU N、SCr、U A含量测定 取肾脏组织前经腹主动脉取血并1500rpm离心5分钟,取血清,通过全自动生化分析仪测定各组大鼠血清 BUN、SCr、UA 含量。
1.3.4 肾脏组织病理形态学变化和细胞凋亡状况观察 取称量后的左侧肾组织,于4%的多聚甲醛溶液中固定72小时后经石蜡包埋、切片(厚度为 5 μm)、脱蜡水化处理后行常规HE染色,通过倒置光学显微镜观察肾脏组织病理形态学变化。石蜡组织切片经脱蜡水化处理后,行TUNEL染色,通过倒置光学显微镜观察,细胞核黄染为阳性着色。计算凋亡指数AI:每张切片随机选取互不重叠6个视野,分别计数肾小球细胞总数和阳性着色细胞数,AI计算公式:凋亡细胞数/总细胞数×100%
1.3.5 肾脏组织中 bcl-2、Bax、N F-kB蛋白表达检测 取右侧肾组织并研磨匀浆,经12 000 rpm 4℃离心20分钟取沉淀,采用BCA法测定蛋白浓度,蛋白变性(沸水浴加热5分钟)、上样(每孔上样30 μg),经SDS-PAGE凝胶电泳后转PVDF膜、室温下5%脱脂奶粉封闭2小时,滴加一抗(1∶500)bcl-2、Bax、caspase-3、β-actin 4℃过夜,洗膜、二抗(1∶100)室温孵育1小时后经ECL系统显影;以β-actin为内参,以条带灰度值测定 bcl-2、Bax、caspase-3蛋白表达相对量并计算Bax/bcl-2比值。
1.3.6 肾脏组织中抗氧化酶活性和M D A含量测定 取“1.3.5”项下制备的组织匀浆液,3 000 rpm离心10分钟后取上清液,通过紫外-可见分光光度计测定各组大鼠肾脏组织中抗氧化酶(SOD、GSH-Px、CAT)活性和 MDA 含量。
1.4 统计学方法 运用SPSS 13.0软件分析数据,计量资料以(±s)表示,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肾脏指数 模型组大鼠肾脏指数为(5.8±1.4)mg/g,较假手术组(3.5±0.6)mg/g 升高(P<0.01);大蒜素低、中、高剂量组肾脏指数分别为(5.3±1.6)mg/g、(4.4±1.2)mg/g、(3.7±0.9)mg/g,中、高剂量组大鼠肾脏指数较模型组降低(P<0.05)。
2.2 各组大鼠血清BU N、SCr、U A含量 模型组大鼠血清BUN、SCr、UA含量较假手术组升高;而与模型组比较,大蒜素中、高剂量组能降低肾缺血再灌注损伤大鼠血清BUN、SCr、UA含量,见表1。
表 1 各组大鼠血清 BU N、SCr、U A含量(±s)
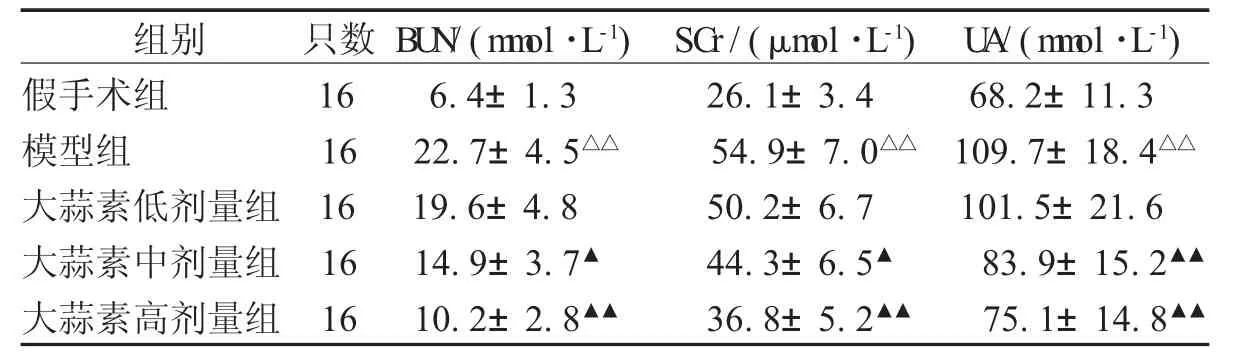
表 1 各组大鼠血清 BU N、SCr、U A含量(±s)
注:与假手术组比较,△△表示P<0.01;与模型组比较,▲表示P<0.05,▲▲表示P<0.01
组别 只数 BU N/(m m ol·L-1) SCr/(μm ol·L-1) U A/(m m ol·L-1)假手术组 16 6.4±1.3 26.1±3.4 68.2±11.3模型组 16 22.7±4.5△△ 54.9±7.0△△ 109.7±18.4△△大蒜素低剂量组 16 19.6±4.8 50.2±6.7 101.5±21.6大蒜素中剂量组 16 14.9±3.7▲ 44.3±6.5▲ 83.9±15.2▲▲大蒜素高剂量组 16 10.2±2.8▲▲ 36.8±5.2▲▲ 75.1±14.8▲▲
2.3 各组大鼠肾脏组织结构形态学变化 假手术组大鼠肾脏组织结构和肾小球细胞形态均未见异常;模型组大鼠肾脏组织结构呈现肾小球体积增大、系膜增生,间质区可见淋巴细胞浸润,肾小球细胞呈空泡变性等病理形态学变化;与模型组比较,大蒜素各剂量组能改善肾缺血再灌注损伤大鼠肾脏组织病变,其中以大蒜素高剂量组效果最为显着,见图1。
2.4 各组大鼠肾小球细胞凋亡状况 假手术组大鼠肾脏组织仅存在极少量的凋亡细胞;与假手术组比较,模型组大鼠凋亡细胞数量明显增多,大蒜素各剂量组肾缺血再灌注损伤大鼠肾小球细胞凋亡数量明显减少,以大蒜素高剂量组效果最为显着,见图 2;与假手术组比较,模型组 AI 为(52.8±7.0)%,较假手术组(3.7±1.4)%升高(P<0.01);大蒜素低、中、高剂量组 AI 分别为(47.1±6.8)%、(36.5±6.3)%、(18.9±4.5)%,中、高剂量组 AI 较模型组降低(P<0.05)。2.5 各组大鼠肾脏组织Bax、bcl-2、N F-kB蛋白表达 模型组大鼠肾脏组织中Bax、bcl-2、NF-kB蛋白表达及Bax/bcl-2比值较假手术组升高(P<0.01);与模型组比较,大蒜素中、高剂量组Bax、NF-kB蛋白表达降低而bcl-2蛋白表达升高(P<0.05),Bax/bcl-2 比值降低(P<0.01),见图 3、表 2。
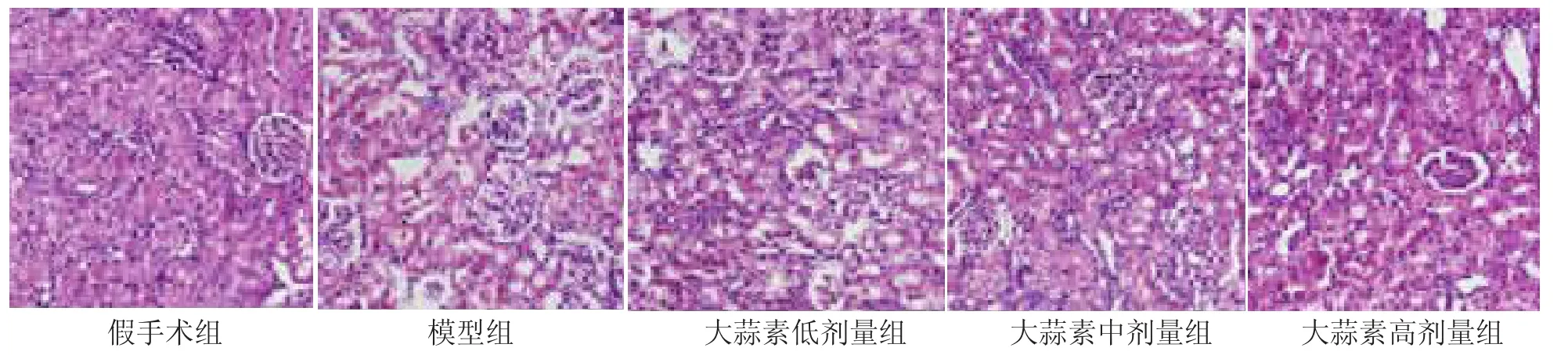
图1 各组大鼠肾脏组织结构形态学变化(H E,×400)
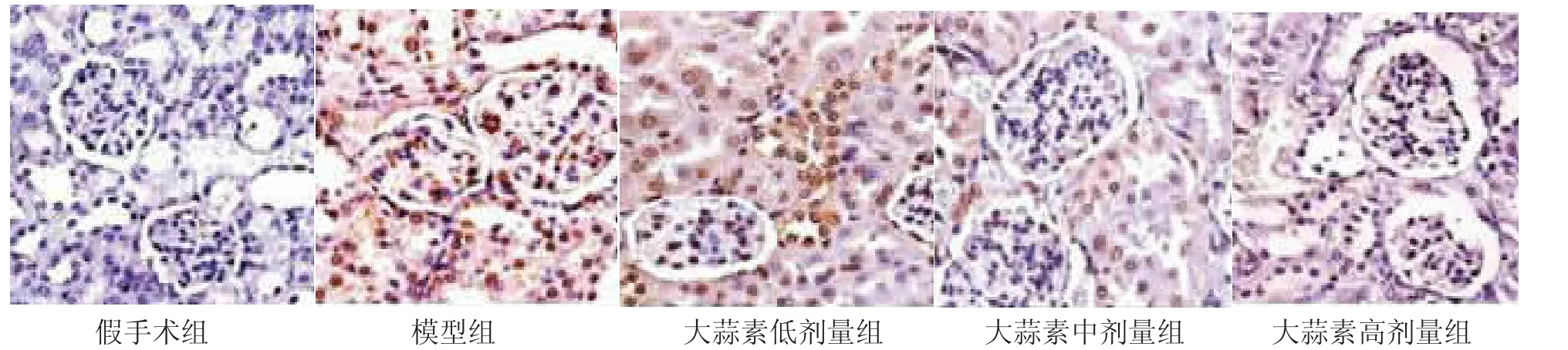
图2 各组大鼠肾小球细胞凋亡状况(TU N EL,×400)

图3 各组大鼠肾脏组织Bax、bcl-2、N F-kB蛋白表达(W est ern bl ot t i ng)
表2 各组大鼠肾脏组织Bax、bcl-2、N F-kB蛋白表达及Bax/bcl-2比值(±s)
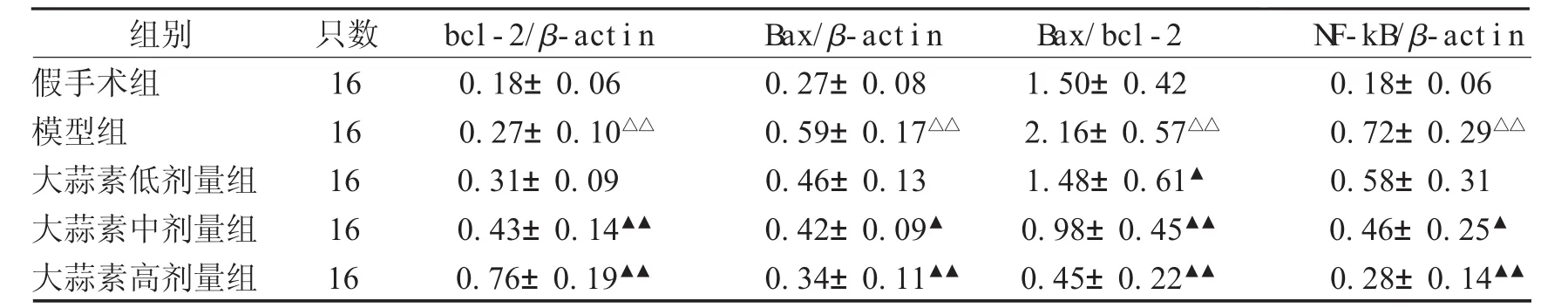
表2 各组大鼠肾脏组织Bax、bcl-2、N F-kB蛋白表达及Bax/bcl-2比值(±s)
注:与假手术组比较,△△表示P<0.01;与模型组比较,▲表示P<0.05,▲▲表示P<0.01
组别 只数 bcl-2/β-act i n Bax/β-act i n Bax/bcl-2 N F-kB/β-act i n假手术组 16 0.18±0.06 0.27±0.08 1.50±0.42 0.18±0.06模型组 16 0.27±0.10△△ 0.59±0.17△△ 2.16±0.57△△ 0.72±0.29△△大蒜素低剂量组 16 0.31±0.09 0.46±0.13 1.48±0.61▲ 0.58±0.31大蒜素中剂量组 16 0.43±0.14▲▲ 0.42±0.09▲ 0.98±0.45▲▲ 0.46±0.25▲大蒜素高剂量组 16 0.76±0.19▲▲ 0.34±0.11▲▲ 0.45±0.22▲▲ 0.28±0.14▲▲
2.6 各组大鼠肾脏组织中抗氧化酶活性和M D A含量 模型组大鼠肾脏组织中抗氧化酶(SOD、GSH-Px、CAT)活性较假手术组降低且MDA含量升高(P<0.01);与模型组比较,大蒜素中、高剂量组SOD、GSH-Px、CAT活性升高且MDA 含量降低(P<0.05),见表3。
表3 各组大鼠肾脏组织中抗氧化酶活性和M D A含量(±s)
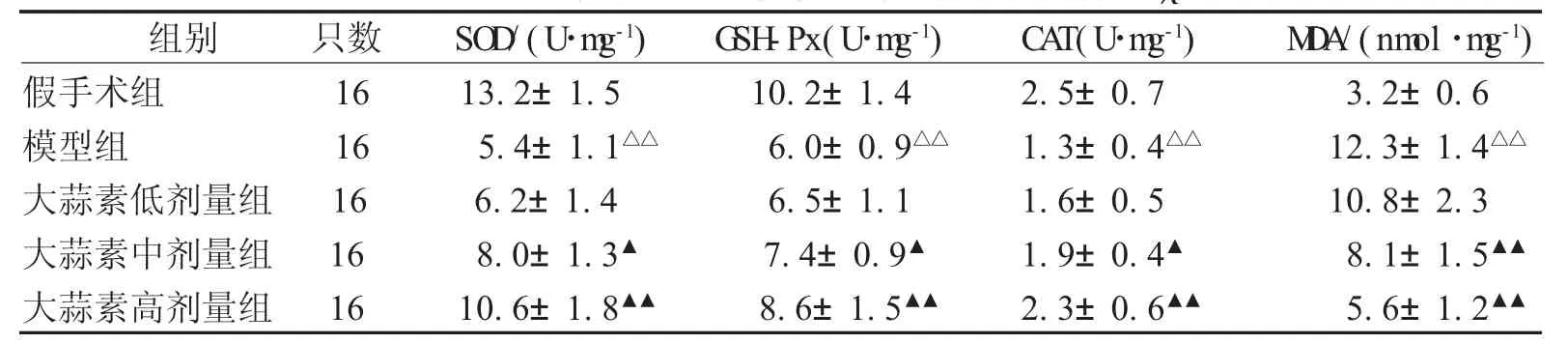
表3 各组大鼠肾脏组织中抗氧化酶活性和M D A含量(±s)
注:与假手术组比较,△△表示P<0.01;与模型组比较,▲表示P<0.05,▲▲表示P<0.01
组别 只数 SO D/(U·m g-1) G SH-Px(U·m g-1) CA T(U·m g-1) M D A/(nm ol·m g-1)假手术组 16 13.2±1.5 10.2±1.4 2.5±0.7 3.2±0.6模型组 16 5.4±1.1△△ 6.0±0.9△△ 1.3±0.4△△ 12.3±1.4△△大蒜素低剂量组 16 6.2±1.4 6.5±1.1 1.6±0.5 10.8±2.3大蒜素中剂量组 16 8.0±1.3▲ 7.4±0.9▲ 1.9±0.4▲ 8.1±1.5▲▲大蒜素高剂量组 16 10.6±1.8▲▲ 8.6±1.5▲▲ 2.3±0.6▲▲ 5.6±1.2▲▲
3 讨论
大蒜素是一种具有多种药理学作用的二烯丙基三硫化物,本研究发现,大蒜素能够有效降低肾缺血再灌注损伤大鼠肾脏指数,降低血清BUN、SCr、UA含量,改善肾脏组织病变,抑制肾小球细胞凋亡,提示大蒜素能抑制肾脏组织细胞凋亡,对肾缺血再灌注损伤大鼠具有一定的保护作用。
细胞凋亡过程由多种基因参与调控,其中Caspase是激活各种凋亡刺激因子的关键蛋白酶,参与细胞凋亡过程的调节;bcl-2能抑制线粒体破裂,可直接与多种凋亡刺激因子结合而抑制caspase-3激活,抑制促凋亡蛋白Bax细胞毒性,调节细胞内钙浓度,从而起到抑制细胞凋亡的作用[6];Bax具有诱导线粒体渗透性改变而释放细胞色素C、激活促凋亡蛋白caspase-9,表现出促细胞凋亡作用[7]。此外,Bax能与bcl-2聚合成二聚体,从而抑制bcl-2活性而促进细胞凋亡,所以Bax/bcl-2比值能体现Bcl-2基因家族对细胞凋亡的调控作用[8]。氧化应激损伤是细胞凋亡重要的诱发因素之一[9],正常生理状态下,体内生成的氧自 由 基 (ROS) 能 在 抗 氧 化 酶 (SOD、GSH-Px、CAT)的催化作用下被还原[10-12],ROS过剩时将导致脂质过氧化而生成终产物丙二醛(MDA),因此抗氧化酶活性和MDA含量能直接或间接反映机体的抗氧化能力。NF-κB为多效能核转录因子[13],生理状态下NF-κB以无活性形式存在于胞质中,当细胞受到ROS攻击时,NF-κB将被活化并暴露出核定位信号而进入胞核内,促进巨噬细胞活化和浸润,诱导促凋亡信号释放从而导致细胞凋亡,NF-κB激活与细胞凋亡密切相关[14]。本研究发现大蒜素能有效下调促凋亡蛋白Bax、NF-κB蛋白表达、上调抑凋亡蛋白bcl-2表达并降低Bax/bcl-2比值,改善抗氧化酶(SOD、GSH-Px、CAT)活性,降低氧化应激损伤。
总之,大蒜素可能通过抑制细胞凋亡而对肾缺血再灌注损伤起到一定的保护作用;其机制可能与大蒜素能调节Bax和bcl-2表达,降低Bax/bcl-2表达比值以及降低氧化应激损伤,下调NF-κB蛋白表达有关。



