富 苏,韩经丹,周 杰,范吉平△
(1.北京中医药大学东直门医院,北京 100700;2.中国中医科学院,北京 100700;3.中国中医科学院望京医院,北京 100102)
近几年,在各种脑缺血模型中均可看到神经元坏死伴有凋亡发生,并认为凋亡是缺血性神经元死亡的一种形式。细胞凋亡成为脑缺血损伤中的研究热点,并成为开发治疗药物的治疗靶点。熊胆粉味苦性寒,归肝、胆、心、胃经,功用清热解毒。导师范吉平教授依据多年中风病治疗的临床经验发现,熊胆粉对脑缺血损伤具有良好的保护作用。我们课题组之前的研究也已证实,熊胆粉可促进脑缺血损伤大鼠神经功能障碍的恢复,减轻神经元病理损害,减少细胞凋亡水平。本研究将试图在上述研究的基础上进一步揭示熊胆粉减少脑缺血损伤大鼠缺血半暗带皮层神经细胞凋亡的机制。
1 材料与方法
1.1 动物
清洁级SD雄性健康成年大鼠,体质量320~350g,购于北京维通利华实验动物技术有限公司(许可证号SCXK(京)2006-0009)。
1.2 药物
熊胆粉由山东沃华医药科技股份有限公司提供。阳性对照药物尼莫地平(商品名尼膜同)购于拜耳医药(国药准字H20003010,生产批号BJ03850)。
1.3 主要仪器和试剂
恒温手术台(SHOR-LINE);MCAO线栓(沙东线栓);电子分析天平(Sartorius);Narrow-Alley Corner Test实验仪器(北京宽街医院);石蜡包埋机(Leica,EG1150H);石蜡切片机(Leica,RM2255);正置显微镜(Olympus BX51);光学照像生物显微镜(Leica,DMLB-HC);图像采集系统(Leica DM4000B);图像分析系统(Image-pro Plus 5.0)。
水合氯醛(国药集团化学试剂有限公司);0.9%生理盐水(石家庄四药);4%多聚甲醛(SUNBIO);超纯水(中国中医科学院医学实验中心机能实验室);乙醇、二甲苯、盐酸酒精、兔抗大鼠Bax、Bcl-2、CytC、Caspase-9、Caspase-3 免疫组化试剂盒(武汉博士德)。
1.4 造模方法
大鼠经10%水合氯醛腹腔注射麻醉(0.35 mL·100 g-1),大鼠麻醉成功后仰卧位固定,颈部正中切口,分离并暴露右侧颈总动脉及颈内、外动脉,颈总动脉近心端和颈内动脉搭一根尼龙线系活扣,颈外动脉近心端和远心端分别用一根尼龙线结扎,2根结扎尼龙线之间间距0.5 cm。颈总动脉动脉夹夹闭后,在颈外动脉上两根结扎的尼龙线之间剪短,后将颈外动脉近心端下翻,与境内动脉成一天直线,从颈外动脉剪一个小口插入线栓,插入长度约为(20.0±0.5)mm时感到有轻微阻力时停止,在颈内动脉处扎紧尼龙线并固定线栓,扎紧颈总动脉近心端尼龙线,取下动脉夹,缝合皮肤。术后常规护理。待实验动物清醒后进行Zea-Longa神经功能评分,神经功能评分标准为:①无神经功能损伤症状,动物正常活动,进食评0分;②将动物尾巴提起后,左前肢屈曲1分;③将动物放置平板上向左侧转圈2分;④将动物放置平板上,用手轻推向左侧倾倒3分;⑤动物左侧偏瘫,不能自发行走意识朦胧或丧失4分。评分大于或等于2分,则表明模型成功,低于2分则予以去除。
1.5 分组与给药
造模成功的实验动物,根据神经功能评分分层随机分为五组,分别为正常对照组(蒸馏水)、假手术组(蒸馏水)、模型组(蒸馏水)、尼莫地平组(尼莫地平研碎蒸馏水溶解,按照临床用量人大鼠体表面折算给药剂量为 32.4 mg·kg-1,配制成药物浓度为3.24 mg·mL-1的蒸馏水溶液)、熊胆粉组(通络化痰胶囊蒸馏水溶解,按照临床用量人大鼠体表面折算给药剂量为27 mg·kg-1,配制成药物浓度为2.7 mg·mL-1的蒸馏水溶液)。从术后第1天开始给药,以1 mL·100 g-1体质量体积灌胃给药,每天1次,连续灌胃给药7d。
1.6 取材及标本制作
术后第8天每组随机取6只,10%水合氯醛深度麻醉(0.35 mL·100 g-1),迅速打开胸腔,暴露心脏,剪开右心房,于心尖部剪开左心室,插管至主动脉,快速注入100 ml生理盐水冲洗后,再以体积分数为4%的多聚甲醛(PH值调成7.0左右)灌注固定后断头取脑。取得的脑组织入4℃4%多聚甲醛固定液中固定过夜,经过固定、脱水、透明、石蜡包埋处理,连续冠状切片,切片厚度为5 μm。
1.7 免疫组织化学测 Bax、Bcl-2、CytC、Caspase-9、Caspase-3表达的变化
组织切片,常规脱蜡,抗原修复后用0.3%H2O2封闭内源性过氧化物酶活性,37℃孵育5 min三遍,滴加一抗;37℃孵育2 h,滴加二抗;37℃孵育30 min,滴加辣根酶标记链霉卵白素工作液;37℃孵育50 min,DAB显色、复染、脱水、透明、封片,光学显微镜下观察。首先在40倍光镜下定位缺血侧缺血半暗带额顶叶皮层,每组6只,每只动物取5张相同部位脑片,后在400倍光镜下选取5个相邻视野对阳性神经元(胞浆呈棕黄色颗粒)进行观察,采用Image-pro Plus 5.0软件测定阳性细胞的光密度值。
1.8 统计学方法
2 结果
2.1 熊胆粉对pMCAO大鼠缺血半暗带皮层细胞CytC、Caspase-9、Caspase-3表达的影响
表1图1~图3显示,正常对照组和假手术组CytC、Caspase-9和Caspase-3阳性细胞表达不明显,模型组可见CytC、Caspase-9和Caspase-3阳性细胞表达增多,与正常对照组和假手术组比较差异有统计学意义(P<0.01),表现为细胞胞浆呈棕黄色,甚至胞核浓染呈棕褐色,有颗粒或块状沉淀。与模型组比较,熊胆粉及尼莫地平给药干预后其 CytC、Caspase-9和Caspase-3阳性表达减少,与模型组比较差异有统计学意义(P <0.01,P <0.05)。
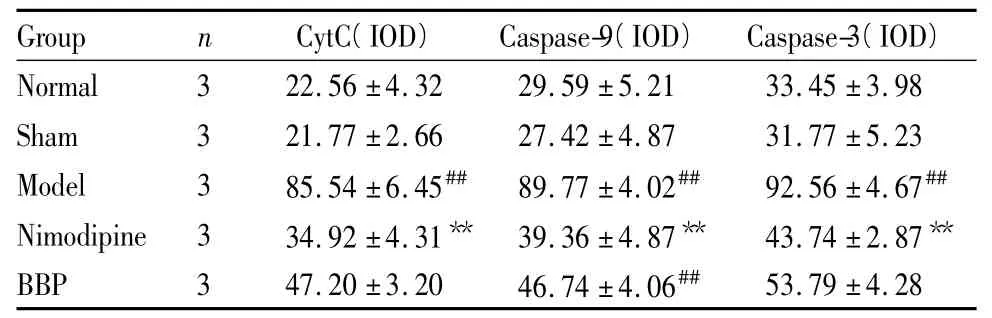
Table 1 Effect of Bear bile power on the expression of CytC,Caspase-9 and Caspase-3 of neurons in ischemic penumbra of rats with pMCAO(-x ± s)

Fig 1 Effect of Bear Bile Power on the expression of CytC of neurons in ischemic penumbra of rats with pMCAO(Immunohistochemical staining×400)
2.2 熊胆粉对pMCAO大鼠缺血半暗带皮层Bax、Bcl-2免疫组化结果的影响

Fig 2 Effect of Bear Bile Power on the expression of Caspase-9 of neurons in ischemic penumbra of rats with pMCAO(Immunohistochemical staining×400)

Fig 3 Effect of Bear Bile Power on the expression of Caspase-3 of neurons in ischemic penumbra of rats with pMCAO(Immunohistochemical staining×400)
表2图4、5显示,正常对照组和假手术组可见Bcl-2阳性细胞表达,表现为细胞胞浆浓染呈棕褐色,有颗粒或块状沉淀;熊胆粉组及尼莫地平给药干预后可见的Bcl-2阳性表达增多,与模型组比较差异有统计学意义(P<0.01)。正常对照组和假手术组Bax阳性细胞表达不明显,模型组可见Bax阳性细胞表达增多,表现为细胞胞浆呈棕黄色,甚至胞核浓染呈棕褐色,成团块状;与模型组比较,熊胆粉组及尼莫地平给药干预后其Bax蛋白减少,与模型组比较差异有统计学意义(P<0.01,P<0.05)。
Table 2 Effect of Bear bile power on the expression of Bax and Bcl-2 of neurons in ischemic penumbra of rats with pMCAO(±s)
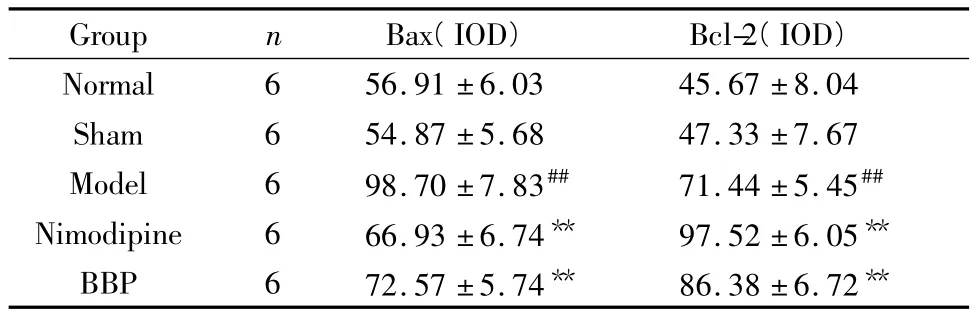
Table 2 Effect of Bear bile power on the expression of Bax and Bcl-2 of neurons in ischemic penumbra of rats with pMCAO(±s)
注:** P <0.01 vs Model Group;*P <0.05 vs Model Group;##P <0.01 vs Sham Group;#P <0.05 vs Sham Group
Group n Bax(IOD)Bcl-2(IOD)Normal 6 56.91 ±6.03 45.67 ±8.04 Sham 6 54.87 ±5.68 47.33 ±7.67 Model 6 98.70 ±7.83## 71.44 ±5.45##Nimodipine 6 66.93 ±6.74** 97.52 ±6.05**BBP 6 72.57 ±5.74** 86.38 ±6.72**

Fig 4 Effect of Bear Bile Power on the expression of Bax of neurons in ischemic penumbra of rats with pMCAO(Immunohistochemical staining×400)
3 讨论
细胞凋亡又称程序性细胞死亡(programed cell death,PCD),是由基因控制的细胞自主的有序的死亡。MacManuS等在1993年首次报道大鼠全脑缺血与神经细胞凋亡的关系,至此之后神经细胞凋亡在脑缺血损伤中的作用日益受到关注。研究表明,神经细胞凋亡是脑缺血损伤病理作用的重要环节,是造成脑缺血损伤后继发性损害的重要机制[1,2]。脑缺血损伤既可造成细胞坏死,又可诱导细胞凋亡。细胞坏死是一个不可逆的过程,而细胞凋亡则是受一系列程序调控的过程,在脑缺血损伤后及早进行抗凋亡治疗具有重要意义[3]。

Fig 5 Effect of Bear Bile Power on the expression of B Bcl-2of neurons in ischemic penumbra of rats with pMCAO(Immunohistochemical staining×400)
细胞凋亡中最经典的途径之一为线粒体途径(内途径)。线粒体对于多细胞生物至关重要。没有线粒体细胞会停止有氧呼吸并迅速死亡,这一机制也是很多凋亡通路的关键。凋亡蛋白通过不同的方式以线粒体为靶点破坏线粒体的作用,通过线粒体膜孔道的形成导致线粒体肿胀,或者通过提高线粒体膜的通透性导致凋亡效应器的漏出[4]。线粒体直接或间接地形成特定的孔道来释放凋亡因子,如细胞色素C。在细胞质内,细胞色素C与Apaf-1聚合,吸引caspase-9前体形成凋亡(apoptosome)。这导致caspase-9的分裂和激活,caspase-9同时可以反过来分裂和激活下游的caspase-3,后者起到细胞凋亡过程效应器的作用。研究表明[5~7],在caspase家族中,caspase-3是caspase级联“瀑布”下游最关键的凋亡执行蛋白酶,它在正常细胞中是以酶原形式存在,受凋亡刺激因素作用后激活,活化的caspase-3可以激活核因子、细胞骨架蛋白及DNA修复酶等,引起细胞形态的变化,如出现细胞皱缩、DNA裂解、染色体浓缩和凋亡小体的形成等,最终导致细胞凋亡,caspase-3在各种因素启动的凋亡程序中起最后的枢纽作用。通过抑制caspase-3的活化,可以产生对缺血性脑损伤的保护作用[8~10]。Bcl-2家族基因是脑缺血神经元凋亡调控基因的重要组成部分。Bcl-2蛋白家族包括Bcl-2样促生存亚家族(Bcl-2、Bcl-xL、Bcl-w等)和Bcl-2样促凋亡亚家族(Bax、Bak、Bcl-xS等)2种。目前研究较多的是Bax和Bcl-2蛋白,Bcl-2增高,抑制神经细胞凋亡;Bax增高,促进神经细胞凋亡[11],研究已发现Bax和Bcl-2将直接进入到细胞凋亡的线粒体途径(内途径)中参与调节细胞凋亡的过程。
熊胆粉味苦性寒,归肝、胆、心、胃经,功用清热解毒,课题组既往临床试验也证实,以熊胆粉为君药的通络化痰胶囊可减少脑梗死病人的神经功能缺损症状[12]。脑缺血损伤后的级联反应所形成的一系列神经生化毒素,导致神经功能损害,当属中医学痰、瘀、毒邪范畴,亦为应用中药抑制或阻断缺血后级联反应成为中医药治疗中风病的特色机制。本研究揭示脑缺血损伤后早期应用熊胆粉可以调节脑缺血损伤后神经细胞凋亡线粒体途径中关键蛋白CytC、Caspase-3和Caspase-9的表达,并且可调节参与调节脑缺血损伤神经细胞凋亡线粒体途径中的Bcl-2基因家族成员Bcl-2和Bax,这可能是熊胆粉促进脑缺血损伤大鼠损伤后神经功能障碍的恢复、减轻神经元病理损害、减少细胞凋亡水平的分子机制之一。
[1]WANGP,WANGW,XUYL,et al.Comparison of focal cerebra1 ischemia-reperfusion induced apoptosis of astrocytes and neurons in rats[J].Chin J Histoehem Cytochem,2006,16(2):113-118.
[2]Morphological Characteristic of apoptosis and its significance in neurogenesis[J].J Morfologiia,2007,131(2):16-28.
[3]DouglasR G,Guido K.Pharmacological manipulation of cell death:clinical applications in sight[J].J Clin In vest,2005,115:2610-2617.
[4]Cotran,Kumar,Collins(1998).Robbins Pathologic Basis of Disease.Philadelphia:W.B Saunders Company.
[5]John C R.Mechanisms of apoptosis[J].Am J Path,2000,157(5):1415-1430.
[6]Cohen G M.Caspase:The executioners of apoptosis[J].Biochem J,1997,326:1-16.
[7]Earnshaw W C,M artins L M,Kaufmann S H.Mammalian caspases:structure,activation,substrates and functions during apoptosis[J].Annu Rev Biochem,1999,68:383-424.
[8]Reed J C.Apoptosis-based therapies[J].Nat Rev Drug Discov,2002,1(2):111-121.
[9]Cheng Y,Deshmukh M,D’Costa A,et al.Caspase inhibitor affords neuroprotection with delayed administration in a rat model of neonatal hypoxic-ischemic brain injury[J].J Clin Invest,1998,101(9):1992-1999.
[10]Inna N L,Alexander G,Peter H K.Caspase:pharmacological manipulation of cell death[J].J Clin Invest,2005,115(10):2665-2672.
[11]CHRYSIS D,CALIKOGLU AS,YEP,et al.Insulin-like growth factor-1 over expression at tenuates cerebral apoptosis by altering the expression of Bcl family protein in a developmentally specific manner[J].J Neurosci,2001,21(3):1481-1490.
[12]马大勇,韩振蕴,范吉平,等.通络化痰胶囊治疗脑梗死恢复期痰瘀阻络353例临床研究[J].中医杂志,2012,53(7):563-567.



