杨燕燕,谢金东,周建华,俞春英,林 玮,刘德强,王训立
(福建中医药大学,福州 350122)
动脉粥样硬化(atherosclerosis,AS)是一种复杂的多因素疾病,表现为动脉壁对各种炎症损伤的炎症-增殖反应[1-2]。目前,AS防治措施有多种选择,经皮腔内冠状动脉成形术虽能缓解AS心肌缺血症状,但容易发生术后再狭窄;他汀类西药可迅速、有效的治疗AS,但作用单一,长期应用会导致明显的不良反应;而多种中药也被用于防治AS疾病,并提示具有一定程度的疗效[3]。近年来,灵芝的抗AS作用机制研究多数是基于大鼠动物模型进行的血脂监控及病理形态学分析[4],但灵芝多糖(ganoderma lucidum polysaccharides, GLPs)治疗AS涉及炎症因子和免疫反应的分子机制尚未见报道。因此,本研究基于ApoE-/-小鼠AS模型和TLR/NF-κB信号通路,分析GLPs对TLR4及其下游MyD88依赖性或非依赖性信号通路的影响,探讨其对AS干预作用的分子生物学基础。
1 材料
1.1 实验动物与分组
8~10周龄ApoE-/-小鼠50只,按随机数字表法分为模型组、GLPs低剂量组(200 mg/kg·d)、GLPs中剂量组(500 mg / kg·d)、GLPs高剂量组(800 mg / kg·d)及辛伐他汀组(1.8 mg / kg·d)各10只,8~10周龄C57BL/6小鼠10只,设为正常对照组。小鼠购自北京维通利华实验动物技术有限公司(许可证号SCXK(沪)2012-0002),喂饲于福建中医药大学实验动物中心(许可证号SYXK(闽)2014-0005)SPF级动物实验室。
1.2 主要仪器与试剂
美国ABI 2720 PCR扩增仪;美国赛默飞世尔17R小型高速冷冻离心机;美国ABI Stepone plus型荧光定量PCR仪;美国Biorad Mini-PROTEAN@Tetra小型垂直电泳槽;美国Biorad Power Pac电泳仪;美国Biorad ChemiDoc XRS +凝胶成像分析系统;普通二级清洁饲料,高脂饲料(1%胆固醇,10%猪油,89%基础饲料);生物工程(上海)股份有限公司SK1312 Total RNA Extractor试剂盒;生物工程(上海)股份有限公司SK2445第一链cDNA合成试剂盒;生物工程(上海股份有限公司)B639273 2X SG Fast qPCR Master Mix(High Rox);GLPs购自杭州众芝康菇生物科技有限公司;TLR4、NF-κB、MyD88等抗体购自美国CST公司;TRAF6、TRIF等抗体购自英国Abcam公司;TRAM抗体购自德国Merck Millipore公司;Pierce Goat Anti-Mouse IgG(H+L)-HRP Antibody和Pierce Goat Anti-Rabbit IgG-HRP Antibody购自美国Thermo Fisher公司。
2 方法
2.1 AS动物模型制作
正常组小鼠喂饲普通饲料,ApoE-/-小鼠给予高脂饲料,连续喂养共90 d。造模后期按照各药物干预组设定剂量每日灌胃给药1次,正常组和模型组给予等量生理盐水,治疗期为30 d。解剖取病变主动脉血管,验证AS疾病模型造模成功与否并进行后续实验。
2.2 实时荧光定量PCR
表1显示,血管组织总RNA提取步骤严格按照说明书进行,并通过反转录反应体系得到cDNA,参照Gene Bank,由生工生物工程(上海)股份有限公司合成。PCR反应总体系20.0 μL:2×SybrGreen qPCR Master Mix 10.0 μL,Template cDNA 2.0 μL,10 μM PCR Forward Primer 0.4 μL,10 μM PCR Reverse Primer 0.4 μL,ddH2O 7.2 μL。反应条件为:95 ℃ 3 min,95 ℃ 7 s,55 ℃ 10 s,72 ℃ 15 s,共45个循环。以GAPDH为内参,数据计算依据2-ΔΔCT法[5]。

表1 各基因的引物序列及扩增产物的长度
2.3 Western Blot
提取动脉总蛋白,基于BCA法定量配制上样蛋白样品,SDS-PAGE垂直板全湿法电泳;转于PVDF膜上,封闭液室温封闭1 h,加入1∶1 000 稀释的一抗,4 ℃孵育过夜,TBST洗涤;加入1∶3 000稀释的HRP标记二抗室温孵育1 h,洗涤后ECL显色;经凝胶成像系统检测,分析各组目标条带的灰度值,计算相对表达量。
2.4 统计学方法
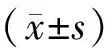
3 结果
3.1 ApoE-/-小鼠AS模型建立
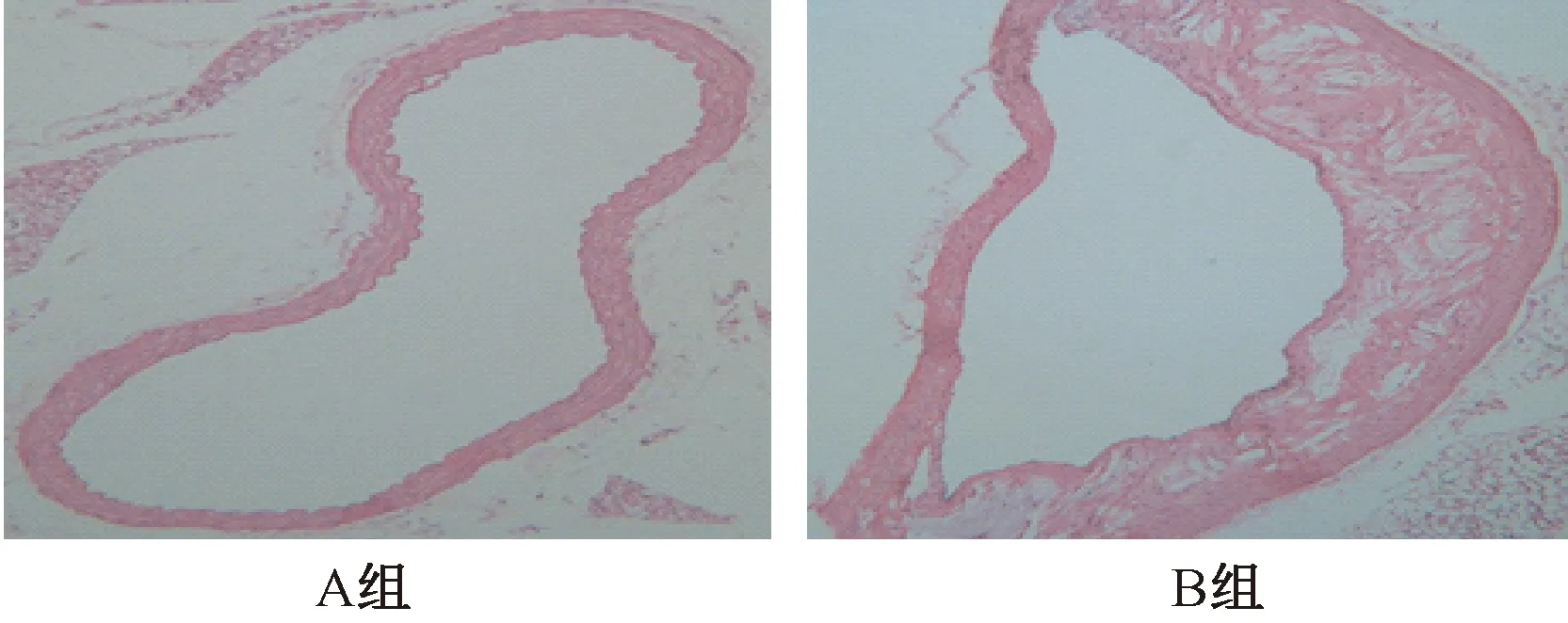
图1 小鼠动脉病理组织学比较
图1表2显示,正常组主动脉壁层次清晰,内膜连续,中膜平滑肌细胞排列整齐,未见AS斑块形成。模型组则显示主动脉管壁厚薄不均,血管内膜增厚,内部脂质池增大,管腔内斑块沉积,有泡沫细胞、炎症细胞浸润,表现为典型的AS病理特征。同时血清血脂水平检测显示,模型组TC、TG、LDL-C水平显着升高,而HDL-C显着降低,并具有统计学意义。基于上述证实,ApoE-/-小鼠AS模型建立成功。
3.2 RNA提取及降解状况
图2显示,小鼠动脉组织总RNA条带的18S、28S条带清晰完整,基本无降解。

表2 正常组和模型组小鼠血脂水平比较
注:与正常组比较:*P<0.05,**P<0.01
3.3 灵芝多糖对TLR4及其下游MyD88信号通路元件表达的影响
3.3.1 TLR4、NF-κB、MyD88和TRAF-6 mRNA表达 表3显示,与正常组比较,模型组TLR4(P<0.05)、NF-κB(P<0.05)、MyD88(P<0.05)和TRAF-6(P<0.01)mRNA表达显着升高。与模型组比较,经药物干预后各治疗组TLR4、NF-κB、MyD88和TRAF-6 mRNA表达均有不同程序的降低。其中西药对照组效果最为明显,TLR4、MyD88及NF-κB mRNA比较差异有统计学意义(P<0.05),TRAF-6 mRNA差异有统计学意义(P<0.01)。而中药GLPs治疗组与模型组比较则表现为低剂量组NF-κB、中剂量组MyD88和高剂量组TLR4、NF-κB、MyD88 mRNA比较差异有统计学意义(P<0.05);同时GLPs各剂量组的TRAF-6 mRNA差异有统计学意义(P<0.01)。

图2 RNA检测电泳结果
3.3.2 TLR4、NF-κB、MyD88和TRAF-6蛋白表达 表3显示,各组的蛋白相对表达趋势与mRNA基本一致。与正常组比较,模型组TLR4(P<0.01)、NF-κB(P<0.05)、MyD88(P<0.05)和TRAF-6(P<0.01)蛋白表达显着升高。与模型组比较,经药物干预后各治疗组各指标蛋白表达均有不同程序的降低,其中西药对照组最为明显,TLR4、MyD88及NF-κB差异有统计学意义(P<0.05),TRAF-6差异有统计学意义(P<0.01)。而中药GLPs治疗组与模型组比较,则表现为高剂量组TLR4和中、高剂量组的NF-κB、MyD88蛋白表达差异有统计学意义(P<0.05),同时GLPs各剂量组的TRAF-6比较差异有统计学意义(P<0.01)。
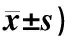
表3 各组小鼠TLR4及其下游MyD88依赖性通路元件mRNA和蛋白表达水平比较(相对表达量,
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01
3.4 灵芝多糖对MyD88非依赖性信号通路元件表达的影响
3.4.1 TRAM和TRIF mRNA表达 表4显示,与正常组比较,模型组TRAM(P<0.05)和TRIF(P<0.01)mRNA表达水平显着升高,差异有统计学意义。与模型组比较,经药物干预后各治疗组TRAM和TRIF mRNA表达均有下降趋势,西药对照组效果较为明显(P<0.05),但GLPs各剂量组比较差异无统计学意义(P> 0.05)。
3.4.2 TRAM和TRIF 蛋白表达 表4显示,各组TRAM和TRIF蛋白相对表达趋势与mRNA基本一致。与正常组比较,模型组TRAM(P<0.05)和TRIF(P<0.01)蛋白表达水平显着升高。与模型组比较,经药物干预后各治疗组TRAM和TRIF蛋白均具有下降趋势,西药对照组效果较为明显(P<0.05),但GLPs各剂量组比较差异无统计学意义(P> 0.05)。
4 讨论
TLR4贯穿于AS起始、进展、斑块不稳定及斑块破裂等各个时期[6]。MyD88依赖性途径表现为介导IRAK-1和IRAK4结合TLR4,IRAK-1自磷酸化后解离、募集并活化下游TRAF-6,随后活化TAK1,激活IKK复合体,诱导IκB磷酸化并释放NF-κB转移至核内,经胞内级联反应启动相关基因转录,介导机体内早期的天然免疫及炎症反应[7-9]。本实验结果显示,与正常组比较,模型组小鼠TLR4及下游MyD88依赖性信号通路主要细胞因子TLR4、NF-κB、MyD88及TRAF-6 mRNA和蛋白相对表达量均显着升高。采用GLPs干预后,各指标表达均有不同程度下降趋势,差异有统计学意义。因此,推测GLPs对TLR4及下游MyD88依赖性信号通路有一定程度的拮抗作用,对TLR4介导的TLR4/MyD88/NF-κB通路可能具有阻断作用。而各剂量组的TRAF6表达水平与模型组比较下降趋势最为显着,这可能是由于TRAF6处于TLR信号通路介导的细胞凋亡和炎症活化反应的中心点,起着至关重要的桥梁作用。这与AS发病机制的主流学说“炎症学说”相一致[10]。
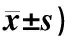
表4 各组小鼠MyD88非依赖性通路元件mRNA和蛋白表达水平比较(相对表达量,
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01

注:1.正常组;2.模型组;3.辛伐他汀对照组;4.灵芝多糖低浓度组;5.0灵芝多糖中浓度组;6.灵芝多糖高浓度组图3 各组小鼠TLR4、NF-κB、MyD88和TRAF-6蛋白表达比较

注:1.正常组;2.模型组;3.辛伐他汀对照组;4.灵芝多糖低浓度组;5.灵芝多糖中浓度组;6.灵芝多糖高浓度组图4 各组小鼠TRAM和TRIF蛋白表达比较
TLR4还可不依赖MyD88激活IRF-3、IRF-7和NF-κB,通过相关接头分子TRAM作用于TRIF,随后结合TRAF6并活化IKK复合体,致使IκB泛素化,最终NF-κB释放至细胞核,一系列炎症反应由此产生[11]。而当前研究提示,MyD88非依赖途径仅存在于TLR3和TLR4通路中[12-13]。本实验结果显示,与正常组比较,模型组小鼠TRAM、TRIF mRNA及蛋白表达明显升高,采用GLPs干预后指标表达有所降低,但差异无统计学意义。因此,推测GLPs对TLR4介导的MyD88非依赖性信号通路可能无阻断作用。
在AS疗效方面,中药治疗组的疗效不如西药对照组,并未显示出明显的浓度依赖性。这与中药在适当剂量时起效慢、疗程长的现象相吻合。GLPs空间构型复杂,本身即具有双向调节作用,而此调节作用主要受药物剂量、配伍、炮制加工、药物代谢动力学等因素的影响。因此,GLPs适宜剂量还需通过调整相应用药量、用药时间及方式来加以改善。与此同时,GLPs发挥免疫功能和抗炎效用的分子机制目前尚无具体定论[14-16]。其抗AS分子机制除TLRs/TLR4之外,可能还存在同时与多种受体结合,激活多条信号通路相互作用,而多糖与受体亲和力的差异又将导致不同传导通路对细胞激活效应的不同。因此,各种细胞表面模式识别受体的相互拮抗或协同调控机制仍需进一步的研究。



