欧凯西, 刘 捷, 赵玉民, 张 缘, 周子意, 余成浩△
(1.成都中医药大学基础医学院,成都 611137;2.西南特色中药资源国家重点实验室,成都 611137)
风热清口服液由“桔梗汤”和“青黛饮”两方加熊胆粉组成,纵观全方具有清热解毒、宣肺透表、利咽化痰的功能,适用于外感风热所致的发热、微恶风寒、头痛、咳嗽、流涕、口渴、咽痛以及急性上呼吸道感染见上述症状者[1-2]。已有学者对风热清口服液的部分药效学进行了研究及探索,但其镇痛药效作用及抗炎镇痛的作用机制尚未见文献报道。本研究通过小鼠二甲苯耳肿胀试验、小鼠醋酸扭体试验以及小鼠热板试验探讨风热清口服液的抗炎镇痛药效作用及其机制,为风热清口服液临床运用提供实验参考及依据。本研究已通过成都中医药大学实验动物伦理委员会审查,伦理学批号2020-13。
1 材料
1.1 动物
SPF级昆明种小鼠150只,雌雄兼用,体质量18~22 g,由斯贝福(北京)生物技术有限公司提供,实验动物生产许可证号SCXK(京)2019-0010。饲养于成都中医药大学动物中心,温度维持在20~25 ℃,湿度维持在40%~70%。
1.2 主要药品及试剂
风热清口服液(由四川省新鹿药业有限公司提供,规格:10 mL/瓶,国药准字Z10950074);醋酸地塞米松(由浙江仙琚制药股份有限公司生产,规格:0.75 mg/片,产品批号:191059);盐酸曲马多缓释片(Farmaceutici Formenti S.p.A.公司生产,德国格兰泰有限公司包装,规格:0.1 g/片,批号:612R01);二甲苯(天津市致远化学试剂有限公司,批号:20200720;含量≥99.0%);冰醋酸(天津市致远化学试剂有限公司,批号:2020071046;含量≥99.5%);ELISA试剂盒肿瘤坏死因子α(tumor necrosis factor-α,TNF-α,依科赛生物科技有限公司,货号:22J289);白介素10(interleukin-10,IL-10,货号:22J295)、白介素4(interleukin-4,IL-4,货号:22J271)试剂盒均购自依科赛生物科技有限公司;组胺(histamine,HIS,货号:1W16HYANYC)、前列腺素E2(prostaglandin E2,PEG2,货号:6 MQ6Z23HQC)、β-内啡肽(β-endorphin,β-EP,货号:AQK27ESQ2Y)、缓激肽(bradykinin,BK,货号:SHMCLQPZCH)试剂盒均购自伊莱瑞特生物技术有限公司;BCA蛋白定量试剂盒(大连美仑生物技术有限公司,货号:MA0082-2-Jan-09F)。
1.3 主要仪器
电子天平(上海越平科学仪器制造有限公司FA2004B);电动匀浆器(天根OSE-Y300);酶标仪(BioTek CYT5MFV);低温离心机(四川蜀科仪器有限公司18091304);RB-200热板仪(成都泰盟软件有限公司)。
1.4 分组及药液配制
将昆明小鼠随机分为5组,模型组、阳性药对照组(醋酸地塞米松组或盐酸曲马多缓释片组)、风热清口服液低剂量组、风热清口服液中剂量组、风热清口服液高剂量组。醋酸地塞米松组:给药量为3 mg/kg,实验用蒸馏水配制成0.3 mg/mL的混悬液备用;盐酸曲马多缓释片组:给药量为30 mg/kg,实验用蒸馏水配制成3 mg/mL的混悬液备用;风热清口服液低剂量组:给药量为5.0125 g/kg,实验将风热清口服液原液用蒸馏水稀释4倍备用;风热清口服液中剂量组:给药量为10.025 g/kg,实验将风热清口服液原液用蒸馏水稀释2倍备用;风热清口服液高剂量组:给药量为20.05 g/kg,实验用风热清口服液原液。
2 方法
2.1 抗炎试验
观察风热清口服液对小鼠二甲苯耳廓肿胀的影响。取昆明小鼠50只,雌雄各半,随机分为5组各10只。适应性喂养3 d,醋酸地塞米松组作为阳性药对照组,按组分别灌胃蒸馏水、醋酸地塞米松药液、风热清口服液药液,给药体积为10 mL/kg,每日1次,连续7 d。末次给药1 h后,用移液枪取50 μL二甲苯,均匀涂抹于每组小鼠右耳的正反两面致炎,并观察昆明小鼠致炎后的状态,涂抹二甲苯30 min后处死昆明小鼠,沿耳廓基线分别剪下左耳和右耳,并用打孔器在左右耳同一位置取直径为8 mm的圆形耳片,用万分之一电子分析天平称耳片质量,按以下公式计算小鼠耳肿胀度和肿胀抑制率:肿胀度=右耳片质量-左耳片质量。耳肿胀抑制率=(模型组平均耳肿胀度-给药组平均耳肿胀度)/模型组平均耳肿胀度×100%。
将每组取下的右耳放入EP管中,-80 ℃保存,待之后制备耳组织匀浆提取蛋白,用ELISA法检测制备的组织匀浆上清液中TNF-α、IL-10、IL-4和组胺含量。
2.2 镇痛试验
2.2.1 风热清口服液对小鼠醋酸扭体的影响 取昆明种小鼠50只,雌雄各半,按随机数字表法分为5组各10只,盐酸曲马多缓释片组作为阳性药对照组,按组分别灌胃蒸馏水、盐酸曲马多缓释片药液、风热清口服液药液,给药体积10 mL/kg,每日1次,连续7 d。末次给药1 h后,在室温22 ℃环境下腹腔注射0.6%醋酸10 mL/kg,观察注射醋酸后的小鼠状态,以小鼠后肢及躯干伸长、腹部内陷、臀部高起1次定义为1次扭体反应,并记录扭体反应的潜伏期以及15 min内扭体次数。用以下公式计算出扭体抑制率:扭体抑制率=[(模型组扭体平均次数-给药组扭体平均次数)/模型组扭体平均次数]×100%。小鼠扭体反应观察结束后迅速摘眼球取血,分离血清,-80 ℃保存,ELISA法检测小鼠血清中PGE2、β-EP、BK的含量。
2.2.2 风热清口服液对小鼠热板的影响 热板温度调节至(55±0.5) ℃,将昆明小鼠置于热板上,分别测定给药前每只昆明小鼠的正常痛阈值(以小鼠置于热板上至开始舔舐后足所需要的时间作为痛阈值),筛选基础痛阈值在5 s~30 s的雌性昆明小鼠50只,随机分为5组各10只。末次给药后30 min、60 min、90 min、120 min分别测量各小鼠的痛阈值,记录结果并进行比较。
小鼠观察结束后迅速摘眼球取血,分离血清,-80 ℃保存,ELISA法检测小鼠血清中PGE2、β-EP、BK的含量。
2.3 统计学方法
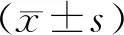
3 结果
3.1 各组小鼠耳肿胀结果
表1示,模型组昆明小鼠涂抹二甲苯后均出现烦躁不安、抓挠右耳,可见右耳快速红肿充血,其充血红肿情况与左耳比较有明显差异。风热清口服液低、中剂量组比模型组小鼠耳肿胀程度明显减轻(P<0.05)。
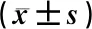
表1 风热清口服液对二甲苯致炎小鼠耳肿胀的影响
3.2 各组小鼠耳组织中炎症因子含量结果
表2示,风热清口服液低剂量组与模型组比较,可减少小鼠耳组织中TNF-α、组胺含量(P<0.05),并提高IL-4含量(P<0.01);风热清口服液中剂量组与模型组比较,可减少小鼠耳组织中组胺含量(P<0.05),提高IL-4含量(P<0.05),风热清口服液各组与模型组比较,耳组织中IL-10的含量差异无统计学意义(P>0.05)。
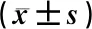
表2 风热清口服液对二甲苯致炎小鼠耳组织中TNF-α、IL-10、IL-4、组胺的影响
3.3 各组小鼠醋酸扭体试验结果
表3示,腹腔注射0.6%醋酸后模型组小鼠扭体阳性率为100%,出现典型的扭体动作躯干和后肢因刺激而伸长、腹腔凹陷、臀部高起。风热清口服液低、中、高剂量组扭体潜伏期与模型组比较扭体潜伏期有一定的延长,但差异无统计学意义(P>0.05)。风热清口服液低剂量组与模型组比较可减少小鼠扭体次数(P<0.05),且低剂量组扭体抑制率达到49.02%。
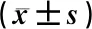
表3 风热清口服液对小鼠醋酸扭体的影响
3.4 各组小鼠血清PGE2、β-EP、BK含量结果
表4示,风热清口服液低剂量能降低醋酸扭体小鼠血清中的PGE2含量(P<0.05);风热清口服液低、中、高剂量能提高醋酸扭体小鼠血清中的β-EP含量(P<0.05);风热清口服液低、中、高剂量组中检测到BK含量与模型组比较虽有所降低,但差异无统计学意义(P>0.05)。
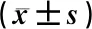
表4 风热清口服液对扭体小鼠血清PGE2、β-EP、BK含量的影响
3.5 各组小鼠热板试验结果
表5示,将昆明小鼠置于温度调节至(55±0.5) ℃的热板上,小鼠因疼痛而出现舔后足的表现。各组之间给药前的基础痛阈值差异无统计学意义(P>0.05)。风热清口服液中、高剂量能延长小鼠给药30 min后的痛阈值(P<0.05);风热清高剂量能延长小鼠给药60 min后的痛阈值(P<0.01)。
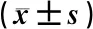
表5 风热清口服液对热板小鼠的影响
3.6 各组小鼠血清PGE2、β-EP、BK含量结果
表6示,风热清口服液高剂量能降低热板小鼠血清中PGE2含量(P<0.05);风热清口服液中、高剂量能降低热板小鼠血清中BK含量(P<0.01),并提高热板小鼠血清中β-EP含量(P<0.01)。
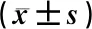
表6 风热清口服液对热板小鼠血清PGE2、β-EP、BK含量的影响
4 讨论
风热清口服液主要由山银花、青黛、熊胆粉、瓜蒌皮、桔梗、甘草组成。山银花、桔梗可疏散风热,清利咽喉,熊胆粉、青黛清热解毒,瓜蒌皮生津养阴,全方配伍精当,可运用于外感风热证。小鼠二甲苯耳肿胀模型是经典的抗炎模型,二甲苯可在涂抹局部诱导组胺、激肽等炎症介质释放,进而导致局部毛细血管通透性增加和炎症细胞浸润[3]。其中最关键的促炎因子则是TNF-α,该因子能够促进上皮、淋巴细胞产生多种黏附分子,并诱导趋化因子的生成,从而介导炎性细胞向炎症局部聚集,最终造成组织损伤、炎症等病理变化[4]。而当机体遭受炎症刺激时,不仅会分泌促炎因子,也会产生大量抗炎因子,其中IL-4、IL-10是单核巨噬细胞分泌促炎因子的重要负调节因子[5,6],可以抑制促炎细胞因子的表达,限制组织损伤[7]。本研究表明,风热清口服液低、中剂量对二甲苯耳肿胀模型有抑制作用,提示风热清口服液具有抗炎作用。对其作用机制进一步研究发现,风热清口服液低剂量组能抑制耳组织中致炎因子TNF-α的含量,且低剂量和中剂量组能抑制耳组织中组胺的含量,同时提高抗炎因子IL-4的含量,说明风热清口服液不仅能降低促炎因子,还能促进抗炎因子的分泌,通过正负反馈双向调节达到抑制炎症作用。
小鼠热板试验与醋酸扭体试验是热刺激和化学刺激的致痛模型。在镇痛研究中,PGE2是重要指标,许多实验都表明在外周和中枢组织中PGE2具有诱导疼痛的作用。Ferreira等[8]通过对大鼠皮下注射PGE2,可导致大鼠痛觉过敏。β-EP是一种内源性阿片肽,具有调节应激反应、免疫机能和中枢镇痛等功能,它可通过减少神经元P物质释放,抑制伤害性感受器兴奋,达到抑制痛觉传导的作用[9]。BK在调节疼痛感觉的有关离子通道表达方面起关键作用,是公认的致痛物质[10]。本研究表明,风热清口服液低剂量能抑制醋酸扭体小鼠的扭体次数,且风热清口服液低中高剂量均能提高醋酸扭体小鼠血清中镇痛物质β-EP的含量,风热清口服液低剂量组还能抑制致痛物质PGE2的含量。在小鼠热板试验中,风热清中剂量在给药30 min后对小鼠热板疼痛反应具有抑制作用,风热清高剂量在给药30、60 min对小鼠热板疼痛反应具有抑制作用。风热清口服液高剂量能抑制热板小鼠血清中PGE2、BK含量,并提高β-EP含量;风热清口服液中剂量能减少BK含量,提高β-EP含量,说明风热清口服液对热刺激及化学刺激的致痛模型均具有一定的镇痛作用。并在机制研究中发现,风热清口服液能通过减少致痛物质、提高镇痛物质,共同达到镇痛作用。
综上所述,风热清口服液具有抗炎镇痛作用,其抗炎作用机制可能与抑制耳组织中促炎因子TNF-α、组胺和增强抗炎因子IL-4的含量有关,镇痛作用机制可能与抑制血清中的致痛物质PGE2、BK含量和促进镇痛物质β-EP的释放有关。



