(1徐州医科大学研究生学院,江苏 徐州 221004;2.徐州医科大学附属医院泌尿外科,江苏 徐州 221006)
膀胱癌是泌尿系统最常见的恶性肿瘤之一。近些年,随着人们生活方式的改变,膀胱癌的发病率日益上升。根据美国癌症协会的最新估计,2021年美国的新发膀胱癌患者将达83 730例,在所有恶性肿瘤中排名第四[1]。虽然我国膀胱癌的发病率较美国低,但2020年我国男性新发膀胱癌患者达到了66 242例,在所有恶性肿瘤中排名第八[2];女性膀胱癌发病率虽低于男性,但也有逐年上升的趋势。
目前,临床上治疗膀胱癌的主要方法仍是外科手术。膀胱根治性切除术一直以来都被认为是治疗高危非肌层浸润性膀胱癌以及TNM分期为T2~T4a、N0~Nx、M0的肌层浸润性膀胱癌的金标准[3-4]。但是,患者术后均面临尿流改道的问题。如今,尿流改道的主要方式为输尿管皮肤造瘘术、回肠膀胱术(Bricker术)以及回肠原位新膀胱术[5]。Bricker术后并发症较多,且对于肥胖及肠系膜短的患者手术难度较大,目前临床上已较少采用[6]。回肠原位新膀胱术相较于输尿管皮肤造瘘术更接近正常人的解剖和生理特点,患者术后无需终生携带集尿袋,能显着提高患者术后生活质量,因此被大多数患者及医生所采纳。
尽管回肠原位新膀胱术优势明显,但新膀胱的构建方式受医生主观影响较大,尚无统一标准。目前临床上主要的新膀胱构建方式为W形和U形新膀胱。W形新膀胱因其高度接近正常膀胱的生理功能,被广泛应用于膀胱根治性切除术后的膀胱重建;U形新膀胱由于所截取的肠段短,对肠道干扰少,也逐渐成为新膀胱的常见构建方式;但目前关于这2种新膀胱的疗效仍缺乏对照研究验证其优劣性。本研究回顾性分析了采用腹腔镜下膀胱根治性切除联合原位U形或W形回肠新膀胱术治疗的68例膀胱癌患者的临床资料,比较2种新膀胱构建方式的优劣,以期为膀胱癌的临床治疗提供参考依据。
1 资料与方法
1.1 临床资料
回顾性分析2016年1月至2019年12月我院收治的68例膀胱癌患者的临床资料。纳入标准:①术前经膀胱镜活检或膀胱肿瘤电切术确诊为膀胱癌;②TNM分期为T2~T4a、N0~Nx、M0或被列为高危的Ta、T1及原位癌;③手术方式为腹腔镜下膀胱根治性切除联合原位U形或W形回肠新膀胱术;④临床资料完整。排除标准:①影像学检查或其他证据提示患者有淋巴结转移或远处转移;②合并其他肿瘤;③患有严重器质性疾病,经相关科室评估,无法耐受手术。本研究符合伦理学原则且经我院伦理委员会审批通过。
根据回肠新膀胱的构建方式将患者分为2组,U组28例患者构建U形新膀胱,W组40例患者构建W形新膀胱。U组患者男26例,女2例;年龄30~71岁,平均(57.86±8.42)岁;BMI(23.92±3.17)kg/m2;病理类型:尿路上皮癌26例,腺癌2例。W组患者男37例,女3例;年龄33~79岁,平均(61.40±10.94)岁;BMI(24.58±2.54)kg/m2;病理类型:尿路上皮癌35例,腺癌4例,平滑肌肉瘤1例。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 术前准备
所有患者术前无渣饮食1周,术前3 d开始口服抗菌药物,术前1 d进行清洁灌肠,以保证肠道准备良好。合并高血压、糖尿病的患者,术前应积极控制血压及血糖至达标;正在口服阿司匹林等抗凝或抗血小板药物的患者,应至少停药1周。术前对所有患者进行肺功能、心电图、心脏彩超等检查,并邀请相应科室会诊,排除手术禁忌。
1.3 手术方法
膀胱根治性切除术:患者全身麻醉,臀部垫高,术野常规消毒、铺巾。于脐下缘切开皮肤及皮下,置入10 mm Trocar,建立人工气腹,置入腹腔镜。直视下于脐下2~3 cm左右腹直肌旁及左右髂前上嵴内上方2~3 cm处分别置入12 mm Trocar及5 mm Trocar,作为操作孔。首先显露盆腔,观察髂血管及输尿管。改变患者体位为头低足高位,找到输尿管,逐步向下游离至膀胱并切断,沿髂外动脉表面剪开腹膜及髂血管鞘,由远及近清除髂内、外动静脉及闭孔神经周围淋巴脂肪组织,手术顺序先右后左。男性患者上提膀胱,暴露输精管,于近精囊处切断输精管,上推精囊,于精囊下方打开狄氏筋膜,显露直肠前脂肪,沿此平面逐步分离,直达前列腺尖部;再次打开耻骨膀胱间隙,沿着前列腺外侧边缘继续分离,打开左右盆内筋膜,切断耻骨前列腺韧带,暴露阴茎背静脉复合体,用Hemo-lok夹及超声刀处理两侧膀胱侧韧带,注意勿伤及直肠,将阴茎背深静脉复合体切断并缝扎,电凝前列腺静脉丛,部分缝扎,分离前列腺达盆膈处,切开后从尿道前壁取出尿管,钳夹尿道并切断,于下腹正中取5~6 cm切口,依次切开至腹腔,取出膀胱标本。对于无生育需求的老年女性患者,同时切除子宫及双侧附件,从阴道取出标本,膀胱切除步骤与男性患者相同;对于有生育需求的青年女性患者,依据患者意见可行单纯膀胱根治性切除术,保留子宫与附件。
体外重建新膀胱:患者改为平卧位,在距回盲部约20 cm处游离并截取保留系膜的回肠段40~45 cm,端端吻合两回肠断端,检查无活动性出血、缺血青紫现象后,缝合肠系膜裂隙。将保留的回肠段沿着系膜缘的对侧纵向剖开,形成肠片。U组患者U形对折(图1a),W组患者W形对折(图1b),闭合形成储尿囊。将输尿管以可吸收缝线种植于近端未切开回肠,并分别放置F6号单J管,于新膀胱最下方作1个1.5 cm的切口,可吸收缝线加固切缘,将新膀胱放入盆腔。关闭腹壁切口,继续腹腔镜操作,以F20号尿管作为支架,缝合新膀胱和尿道残端,尿管气囊注水,用医用胶带将其牵拉固定于大腿内侧,并持续牵引。于新膀胱内注入生理盐水,检查有无漏尿。用Hemo-lok夹间断关闭腹膜,放置腹腔引流管、盆腔引流管各1根。
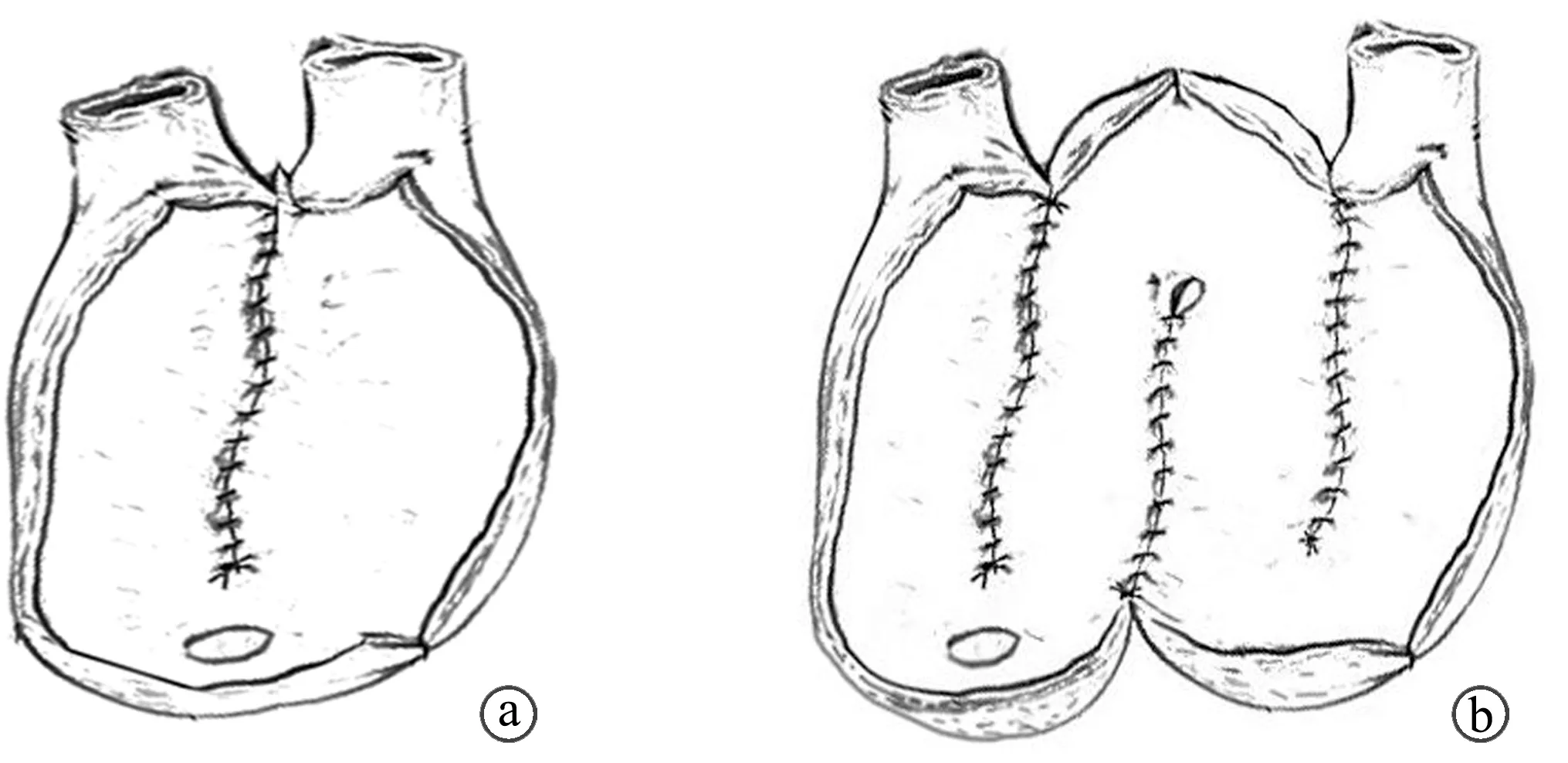
a:U形新膀胱示意图;b;W形新膀胱示意图图1 2组新膀胱示意图
1.4 术后处理
术后放置胃管,直至患者肠道功能恢复。禁食4~5 d,予以静脉高营养支持。自术后3 d开始,每天以5%碳酸氢钠液人工冲洗膀胱2次。视引流量情况,于术后12~14 d拔除输尿管支架管,于术后2~3周拔除尿管。同时指导患者定时排尿、运用腹压排尿,并进行提肛运动以锻炼盆底肌。术后定期复查,包括排尿情况、尿流动力学检查、腹部CT,必要时可行膀胱镜检查。
1.5 观察指标
比较2组患者以下指标:①围术期相关指标,包括手术时间、术中出血量、术后排气时间、术后住院时间;②术后随访情况,通过门诊随访术后6个月的尿流动力学相关指标(最大尿流率、残余尿量、新膀胱容量)及尿控情况;③术后并发症发生率,包括肠梗阻、吻合口漏尿、感染、尿失禁、肾积水等。
1.6 统计学方法
2 结果
2.1 患者围术期相关指标比较
患者均顺利完成手术,均未更换手术方式。U组患者手术时间及术后排气时间短于W组,差异有统计学意义(P<0.05)。2组患者术中出血量及术后住院时间比较,差异无统计学意义(P>0.05),见表1。
2.2 患者术后随访情况比较
所有患者术后随访6个月。术后6个月,U组患者新膀胱容量小于W组,差异具有统计学意义(P<0.05)。2组患者最大尿流率及残余尿量比较,差异无统计学意义(P>0.05),见表2。所有患者拔除导尿管后均能自主排尿,无需导尿。拔除导尿管后对患者进行电话随访,其中U组25例(89.29%)患者日间尿控满意,18例(64.29%)患者夜间尿控满意;W组36例(90.00%)患者日间尿控满意,35例(87.50%)患者夜间尿控满意。2组患者日间尿控满意率均高于夜间尿控满意率,差异具有统计学意义(P<0.05)。
表1 患者围术期相关指标比较
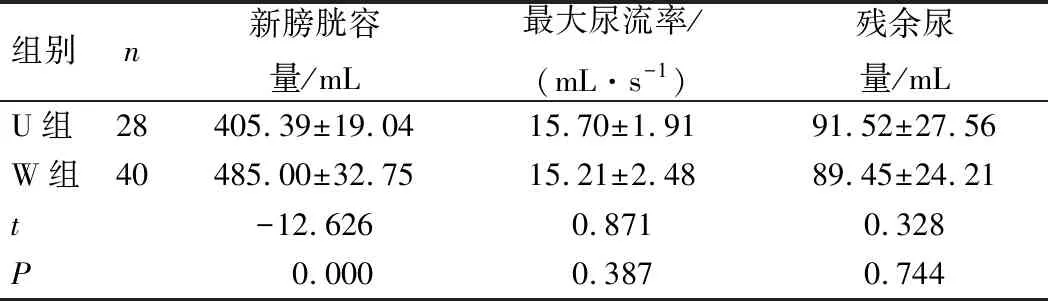
表2 患者术后6个月尿流动力学指标比较
2.3 患者术后并发症情况比较
2组患者术后并发症总发生率比较,差异无统计学意义(P>0.05)。U组患者术后尿失禁发生率高于W组(P>0.05);但2组术后感染、吻合口漏尿、肠梗阻及肾积水发生率比较,差异无统计学意义(P>0.05),见表3。
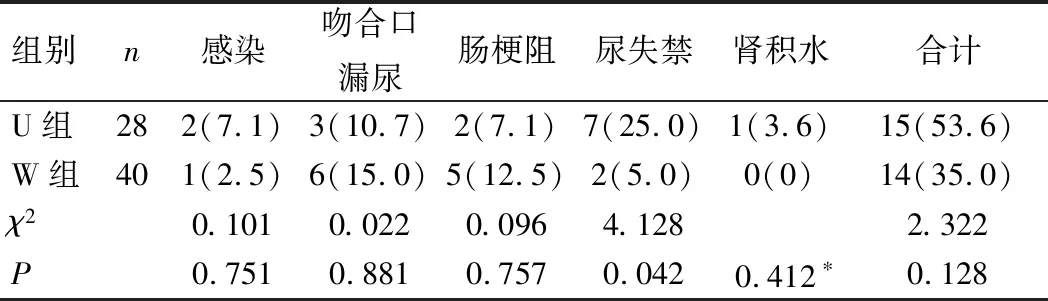
表3 患者术后并发症情况比较[例(%)]
3 讨论
随着人们生活方式的改变,膀胱癌的发病率逐年升高,且极易进展和复发。临床上膀胱癌可分为肌层浸润性膀胱癌和非肌层浸润性膀胱癌。目前非肌层浸润性膀胱癌的主要治疗方法为经尿道膀胱肿瘤电切术,辅以术后膀胱灌注药物(如BCG、吉西他滨、表柔比星等)[7]。但仍有约1/4的非肌层浸润性膀胱癌患者会复发并发展为浸润性膀胱癌,最终需要行膀胱根治性切除术[8]。根据最近的指南[3],对于高危的非肌层浸润性膀胱癌患者和TNM分期为T2~T4a、N0~Nx、M0的肌层浸润性膀胱癌患者,应首选手术治疗。
目前,膀胱根治性切除术分为开放性膀胱根治性切除术、腹腔镜下膀胱根治性切除术和机器人辅助膀胱根治性切除术。有研究表明,接受开放性膀胱根治性切除术、机器人辅助膀胱根治性切除术和腹腔镜下膀胱根治性切除术治疗的膀胱癌患者5年无复发生存率、癌症特异性生存率和总体生存率均无明显统计学差异[9]。但也有研究显示,与开放性膀胱根治性切除术相比,腹腔镜下膀胱根治性切除术可以减少出血量,缩短住院时间,降低并发症发生率[10]。还有一些研究表明,机器人辅助膀胱根治性切除术的肿瘤学结局与腹腔镜下膀胱根治性切除术相似[11],但由于其直接成本较高,目前尚未得到广泛应用。因此,腹腔镜下膀胱根治性切除术仍是目前治疗膀胱癌的主流手术方式。然而膀胱切除后,患者都要进行尿流改道,原位回肠新膀胱可以使患者拥有近乎正常的排尿力学,且无需携带集尿袋,提高了患者的术后生活质量,已经成为膀胱根治性切除术后尿流改道的主要方式。
本研究结果显示,U组患者的手术时间及术后排气时间短于W组。手术时间的长短与术者对解剖结构的了解及手术的熟练程度有关,且W形膀胱的构建方式较U形复杂,需要更长的时间缝合,从而导致W组的手术时间较长。术后排气时间的长短间接反映了患者术后胃肠道功能恢复的情况,术后排气时间长,说明患者术后胃肠道功能恢复慢。术后胃肠道功能的抑制主要与手术操作创伤、胃肠道显露、炎症渗出等因素启动了胃肠道动力的负调控机制有关[12],并且手术时间长短和手术方式亦可能影响胃肠道功能恢复[13]。同时,构建新膀胱时不可避免地会牵拉肠管及其系膜,加之要截取一部分肠管,这些操作均会刺激到腹腔神经丛,使得交感神经元过度兴奋,可能还会刺激一些抑制性激素的释放,导致胃肠道激素紊乱,从而使肠道在术后一段时间内处于生理性麻痹的状态。手术时间较长、对肠管的牵拉及损伤均较重可能是W组患者术后胃肠道功能恢复较慢、排气时间更长的主要原因。
根据基本的几何原理,当肠段的长度固定时,将去管化的肠管做成球形的储尿囊有着最大的储尿量[14-15]。本研究中,U组患者新膀胱容量小于W组,原因为W形新膀胱是将游离出的回肠段去管化后排成W形,然后予以缝合,类似球形,从而使得W形新膀胱比U形新膀胱具有更大的膀胱容量[16]。本研究中2组患者日间尿控均较夜间好,与国外研究结果相似[17],这可能与患者对盆底肌肉的控制有关。白天患者可以自觉地控制骨盆肌肉以减少渗漏;而夜间患者入睡后,排尿意识降低,对尿道括约肌控制减弱,因此,漏尿率升高[18],导致患者夜间尿控满意率比白天低。U组患者术后尿失禁的发生率要高于W组患者,这可能是因为U形新膀胱的肠管未经去管化,且新膀胱呈长筒形,肠管的蠕动较W形新膀胱更明显[5],过多的肠管蠕动会引起膀胱内压增高,从而导致漏尿的发生。术后早期新膀胱容量较小,无法储存大量的尿液,尿失禁发生率较高。但随着时间的推移,膀胱容量逐渐增大,尿失禁的现象也会逐步好转。此外,为了手术切除更加彻底,术中可能会损伤到控制排尿的神经和相应的血管,从而导致术后尿失禁[19]。因此,术中适当保留血管神经有利于降低尿失禁的发生率[20-22]。
综上所述,与U形新膀胱相比,W形新膀胱具有更大的膀胱容量和更低的尿失禁发生率,但W形新膀胱手术时间及术后排气时间较长,患者术后胃肠道功能恢复较慢。本研究也存在一些局限性,纳入患者较少且患者分布不均匀,设计无法控制选择偏倚,因此,需更大的前瞻性研究证实本研究结论。



