许艺珊 许艳冰 许惠贤 蒋 倩
(福建师范大学生命科学学院,福建 福州350108)
1 实验步骤
1.1 培养基母液的配制和保存
用电子天枰逐个称取,依次倒入盛有一定蒸馏水的烧杯中,搅拌混匀溶解,定容至1L,保存在棕色试剂瓶中,贴好标签,注明名称和日期。
1.1.1 MS大量元素母液
1.7g KH2 PO4+3.7g MgSO4·7H2O+16.5gNH4·NO3+19g KNO3+4.4g CaCl2·2H2O。
1.1.2 MS微量元素母液
4.46g MnSO4·4H2O+1.72g ZnSO4·7H2O+1.24g H3BO3+0.166g KI+0.05g Na2MoO4·2H2O+0.005g CuSO4·5H2O+0.005g CoCl2·6H2O。
1.1.3 MS铁盐母液
7.46g Na2·EDTA+5.56g FeSO4·7H2O。
1.1.4 MS有机母液
0.1g甘氨酸+0.02g盐酸硫胺素+0.025g盐酸吡哆素+0.025g烟酸+5g肌醇。
1.2 MS培养基的配制
1.2.1 配制培养液
用量筒或移液管从各种母液中分别取出所需的用量于1L烧杯中,制备培养液:100mlMS大量元素母液+5mlMS微量元素母液+5mlMSMS铁盐母液+20mlMS有机母液。
1.2.2 溶化琼脂与调pH
用天平分别称取琼脂7g、蔗糖30g,放入烧杯中,再加入蒸馏水750 mL,用微波炉加热直到液体呈半透明状。然后再将配好的混合培养液加入到煮沸的琼脂中,再加入生长调节物质:0.5mg/L NAA+2mg/L 6-BA,最后加蒸馏水定容至1L,搅拌均匀。用1 mol/L的NaOH溶液调节pH到6.2为止。
1.2.3 培养基的分装
溶化的培养基趁热分装,瓶中培养基的量约为瓶容量的1/5~1/4,每瓶大约40~50ml,分装23~30瓶即可,及时封盖瓶口,贴上标签。培养基配制完毕后,应立即灭菌。
1.3 实验器皿等的清洗、包扎、灭菌
在组培瓶中加入100ml蒸馏水,准备5瓶,封口包扎;取枪状镊子、普通镊子各1把、2把剪刀,用报纸和橡皮圈包扎好,作为诱导月季不定芽和愈伤组织的接种工具;培养基;2个500ml烧杯、3个培养皿(内有滤纸)用报纸包扎。将以上材料一齐放入高压灭菌锅进行高压灭菌。
1.4 外植体的灭菌消毒及接种
外植体先用肥皂水涮洗,再用流水冲洗干净,放入灭菌的烧杯中。将培养基、无菌水、接种工具、酒精灯等置于接种台,打开超净工作台紫外线开关,同时打开接种室内的紫外灯,用紫外灯照射30min,然后关闭室内的紫外灯,开送风开关,关闭台内的紫外灯,通风10min。再开日光灯进行无菌操作。
接种前用肥皂水洗手,并用酒精棉球擦拭双手和台面。将70%的酒精倒入外植体的烧杯中浸泡30s,再倒入0.1%HgCl浸泡10min,重复无菌水清洗5道。无菌滤纸吸干水分,将茎段和叶片放在装有滤纸的培养皿上吸干水分。接种时茎基部朝下,将其1/3部分植入培养基;叶片应包含一部分中脉,将叶片平置于培养基上,下表面朝下,接触培养基。
在培养瓶上写上日期,移入培养室进行培养。培养温度25度左右,光强1500~20000lx,光照时间14h/d。2周后观察诱导情况。
2 结果与分析
外植体对愈伤组织状态的影响:
经过实验观察,发现两种外植体经过培养均诱导出愈伤组织,叶片和茎段愈伤组织形态上差异不明显,愈伤组织多数呈淡黄色,松散程度不一,但叶片诱导率愈伤组织100%,比茎段稍高。

图1 月季茎段诱导愈伤组织
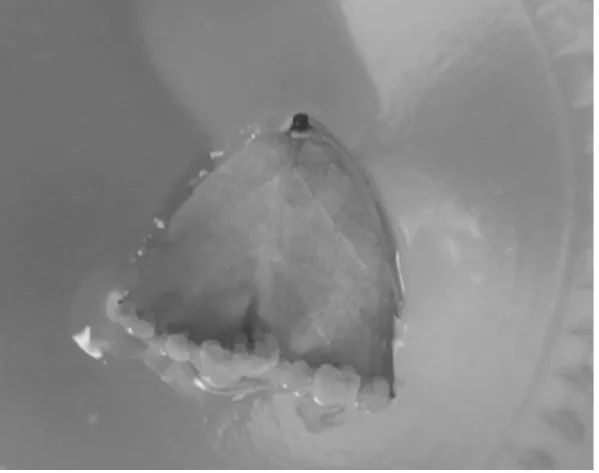
图2 月季叶片诱导愈伤组织
3 小结
叶片和嫩茎均可用于诱导愈伤组织。愈伤组织的形成与否和长势好坏还受外植体材料、生长调节剂浓度、消毒等诸多因素的共同影响。其中,生长调节剂的种类、用量及配比对调控植物器官产生愈伤组织的作用,还有待进一步研究。月季生长繁殖速度较慢,应用组织培养技术可大大缩短它的增殖周期,必将带来巨大的经济效益、社会效益。
[1]邱文青,季静,杜长城.月季组培最优条件的选择[J].天津农业科学,2009,15(3):26-28.
[2]林小洁,李洪清.紫花月季组织培养与快速繁殖研究[J].安徽农业科学,2011,39(19):11380-11381,11385.
[3]王艳红,龚束芳,车代弟.丰花月季愈伤组织的诱导及细胞悬浮培养[J].东北农业大学学报,2007,38(2):161-165.



