耿海峰,张丽珍*,牛 伟
(1.山西大学生物工程学院,山西 太原 030006;2.山西大学生命科学与技术学院,山西 太原 030006;3.山西省农业科学院,山西 太原 030006)
冬枣采后病害拮抗菌的筛选和鉴定
耿海峰1,张丽珍2,*,牛 伟3
(1.山西大学生物工程学院,山西 太原 030006;2.山西大学生命科学与技术学院,山西 太原 030006;3.山西省农业科学院,山西 太原 030006)
从采集的土样中分离筛选11株对冬枣细交链格孢病菌、多隔镰孢霉和美澳核果褐腐串珠霉具有较好抑制作用的拮抗菌。通过平板对峙生长法测抑菌半径。结果表明:其中B26的抑菌效果最显着,对细交链格孢的平均抑菌圈半径为15.8mm,抑制率达78.8%,对冬枣多隔镰孢霉和美澳核果褐腐串珠霉的平均抑菌圈半径分别为14.3mm和12.8mm,抑制率分别达71.3%和63.8%。通过在PDA生长的形态学观察、生理生化实验以及PCR产物测序结果综合分析,初步鉴定B26为枯草芽孢杆菌。
冬枣;病害;拮抗菌;筛选;鉴定
冬枣是我国稀有的优质晚熟鲜食品种,由于它含有19种氨基酸及多种维生素,VC含量高达3.5~6.5g/kg[1],果实清脆可口,素有“百果王”、“活维生素丸”之称,深受人们的青睐。近年来,随着冬枣栽培面积的不断扩大和集约化栽培的发展,冬枣产量也逐年递增。据2001年秋季不完全统计,目前全国冬枣栽培的面积已经有53万亩左右,其中,结果面积9000亩,总产量约7000t以上[2]。冬枣采后在常温下放置10d,腐烂率高达80%,低温贮藏60d左右,果实腐烂严重,丧失食用价值和商品价值[3],由细交链格孢(Alternaria alternata)、多隔镰孢霉(Fusarium decemcellulare Brick)和美澳核果褐腐串珠霉(Monilia fructicola)引起的黑斑病和腐烂病对采后冬枣的产量和品质产生重大影响,危害严重,在实际生产中仍未有合适的耐贮藏的优良品种。为减轻贮藏期和货架期病害损失,防治上大多采用化学杀菌剂[4],由于对食品安全性的要求越来越高,使得水果采后病害防治不宜采用有残留的化学试剂。因此,迫切需要寻求一些新的、无毒高效的防腐防病新技术,以逐步取代化学杀菌剂在采后果蔬上的使用。
借鉴采前作物病害生物防治的思路,人们提出了果
蔬采后病害生物防治的设想。Wilson等[5]提出果蔬采后病害生物防治的主要途径之一就是利用拮抗菌的拮抗作用来控制病原菌,而拮抗作用的主要机理是利用拮抗菌与病原菌竞争营养和生存空间[6-9],此外通过拮抗菌产生抗生素、拮抗菌直接吸附于病原菌导致病菌死亡、诱导水果产生抗性抵御病原菌的侵害是另外几种研究较多的拮抗菌的拮抗机理[10-12]。国内外已有拮抗菌用于水果采后病害研究的报道,Fan等[13]从桃果实的伤口处成功地分离到了能有效防治核果类果实软腐病的酵母菌(Pichia membranefaciens),该生物治防菌可以防治桃果实的软腐病。宋聪等[14]从水果、叶片表面及果园土壤中分离筛选到1株细菌和2株酵母菌,对梨黑斑病菌(Alternaria kik uchiana)、柑橘青霉病菌(Penicillium italicum)都表现出显着的拮抗效果。在冬枣的采后腐烂病的生物防治研究中,有利用梅奇酵母菌(Metschnikowia)的报道[15],但尚未见从土壤中定向筛选芽孢杆菌作为冬枣采后病害生防因子的报道,由于芽孢杆菌能产生耐热、抗逆的芽孢,有利于菌剂的生产,剂型的加工及在环境中存活和定殖与繁殖[16]。为了开展冬枣采后贮藏期各种病害的侵染、发生规律及防治方法的研究,更好的利用微生物资源进行水果采后病害的防治,本实验通过从采集的土样中选择性分离和筛选具有较好拮抗作用的拮抗菌,对它们进行形态学观察、生理生化分析及16S rDNA序列比对研究和鉴定,以期对冬枣的采后病害防治提供新的生防菌资源。
1 材料与方法
1.1 材料与培养基
1.1.1 供试病原菌
细交链格孢(Alternaria al ternata)、多隔镰孢霉(Fusarium decemcellulare Brick)和美澳核果褐腐串珠霉(Monilia fructicola)由山西省农业科学院保鲜所薛梦林老师惠赠。
1.1.2 培养基
用于PCR反应菌种制备的LB培养基,用于分离和筛选拮抗菌及培养病原菌PDA培养基和各种生理生化反应的培养基参照陈天寿[17]的方法制备。
1.2 试剂与仪器
细菌基因组提取试剂盒 宝生物(大连)有限公司。
DYY-8C电泳仪、DYCP-31系列水平电泳槽 北京市六一仪器厂;TC-25/H基因扩增仪 杭州博日科技有限公司;HH-2数显恒温水浴锅、BS-S恒温振荡器 常州国华电器有限公司;HH.BⅡ.600电热恒温培养箱 上海跃进医疗机械厂;YXQ-LS-50压力蒸汽灭菌锅、SW-CJ-1FD洁净工作台 上海博讯实业有限公司医疗设备厂;TGL-16G-C高速台式冷冻离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 拮抗菌的分离
参考张晓舟等[18]采集森林和不同菜园的耕作层下5~10cm的土壤,带回实验室风干、过筛、混匀,每份土样取10g,加入90mL无菌水中,在150r/min摇床上振荡30min后用无菌水进行梯度稀释到10-6、10-7后涂布PDA平板,于37℃培养箱内培养24h左右,并记录菌株的生长情况,然后挑取菌落形态差异明显的单菌落用PDA培养基初筛。
1.3.2 拮抗菌的初筛和复筛
以细交链格孢为指示菌,采用十字交叉法将进入初筛的菌株点接在距平板中央3cm处的4个角点上(图1),平板中央同时移入直径3mm的长有细交链格孢的琼脂块,28℃恒温培养5d后,选出被抑病原菌丝边缘平齐且拮抗作用持久的菌株进入复筛,测量、记录抑菌圈半径(细菌菌落中心至病原菌菌丝边缘)的大小并计算抑制率。
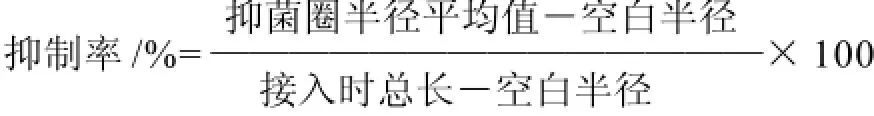
1.3.3 对不同病原真菌的拮抗能力测定
采用平板对峙生长法在平板正中间用接种环划线,培养12~18h后将病菌琼脂块接种于离平板中央2cm处,重复3次,以无菌水作对照,28℃培养5d后观察并记录抑菌圈半径的大小。抑制率的计算同1.3.2节公式。
1.3.4 拮抗菌的初步鉴定
1.3.4.1 拮抗菌的培养特征和形态特征
参考沈萍等[19]观察拮抗菌在PDA平板上培养时生长特征和显微观察形态特征。
1.3.4.2 拮抗菌的生理生化特征
参照《伯杰细菌鉴定手册》[20]和《常见细菌系统鉴定手册》[21]对抑菌效果较好的拮抗菌B26进行了部分代表性的生理生化实验。
1.3.4.3 PCR扩增及序列测定
16S rDNA的PCR扩增及序列测定:以细菌基因组提取试剂盒提取的基因组DNA为模板,以引物1(5′-A T C C T T G T T A C G A C T T G A-3′)和引物2(5′-AGTTTGATCCTGGCTCA-3′)为引物,扩增B26的16S rDNA。PCR的反应体系按照宝生物工程(大连)有限公司Premix Taq(Ex TaqTMVersion)使用说明书配制为(50μL):Premix Taq 25μL,模板DNA 2μL,引物1和引物2各1μL,灭菌双蒸水21μL。经过多次实验探索PCR扩增的条件是:95℃初始变性5min;94℃变性30s,50℃退火30s,72℃延伸1min,30个循环;72℃复性15min。
经1%琼脂糖凝胶电泳检测结果,结果送交宝生物(大连)有限公司进行纯化测序,测序结果提交到NCBI网站上进行同源性比较,下载相关序列,利用软件Clustal2.0和MEGA4.1进行多序列比对,并绘制进化树。
2 结果与分析
2.1 拮抗菌的分离筛选及初步鉴定结果
2.1.1 拮抗菌的分离和筛选
通过稀释采集的土壤悬液,涂布平板,共分离112个差异明显的细菌菌落进入复筛实验阶段。
2.1.2 拮抗菌的复筛结果

图 1 拮抗菌对病原真菌的拮抗作用Fig.1 Antagonistic effects of antagonistic bacteria on pathogenic fungi
通过十字交叉法共从112个经过初筛筛选出的差异明显的菌落中,分离出11株对指示菌株细交链格孢病菌具有抑制作用的拮抗菌,占所分离细菌总数的9.8%。图1是其中8株拮抗菌复筛结果(复筛选后将具有拮抗作用的细菌培养于同一平皿中),从图1可以看出,经过初筛所筛选的拮抗菌具有不同的拮抗性能。
2.2 不同拮抗菌的拮抗性能
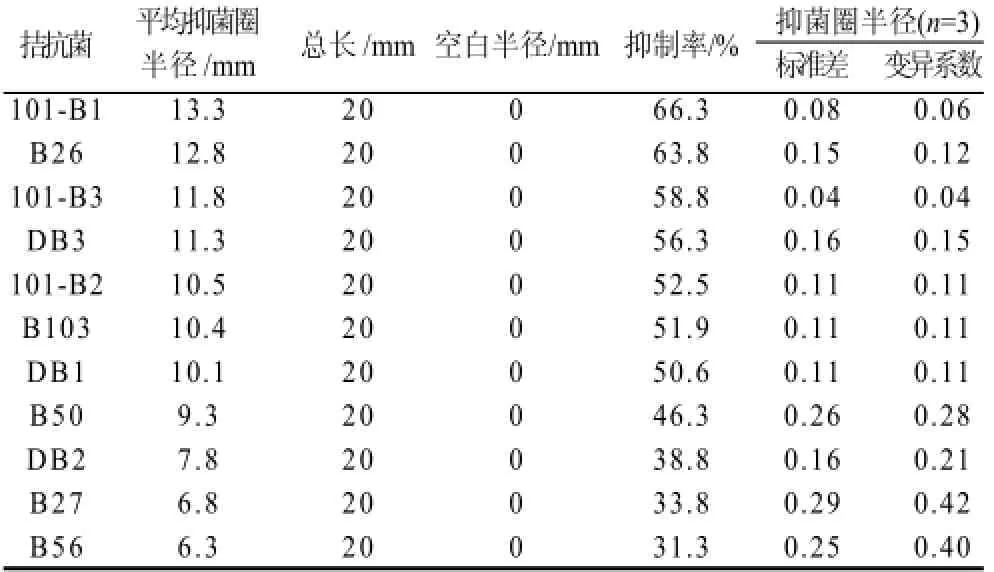
表 1 不同拮抗菌株对美澳核果褐腐串珠霉病原菌的抑制效果Table 1 Antibacterial effects of different antagonistic bacterial strains onMonilia fructicola
实验中筛选出11株拮抗菌,对其对不同的病原菌的拮抗效果进行拮抗实验(拮抗效果最好的菌株见第一列),如表1所示,表中101-B1对美澳核果褐腐串珠霉病原菌的抑菌圈半径最大可达到14.1mm,抑制率可达66.3%。而B26对美澳核果褐腐串珠霉病原菌的平均抑菌圈半径是12.8mm,抑制率为63.8%,相对于其他筛选的拮抗菌具有较好的抑制美澳核果褐腐串珠霉病原菌的能力。
同样通过实验测得结果可知,所筛选的11株拮抗菌对多隔镰孢霉病原菌具有不同的拮抗性能。表2是11株拮抗菌对多隔镰孢霉的抑制效果,可以看出B26对多隔镰孢霉病原菌的抑制效果抑菌圈半径最大可达到15.0mm,平均抑菌圈半径达到14.3mm,抑制率为71.3%,实验显示B26具有较好的抑制多隔镰孢霉病原菌的拮抗能力。
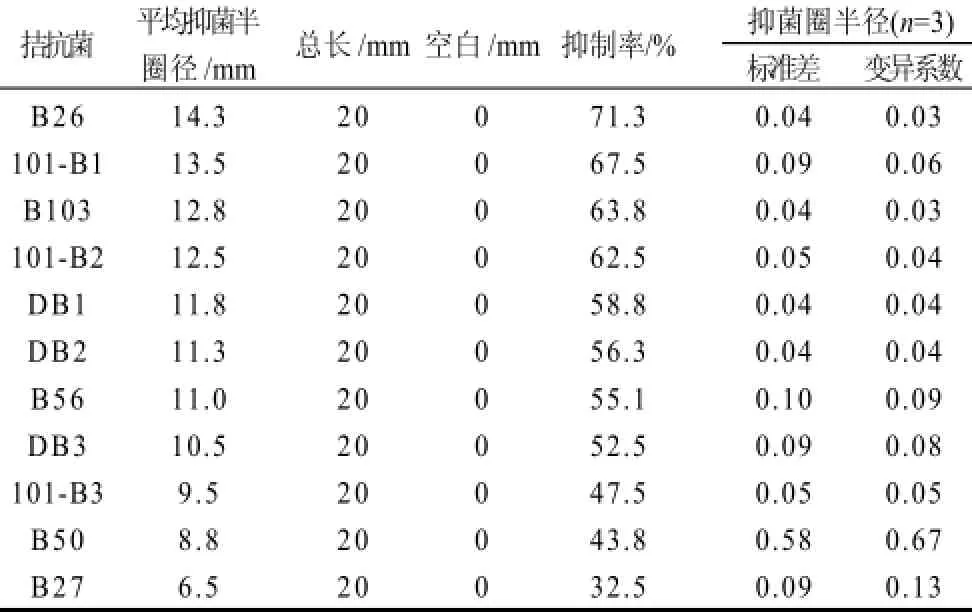
表 2 不同拮抗菌株对多隔镰孢霉病原菌的抑制效果Table 2 Antibacterial effects of different antagonistic bacterial strains onFusarium decemcellulareBrick
表3是11种拮抗菌对细交链格孢的抑制效果,可以看出B26对细交链格孢病原菌的平均抑菌圈半径最大,可达到15.8mm,抑制率可达78.8%,拮抗效果明显优于其他拮抗菌,而且各个数值之间的变异系数较小,拮抗效果比较稳定。
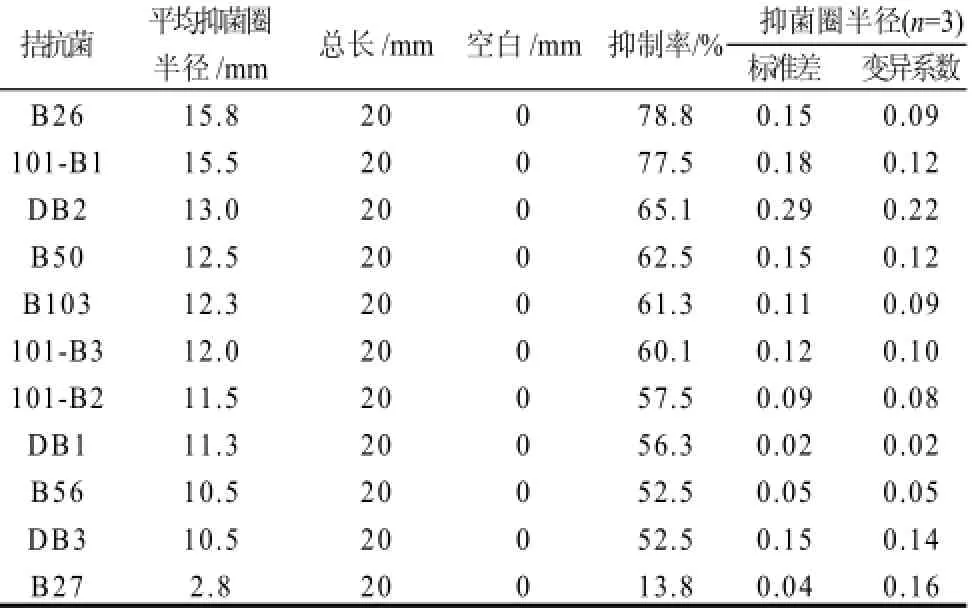
表 3 不同拮抗菌株对细交链格孢病原菌的抑制效果Table 3 Antibacterial effects of different antagonistic bacterial strains onAlternaria alternata
从表1~3中综合分析B26对美澳核果褐腐串珠霉、
多隔镰孢霉和细交链格孢的抑制效果都在60%以上,抑制率分别是63.8%、71.3%、78.8%,其中对细交链格孢的抑制率最大。B26对多隔镰孢霉病菌的抑制作用相对较好,抑菌圈的平均半径在14.3mm,B26对细交链格孢的抑制作用最好,抑菌圈的半径为15.8mm;对峙培养72 h后,可观察到在拮抗菌四周有明显的透明圈,越靠近拮抗菌抑菌圈周围的病原菌,菌落越小,这说明这些拮抗菌产生了一些能在培养基中向四周扩散的抗菌物质。由于拮抗菌B26具有广谱的抗菌活性和抑菌效果,具有很好的应用与发展的前景,因此将侧重于对目的菌株B26的一些理化性质和分子生物学的鉴定。
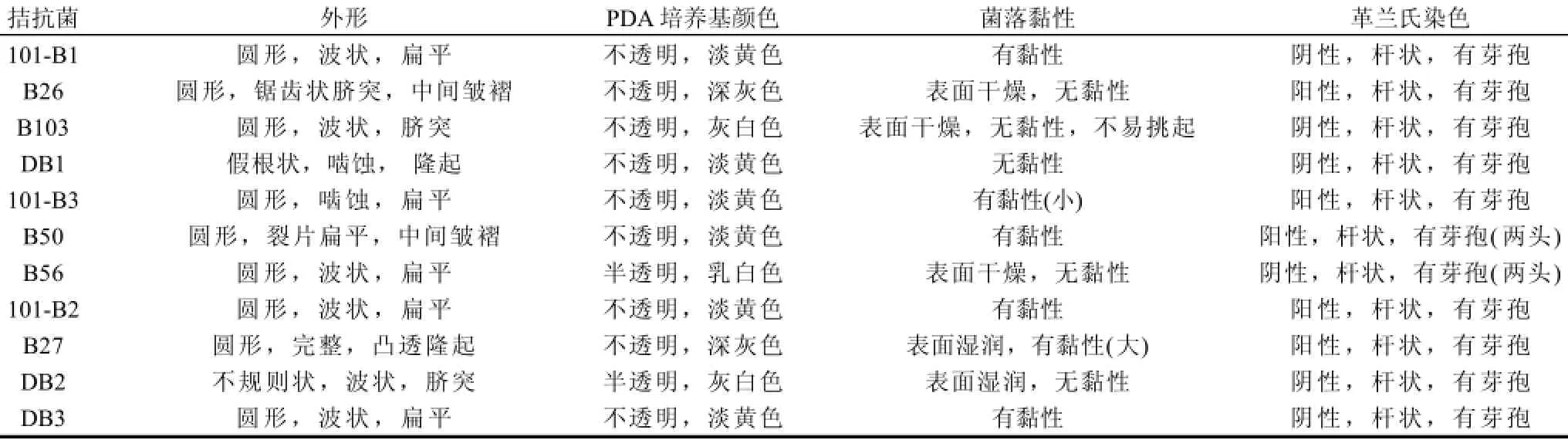
表 4 拮抗菌的形态学观察结果Table 4 Morphological features of antagonistic bacteria
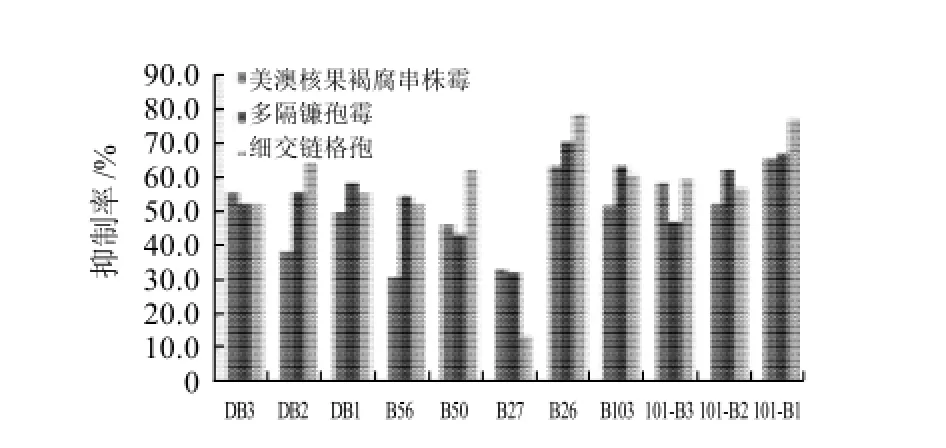
图 2 拮抗菌对不同病菌的抑制率Fig.2 Inhibition rates of antagonistic bacterial strains against different pathogenic fungi
图2是实验中11株拮抗菌对不同种病菌拮抗综合效果图,拮抗菌B26具有较强的拮抗病菌能力,具有抗菌广谱性,图3是实验中拮抗菌对3种病菌的拮抗图。
2.3 拮抗菌的形态学观察和革兰氏染色
拮抗菌B26在PDA培养基上培养时特征见表4,B26外形为圆形,边缘波浪状,菌落不透明,深灰色,随着培养时间出现锯齿状边缘,菌落中间出现皱褶突起,革兰氏染色为阳性,芽孢染色不着色,根据以上特性初步鉴定拮抗菌B26为芽孢杆菌属(Bacillus spp.)。菌株的生理生化实验结果见表5,菌株为生长温度10~50℃生长的pH5.0~9.0能够耐受含10g/100mL的氯化钠,参照文献[21]和《伯杰细菌鉴定手册》[20],初步鉴定该拮抗菌为枯草芽孢杆菌。

表 5 B26菌株的生理生化实验结果Table 5 Physical and biochemical properties of strain B26
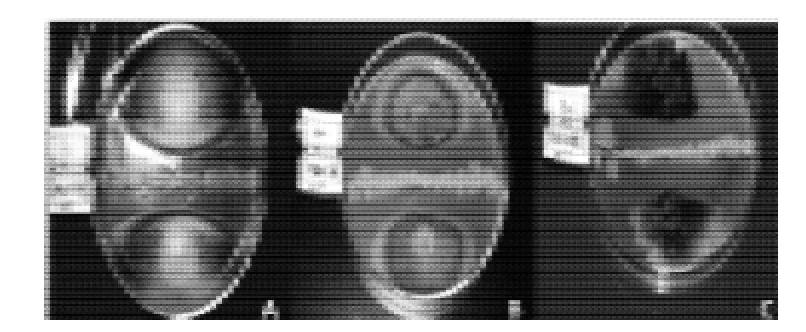
图 3 拮抗菌B26对细交链格孢(A)、多隔镰孢霉(B)和美澳核果褐腐串珠霉(C)的拮抗作用Fig.3 Antagonistic effects of strain B26 onAlternaria alternate,Fusarium decemcellulareBrick andMonilia fructicola
2.4 PCR产物的1%琼脂糖凝胶电泳
经部分测序分析B26扩增16S rDNA序列长为780bp (图4),将B26的16S rDNA在NCBI数据库中进行BLAST,选取相似性较高的15条序列,利用软件进行系统发育分析。通过比对发现其16S rDNA序列与Bacillus subtilis的序列相似性达98%,初步将其判断为枯草芽孢杆菌,图5为系统发育进化树。
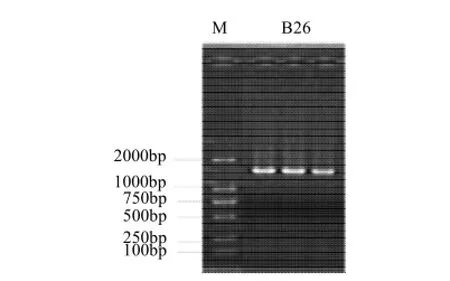
图 4 B26的16SrDNA序列PCR扩增电泳图谱Fig.4 Electrophoresis of 16SrDNA for strain B26

图5 基于16SrDNA序列同源性的15株细菌系统发育树Fig.5 Phylogenetic tree of 15 homologous strains based on 16SrDNA sequences
3 讨 论
在冬枣采后病害拮抗菌筛选中,已有从冬枣果实表面的病健交界处筛选酵母菌防治采后病害取得较好防效的报道,澳大利亚的Huang等[22]从柑橘果实表面分离获得的Bacillus pumilus用于防治茯苓夏橙的绿霉病,表现出和杀菌剂抑霉哇相仿的防效,用于华脐和里斯本柠檬的绿霉病防效也较好。因此,在筛选水果采后病害拮抗菌的过程中,不仅可以从病害发生的自然微生态环境-水果表面附生菌或水果内生菌中筛选,还可以从更广泛的不同生境中筛选,以适应商品化生产时不同需求。基于此,本实验选取不同类型的菜园土及森林土作为拮抗菌筛选源,也是利用土壤细菌防治冬枣采后病害的一种新探索。但是在筛选过程中,筛选方法多参照前人的,缺乏创新性和选择性,培养基的种类及筛选方式缺乏针对性,因此在以后的分离筛选实验中,可以使用特殊的具有高度选择性的分离条件,并使用相应的培养基及筛选方式,以增加发现新拮抗菌的概率。
在以往的研究中发现,一些菌株在平板对峙实验中有较好的抑菌活性,但其代谢产物却没有表现出相应的活性,而菌株B26在平板对峙法和离心提取上清液实验中均表现一定的拮抗效果,对细交链格孢抑制作用明显。在实验中拮抗菌B26对细交链格孢的抑制率达78.8%、对多隔镰孢霉的抑制率达71.3%、对美澳核果褐腐串珠霉的抑制率达63.8%,显示出较好的抑菌作用,具有广谱的抗菌活性。通过该菌株在实验中的防治效果以及抑菌的广谱性可以推测其具有很好的发展前景,具有很大的开发和应用潜力,值得深入研究。筛选和鉴定拮抗菌株只是本课题的一部分,有关拮抗菌最佳培养条件、活性物质的理化性质以及田间防效需要进一步实验和研究。
[1]王绪芬. 提高冬枣产量和品质的关键技术[J]. 北方园艺, 2008(9)∶91-92.
[2]刘炳仁. 冬枣高效栽培技术[M]. 北京∶ 科学献出版社, 2007∶ 2.
[3]刁小琴, 张有林, 关海宁. 冬枣采后病害及其防治技术[J]. 果树, 2006 (1)∶ 42-45.
[4]ECKERT J W, OGAWA J M. The chemical control of postharvest diseases∶ Subtropical and tropical fruits[J]. Annu Rev Phytopathol, 1985, 23∶ 421-454.
[5]WILSON C L, WISNIEWSKI M E. Biological control of postharvest diseases of fruits and vegetables∶ an emerging technology[J]. Annu Rev Phytopathol, 1989, 27∶ 425-441.
[6]DROBY S, CHALUTZ E, WILSON C L, et al. Biological control of postharvest diseases∶ a promising alternative to the use of synthetic fungicides[J]. Phytoparasitica, 1992, 20∶ 1495-1503.
[7]WILSON C L, WISNIEWSKI M E, DROBY E, et al. A selection strategy for microbial antagonists to control postharvest diseases of fruit and vegetables[J]. Scientia Horticulturae, 1993, 53(3)∶ 183-189.
[8]FILONOW A B. Role of com petition for sugars by yeasts in the biocontrol of gray mold of apple[J]. Biocontrol Science and Technology, 1998, 8 (2)∶ 243-256.
[9]IPPOLITO A, NIGRO F. Impact of preharvest application of biological control agents on postharvest diseases of fresh fruit and vegetables[J]. Crop Protection, 2000, 19(8/10)∶ 715-723.
[10]JANISIEWICZ W J, TWORKOSKI T J, SHARER C. Characterizing the mechanism of biological control of postharvest diseases on fruit with a simple method to study competition for nutrients[J]. Phytopathology, 2000, 90(11)∶ 1196-1200.
[11]BARKAI-GOLAN R. Postharvest diseases of fruit and vegetables∶ development and control[M]. The Netherlands∶ Elsevier Sciences, Amasterdam, 2001.
[12]EL-GHAOUTH A, WILSON C L, WISNIEWSKI M E. Biologically based alternatives to synthetic fungicides for the postharvest diseases of fruit and vegetables[M]//NAQVI S A M H. Diseases of fruit and vegetables∶volume Ⅱ diagnosis and management. The Netherlands∶ Kluwer Academic Publishers, 2004∶ 511-535.
[13]FAN Qing, TIAN Shiping. Postharvest biological control of Rhizopus rot on nectarine fruits by Pichia membranefaciens Hansen[J]. Plant Disease, 2000, 84(11)∶ 1212-1216.
[14]宋聪, 李正国, 边万平, 等. 果实采后病害生防菌的筛选及鉴定[J].西南师范大学学报∶ 自然科学版, 2007, 32(2)∶ 76-81.
[15]XUE Menglin, ZHANG Liqun, WANG Qiming, et al. Metschnikowia sinensis sp.nov., Metschnikowia zizyphicola sp.nov.and Metschnikowia shanxiensis sp.nov.,three novel yeast species from jujube fruit[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(9)∶ 2245-2250.
[16]方敦煌, 吴祖建, 邓云龙, 等. 防治烟草赤星病拮抗根际芽孢杆菌的筛选[J]. 植物病理学报, 2006, 36(6)∶ 555-561.
[17]陈天寿. 微生物培养基的制造与应用[M]. 北京∶ 中国农业出版社, 1995.
[18]张晓舟, 徐剑宏, 李顺鹏. 植病生防芽孢杆菌的分离筛选与初步鉴定[J]. 土壤, 2005, 37(1)∶ 85-88.
[19]沈萍, 范秀容, 李广武. 微生物学实验[M]. 北京∶ 高等教育出版社, 1999.
[20]布坎南R E , 吉本斯N E . 伯杰细菌鉴定手册∶ 中文版[M]. 8版. 北京∶ 科学出版社, 1984.
[21]东秀珠, 蔡妙英.常见细菌系统鉴定手册[M]. 北京∶ 科学出版社, 2001.
[22]HUANG Y, WILD B L, MORRIS S C. Postharvest biological control of Penicillium digitatum decay on citrus fruit by Bacillus pumilus[J]. Annals of Applied Biology, 1992, 120(4)∶ 367-372.
Screening and Identification of Antagonistic Bacteria against Post-harvest Diseases of Jujube Fruits
GENG Hai-feng1,ZHANG Li-zhen2,*,NIU Wei3
(1. College of Biological Engineering, Shanxi University, Taiyuan 030006, China;2. College of Life Science and Technology, Shanxi University, Taiyuan 030006, China;3. Shanxi Academy of Agricultural Science, Taiyuan 030006, China)
Eleven strains of antagonistic bacteria were isolated from soil samples and exhibited an excellent antagonistic effect on Alternaria alternate, Fusarium decemcellulare Brick and Monilia fructicola. Results showed strain B26 had the strongest inhibition effect on three selected fungal pathogens. The average radius of inhibition zone was 15.8 mm in plate inhibition test and inhibition rate against Alternaria alternate was 78.8%. Similarly, strain B26 also exhibited inhibition effect on Fusarium decemcellulare Brick and Monilia fructicola with average radius of 14.3 mm and 12.8 mm, and inhibition rate of 71.3 % and 63.8%, respectively. Strain B26 was primarily identified as Bacillus subtilis through the characterization of morphological features, cultural characteristic observation PDA, physiological and biochemical measurements and 16S rDNA sequence analysis of PCR products.
Jujube fruit;post-harvest diseases;antagonistic bacteria;screening;identification
Q939.92
A
1002-6630(2010)09-0150-06
2009-08-31
“十一五”国家科技支撑计划项目(2006BAD01A16);山西省青年基金项目(2008021036-1);山西省留学人员科研项目(2008-119);太原市科技局项目(2008)
耿海峰(1983—),男,硕士研究生,主要从事微生物的资源利用研究。E-mail:ghf030483@163.com
*通信作者:张丽珍(1977—),女,副教授,博士,主要从事微生物生态学研究。E-mail:lizhen@sxu.edu.cn



