赵乃蕊 王光亚 许金秀
[摘要] 肌营养不良症为X-连锁隐性遗传病,是临床罕见病,而合并扩张性心肌病者更是罕见报道。但目前肌营养不良症尚无特效治疗方法,临床上以延缓病情进展为主。维生素D缺乏在扩张性心肌病患者中发挥着潜在作用。本研究报道1例以双下肢进行性乏力就诊的成年男性患者,除家族中有肌营养不良症患者,同时合并扩张性心肌病,伴低血钙、低血磷、低25-羟基维生素D、甲状旁腺素升高等实验室异常。住院期间给予补充活性维生素D及钙剂,患者下肢乏力症状有所缓解。通过分析病例特点及相关文献复习,了解并探讨肌营养不良症、扩张性心肌病、维生素D缺乏及低钙血症之间的相互关系,以期提高临床医师对疾病的认识,减少误诊;提醒临床医师重视维生素D缺乏的危害,增强警惕性。
[关键词] 肌营养不良;维生素D缺乏;低钙血症;继发性甲状旁腺功能亢进;扩张性心肌病
[中图分类号] R591.4 [文献标识码] C [文章编号] 1673-9701(2022)05-0176-04
[Abstract] Muscular dystrophy is an X-linked recessive genetic disease, which is a rare clinical disease, and the combination of dilated cardiomyopathy is even more rarely reported. However, there is no specific treatment for muscular dystrophy. Clinically, it mainly focuses on slowing the progression of the disease. Vitamin D deficiency plays a potential role in patients with dilated cardiomyopathy. This article reports a case of an adult male patient with progressive weakness of both lower limbs. In addition to family members with muscular dystrophy, the patient also had dilated cardiomyopathy, accompanied by laboratory abnormalities such as hypocalcemia, hypophosphate, low 25-hydroxyvitamin D, and elevated parathyroid hormone. During the hospitalization, active vitamin D and calcium were supplemented, and the symptoms of the patient's lower limb weakness were relieved. Through analyzing the characteristics of cases and reviewing relevant literature, the relationship between muscular dystrophy, dilated cardiomyopathy, vitamin D deficiency and hypocalcemia was understood and explored, in order to improve clinicians’ understanding of the disease and reduce misdiagnosis. The clinic physicians should be reminded of attaching importance to the harm of vitamin D deficiency and increasing their vigilance.
[Key words] Muscular dystrophy; Vitamin D deficiency; Hypocalcemia; Secondary hyperparathyroidism; Dilated cardiomyopathy
假肥大型肌营养不良症包括杜兴型肌营养不良症(duchenne muscular dystrophy,DMD)和贝克型肌营养不良(becker muscular dystrophy,BMD),二者均是由抗肌萎缩蛋白基因突变所致的X-连锁隐性遗传病[1]。肌营养不良症是临床罕见病,BMD患者可青年或至成年起病,病情相对轻于DMD患者。BMD患者假性肥大体征明显,并可出现不同程度的心肌受累。国内对于BMD合并扩张性心肌病的研究仍局限于少数个案报道。本研究报道1例BMD合并扩张性心肌病患者,其不仅出现左心功能受损,检查发现其血钙、血磷及低25-羟基维生素D均低于正常。维生素D在维持人体钙磷平衡及骨骼健康方面意义重大,其在糖尿病及其并发症、心血管疾病等作用也日益突出。本研究通过探讨BMD、扩张性心肌病、维生素D缺乏之间存在的相互关联及相互制约关系,以提高临床医师对疾病的认识,减少误诊;并加强对维生素D缺乏的关注,现报道如下。
1 病例资料
患者男性,46岁,农民,河北省沧州人,因“进行性双下肢乏力26年,加重2 d”于2019年12月2日入院。入院26年前患者无明显诱因出现双下肢乏力,开始表现为走路费力,行走过程中出现下肢乏力加重,无肌肉疼痛,无肢体抽搐。病程进展出现抬腿困难,无法上楼梯,自诉曾于外院就诊,未明确诊断。近5年来患者出现步态改变,起床及下蹲起立时困难,症状进行性加重。10 d前患者感冒后出现发热、咳嗽,体温最高达39.5℃,应用“布洛芬”退热可降至正常,体温间断升高,咳白痰,但不易咳出,于当地医院就诊查血沉及CRP升高,诊断急性支气管炎,予抗感染等治疗5 d,发热症状缓解(3 d未发热)。近2 d再次出现发热、咳嗽,且下肢乏力较前加重,为求进一步诊治入沧州市中心医院内分泌糖尿病二科。患者平素喜进素食,睡眠可,大小便正常,外出活动少。既往7个月前因突发胸闷于当地县医院诊断为扩张性心脏病、心力衰竭,平素口服“比索洛尔、地高辛、螺内酯”治疗;否认高血压病、糖尿病、甲亢病史,否认药物过敏史,弟弟及1个外甥有双下肢乏力病史。
1.1 入院体格检查
T 37.2℃,P 100次/min,R 25次/min,BP 136/82 mmHg,神清,面色发黄,咽稍充血,甲状腺无压痛,双肺呼吸音粗,未闻及干湿性啰音,心率100次/min,律齐,心音低,腹软,左中腹部有压痛,肝区、肾区无叩击痛,双下肢不肿。双侧腓肠肌肥大,双上肢肌力Ⅳ级,双下肢肌力Ⅱ级,双下肢腱反射迟钝,双侧肢体深、浅感觉未见异常,双侧巴氏征阴性。
1.2 初步诊断
①双下肢乏力原因待查:低钾血症?进展型重症肌无力?②急性支气管炎;③扩张性心肌病;④心力衰竭。
1.3 入院后相关化验及检查结果
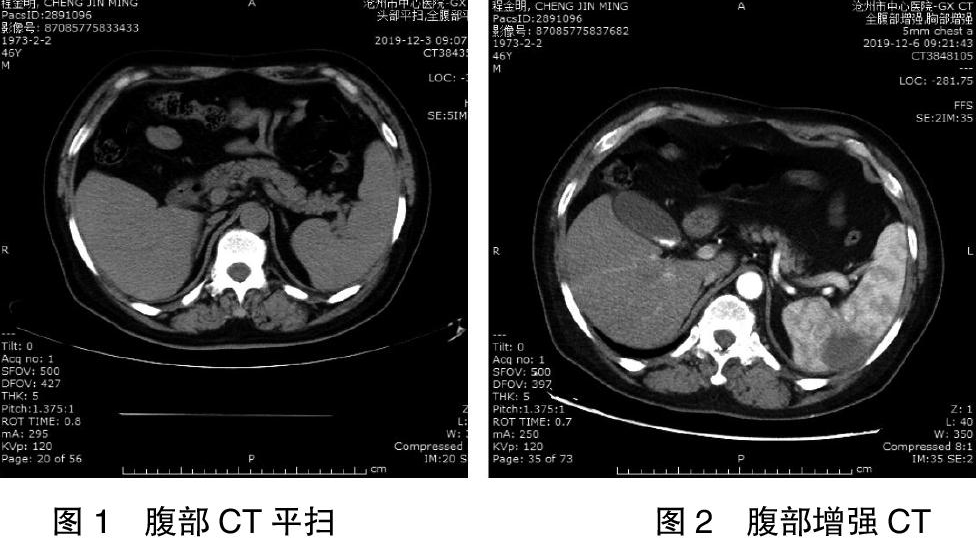
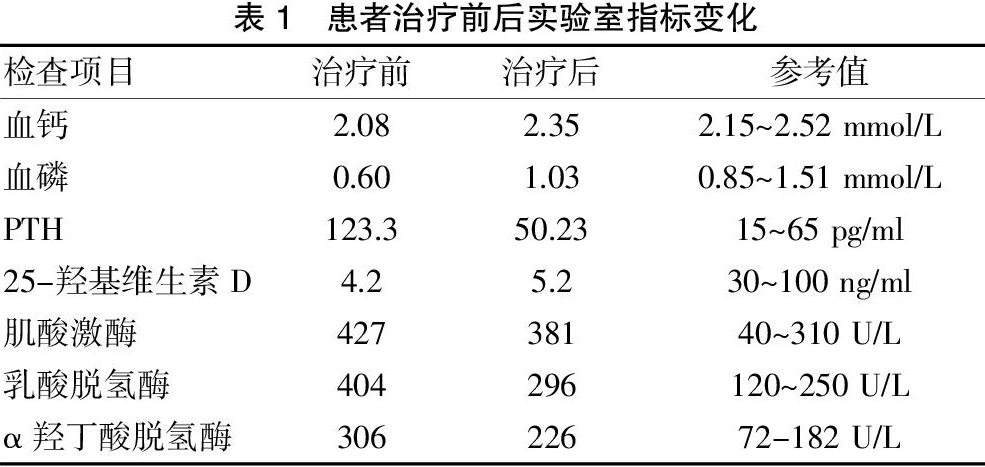
入院急诊生化:钾 3.7 mmol/L,血糖5.3 mmol/L、肌酸激酶 427 U/L(40~310)↑、乳酸脱氢酶 404 U/L(120~250)↑、α羟丁酸脱氢酶 306 U/L(72~182)↑、谷丙转氨酶 48.1 U/L、谷草转氨酶 30.7 U/L;血常规:血红蛋白 137 g/L、淋巴细胞绝对值 0.97×109/L、中性粒细胞绝对值 7.47×109/L、中性粒细胞 83.1%、血小板 203×109/L、红细胞 4.57×1012/L、白细胞 8.99×109/L;D-二聚体 1.58 μg/ml(<0.536)↑;尿液分析:微量白蛋白 >0.15 mg/dl、酸碱度 ≤5.0、尿蛋白 1+;24 h尿总蛋白 0.14 g(0~0.15);血气分析:pH 7.439、PCO2 36.0 mmHg、PO2 77.1 mmHg;血脂:总胆固醇 5.49 mmol/L(<5.2)↑、高密脂蛋白胆固醇 0.57 mmol/L(1.04~1.55)↓、低密脂蛋白胆固醇 4.12 mmol/L(<3.12)↑;钙 2.08 mmol/L(2.15~2.52)↓、磷 0.60 mmol/L(0.85~1.51)↓、24 h尿钙 1.80 mmol/24 h(2.7~7.5)↓、24 h尿磷 6.20 mmol/24 h(12.9~42)↓、碱性磷酸酶 79 U/L(35~135)、甲状旁腺素 123.3 pg/ml(15~65)↓、25-羟基维生素D 4.2 ng/ml(30~100)↓;超敏C-反应蛋白 104.5 mg/L↑、血沉 48 mm/h↑;甲功、免疫八项、超敏肌钙蛋白Ⅰ均未见异常。骨密度检测骨质减少;心脏彩超显示,左心扩大、二尖瓣中量反流、升主动脉扩张、主动脉瓣少量反流、左室舒张功能减低、左心功能测定中度受损(EF值34%);颈动脉+椎动脉+锁骨下动脉彩超显示,双侧颈动脉硬化并斑块形成;双下肢动脉+深静脉+浅表静脉彩超显示,双侧股、腘、胫后及胫前动脉轻度硬化;头部+全腹部CT平扫(图1)显示,①头部CT 平扫未见确切异常;②脾内多发略低密度影,边界不清,邻近脾缘毛糙,建议强化CT;③肝右叶囊肿及钙化点;④胆囊结石;⑤所示心脏增大。胸部+全腹部增强CT回报(图2),①考虑脾梗死;②右肾片状强化减低区,缺血梗死?③肝右叶囊肿及钙化点;④胆囊多发结石;⑤心脏体积增大,符合扩张型心肌病;⑥左肺下叶边缘膨胀不良;⑦左侧胸腔少量积液。
1.4 诊治经过
患者入院前有感染、发热、咳嗽,入院后予抗感染、止咳化痰等对症治疗,患者症状缓解。患者有扩张性心肌病病史,合并心力衰竭,监测24 h出入量,予强心、利尿等对症治疗。患者进行性双下肢乏力病程迁延,查体可见双侧腓肠肌肥大,双下肢肌力Ⅱ级,检查提示,肌酶谱升高、低钙低磷伴PTH升高、扩张性心肌病;另患者弟弟及1个外甥有双下肢乏力病史,起病年龄相似,但症状较患者轻。考虑是否存在基因遗传性疾病,因患者不能准确提供家属相关病史,故联系患者家属来我院,补充家族史,患者弟弟进行性双下肢乏力20余年,6年前于外院诊断为进行性肌营养不良;其外甥进行性双下肢乏力6年,3年前于中国人民解放军总医院查肌肉活检病理诊断:肌营养不良,并行基因检测,在肌营养不良相关基因DMD上发现3号外显子区域存在重复突变,诊断进行性肌营养不良。故考虑患者双下肢乏力诊断为贝克型肌营养不良(BMD)。患者入院后检查发现:低钙、低磷、PTH升高,维生素D减低,结合平素外出活动少,长期进食素食,不除外钙及维生素D摄入不足所致继发性甲旁亢,予补充钙剂及活性维生素D制剂,10 d后复查血钙磷、PTH均正常(各指标变化见表1)。患者因间断左上腹部不适,查CT示脾梗死,肾缺血梗死,请普外科、泌尿外科会诊,建议低分子肝素抗凝治疗,复查CT变化。患者出院后未遵嘱沧州市中心医院复查,1个月后电话随访,患者下肢乏力症状有所缓解。
2 讨论
该患者病例特点,男性,青年起病,双下肢乏力进展缓慢,进行性加重,查体可见双侧腓肠肌肥大,肌力下降;辅助检查:血钾正常、肌酶谱升高、扩张性心肌病、心脏射血分数下降,故在排除内分泌科常见疾病低钾血症的同时,拓展病例线索,很容易检索得出肌营养不良症或抗肌萎缩蛋白病的诊断。进一步追踪患者家族史,结合其外甥基因检测,诊断贝克型肌营养不良(becker muscular dystrophy,BMD)明确。
中华医学会神经病学分会联合神经肌肉病、肌电图与临床神经生理学组在2016年发布了《中国假肥大型肌营养不良症诊治指南》。目前国内最大的DMD/BMD基因突变报告显示,97.91%的患者证实有基因突变,其中大突变占70.41%,重复占8.28%,小突变占19.12%[2]。DMD发病率约1/3500活产男婴,通常认为BMD的发病率为DMD的1/10。DMD患者多3~5岁起病,进行性发展,12岁后不能行走;临床表现为双下肢无力、鸭步、Gowers征、腓肠肌肥大,另有血清肌酸激酶显著升高、肌电图示肌源性受损、超声心动图示左心室扩大及基因检测异常等诊断要点[1]。BMD为该患者进行性双下肢乏力的本源,其临床病程相对于DMD而言,起病晚,病情进展缓慢,预后良好,但病变最后仍可造成患者生活质量的下降。DMD/BMD临床少见,尤其内分泌科医师对其更是不熟悉。但该类患者具有特征性的体征,包括腓肠肌假性肥大和Gowers征,是临床医师需掌握的知识。Gowers征是患者卧位起立的特有临床现象,患者自卧位起立时需先翻转为俯卧位,然后靠双手和双足支撑身体,利用双手交替使力让躯干向后呈深躬位,双腿开始受力,然后一只手支撑膝关节,另一只支撑大腿,最后使躯体直立[3]。本例患者就诊时可见腓肠肌肥大,有Gowers征的描述,而且伴随血清肌酸激酶的升高,结合患者外甥的基因检测进一步印证了该诊断。因此,在某些罕见病诊断时,仔细的体格检查及获取详细的家族史仍然是十分必要的。
而BMD是否与患者扩张性心肌病存在直接关联呢?BMD会导致抗肌萎缩蛋白(dystrophin)的异常生成,dystrophin是一种主要存在于心脏和骨骼肌的大型肌膜蛋白[4]。研究报道约超过70%的BMD患者被诊断为扩张性心肌病[5-6]。心力衰竭是BMD最严重的临床表现和最常见的死亡原因[7]。扩张性心肌病是一种以左心室增大和射血分数<50%为特征的左心室功能障碍。扩张性心肌病最常见的病因是特发性、家族性、急性心肌炎,可继发于感染、代谢性疾病等原因。国内关于BMD导致扩张性心肌病的研究尚局限于个别病例报道。蒋伟等[8]报道了1例BMD青年男性患者因反复胸闷、气促入院,诊断合并扩张性心肌病,给予强心、利尿、扩血管、逆转心室重构等综合治疗后,病情缓解出院。尽管心肌损伤进展缓慢,但BMD患者仍有发生心功能障碍的风险。扩张性心肌病甚至是某些BMD携带者的唯一临床表现,而进行基因检测是识别BMD引起的心肌病的有效方法[9]。该患者起病20余年后出现胸闷症状,其外甥经肌营养不良症基因检测显示存在3号外显子区域重复突变,且患者心肌病变前无明确病毒感染等诱因,故支持BMD在患者发生扩张性心肌病中占主导地位。
患者病情复杂,检查发现其同时合并血钙、磷减低,维生素D水平减低、PTH升高、脾梗死、肾梗死等诸多问题。维生素D的主要来源是阳光,少量通过食物摄取。维生素D的合成取决于暴露皮肤的面积和时间、皮肤类型、地理纬度和云量等因素。维生素D对骨骼健康和细胞生长有着重要的作用。活性维生素D的基本作用是帮助肠道吸收钙和磷,维持机体钙磷平衡及甲状旁腺激素水平。钙的吸收在有维生素D的情况下增加30%~80%。低钙血症是诱发心力衰竭恶化的有害因素,钙离子在心肌的兴奋和收缩中起着至关重要的作用,低钙血症患者的心肌收缩力可能下降。维生素D缺乏症和低钙血症可导致佝偻病、骨软化症、扩张性心肌病、肌病等。Glackin等[10]报道了3例爱尔兰扩张性心肌病婴儿,均继发于严重的维生素D缺乏和低钙血症,补充治疗后心功能随之改善。在Yilmaz等[11]研究中也同样指出,如及时诊治,与佝偻病相关的扩张性心肌病和心力衰竭效果良好。Priya等[12]研究发现扩张性心肌病患者维生素D缺乏与心功能显著相关,建议对扩张性心肌病患者进行维生素D的筛查并及时治疗。维生素D缺乏和不足在DMD患儿中普遍存在,Alshaikh等[13]认为1000~1500 IU/d是优化DMD中维生素D的最佳剂量。该患者存在维生素D缺乏和低钙血症。分析患者低钙血症原因,PTH增高,血磷偏低,既往无特殊用药史,无肿瘤、肾脏病史,首查25-羟维生素D 4.2 ng/ml;患者成年起病,因活动不便,日照时间极少,且平素钙质食物摄入不足,故考虑患者低钙血症为维生素D缺乏。住院期间给予补充活性维生素D及钙剂,患者血钙、血磷恢复正常,PTH下降,自诉下肢乏力稍有缓解,支持维生素D缺乏所致继发性甲状腺旁腺功能亢进症。维生素D缺乏和低钙血症在扩张性心肌病中均发挥着潜在作用[10,14-16]。患者维生素D缺乏严重,予增加活性维生素D补充剂量。结合患者病例特点,其扩张性心肌病可能存在BMD和维生素D缺乏双重病因,但不能完全确定哪个是更重要的病因,也许两者均起了主要作用。目前有关BMD所致的扩张性心肌病尚无有效治疗措施,Angelini等[17]建议尽早使用ACE抑制剂治疗心肌病,在严重的情况下,建议进行心脏移植;对于该患者,继续补充维生素D至正常水平,观察其心功能及心脏结构的变化,也许可进一步明确维生素D缺乏在其中起到的作用,更好地指导下一步治疗。该患者另存在脾梗死及肾梗死情况,结合会诊意见给予对症抗凝治疗,随访观察变化。检索国内外文献,并未发现脏器梗死与肌营养不良症、扩张性心肌病、维生素D缺乏、低钙血症之间关系的报道,有待进一步观察、探讨。
综上所述,通过本研究报道,可见临床工作中各疾病间存在相互关联、制约的关系,及时发现与诊治,可能有利于患者疾病的恢复。目前虽然人们生活质量不断提高,仍存在维生素D缺乏的严重现象,关注维生素D水平是全民不可忽视的公共健康问题,而临床医师更应提高警惕。
[参考文献]
[1] 中华医学会神经病学分会,中华医学会神经病学分会神经肌肉病学组,中华医学会神经病学分会肌电图与临床神经生理学组.中国假肥大型肌营养不良症诊治指南[J].中华神经科杂志,2016,49(1):17-20.
[2] Kong X,Zhong X,Liu L,et al. Genetic analysis of 1051 Chinese families with duchenne/becker muscular dystrophy[J].BMC Med Genet,2019,20(1):139.
[3] 张成.《中国假肥大型肌营养不良症诊治指南》解读[J]. 中国现代神经疾病杂志,2018, 18(7):475-479.
[4] Feingold B,Mahle WT,Auerbach S,et al. Management of cardiac involvement associated with neuromuscular diseases:A scientific statement from the American Heart Association[J]. Circulation,2017,136(13):200-231.
[5] Yilmaz A,Gdynia H-J,Baccouche H,et al. Cardiac invo lvement in patients with becker muscular dystrophy:New diagnostic and pathophysiological insights by a CMR approach[J].J Cardiovasc Magn Reson,2008,10:50.
[6] Panovsk?伥 R,PelM,Holeek T,et al. Cardiac profile of the czech population of duchenne muscular dystrophy patients:A cardiovascular magnetic resonance study with T1 mapping[J]. Orphanet J Rare Dis,2019,14(1):10.
[7] Papa AA,D’Ambrosio P,Petillo R,et al. Heart trans plantation in patients with dystrophinopathic cardiomy opathy:Review of the literature and personal series[J]. Intractable Rare Dis Res,2017,6(2):95-101.
[8] 蒋伟,羊镇宇.Becker型肌营养不良症导致扩张型心肌病一例[J]. 中华心血管病杂志,2019,47(7):570-571.
[9] Komoriyama H,Fukushima A,Takahashi Y,et al. Rapidly progressive heart failure in a female carrier of becker muscular dystrophy with no skeletal muscle symptoms[J]. Intern Med,2019,58(17):2545-2549.
[10] Glackin S,Mayne P,Kenny D,et al. Dilated cardiomyo pathy secondary to vitamin D deficiency and hypocalca emia in the Irish paediatric population. A case report[J].Ir Med J, 2017,110(3):535.
[11] Yilmaz O,Olgun H,Ciftel M, et al. Dilated cardiomyo pathy secondary to rickets-related hypocalcaemia:Eight case reports and a review of the literature[J].Cardiol Young,2015,25(2):261-266.
[12] Priya S,Siddiqi Z,Karoli R,et al. Study of vitamin D status in patients with dilated cardiomyopathy at a teaching hospital in North India[J].J Cardiovasc Echaogr,2016,26(3):89-93.
[13] Alshaikh N,Brunklaus A,Davis T,et al. Vitamin D in corticosteroid-na ve and corticosteroid-treated Duchenne muscular dystrophy:What doseachieves optimal 25(OH) vitamin D levels[J].Arch Dis Child,2016,101(10):957-961.
[14] Polat V,Bozcali E,Uygun T,et al. Low vitamin D status associated with dilated cardiomyopathy[J]. Int J Clin Exp Med,2015,8(1):1356-1362.
[15] 王方芳,余飞,张媛,等. 低钙血症致可逆性扩张性心肌病一例[J]. 中华医学杂志,2011,91(20):1439.
[16] 张亚男,张会丰.维生素D钙和扩张性心肌病与猝死[J]. 中国实用儿科杂志,2019,34(7):565-568.
[17] Angelini C,Marozzo R,Pegoraro V. Current and emerging therapies in Becker muscular dystrophy(BMD)[J].Acta Myol,2019,38(3):172-179.
(收稿日期:2021-09-24)



