钟岳,屈士斌,杨西胜,汪建林,李霄,郝晓坤,李海民#
1空军军医大学西京医院肝胆胰脾外科,西安 710032
2陕西省第二人民医院肝胆外科,西安 710005
胰腺癌是一种侵袭力强、早期诊断困难、病情进展迅速、患者生存率极低的消化道恶性肿瘤,虽然大多数肿瘤患者的生存情况明显改善,但对胰腺癌患者而言,其生存的改善情况不佳[1]。长链非编码RNA(long chain non-coding RNA,lncRNA)是一类长度超过200 nt,不编码蛋白质的内源性RNA[2]。研究表明,lncRNA在X染色体沉默、原癌基因激活、转录干扰、基因组印迹等方面起着重要的调节作用,参与各种疾病的进展[3-6]。许多lncRNA已经被证明在多种肿瘤中异常表达,可能参与肿瘤的发生、发展[7-9],如HOX转录反义RNA(HOX transcript antisense RNA,HOTAIR)、浆细胞瘤转化迁移基因 1(plasmacytoma variant translocation gene 1,PVT1)、肺腺癌转移相关性转录因子1(metastasis associated lung adenocarcinoma transcript 1,MALAT1)等在胰腺癌中异常表达,并参与胰腺癌的恶性进展[10-14]。M IR31HG是位于9p21.3的lncRNA,长度为2166 bp,已被发现在乳腺癌、肺腺癌组织中高表达,并且能够促进肿瘤细胞的增殖[15-16]。但M IR31HG在胰腺癌组织中的表达情况与患者临床特征的关系,以及M IR31HG表达对胰腺癌细胞耐药性的影响尚未见研究。因此,本研究对lncRNA M IR31HG在胰腺癌组织中的表达情况及与患者临床特征之间的关系进行了探讨,并分析了M IR31HG表达对胰腺癌细胞耐药性的影响,现报道如下。
1 材料与方法
1.1 材料
人胰腺癌细胞系 SW 1990、Capan-1、Capan-2、PANC-1、AsPC-1均购自中国医学科学院上海细胞库,正常的人类胰腺导管上皮细胞HPDE6c-7购自美国模式培养物集存库(American type culture collection,ATCC)。以上所有细胞系由空军军医大学西京医院肝胆胰脾外科实验室保存。80例胰腺癌组织及其癌旁正常组织标本由空军军医大学西京医院肝胆胰脾外科实验室提供,实时荧光定量逆转录-聚合酶链反应(quantitative real-time reverse transcription-polymerase chain reaction,qRT-PCR)仪购自美国Bio-Rad公司,总RNA提取试剂(Trizol)、LipofectamineTM2000均购自美国Invitrogen公司,反转录试剂盒购自日本Takara公司,Smart SpecTMPlus分光光度计购自美国Biotek公司,DMEM高糖培养基购自美国Hyclone公司,CCK-8检测试剂盒购自碧云天生物技术研究所,胎牛血清购自以色列BI公司。
1.2 实验方法
1.2.1 细胞培养 将人胰腺癌细胞系SW 1990、Capan-1、Capan-2、PANC-1、AsPC-1和正常的人类胰腺导管上皮细胞HPDE6c-7均放入含10%胎牛血清的DMEM高糖培养基中,置于37℃、5%CO2饱和湿度培养箱中进行培养,后储存于-130℃冰箱中保存待用。
1.2.2 qRT-PCR法检测MIR31HG的表达水平严格按照Trizol试剂说明书的步骤提取全部组织和细胞的总RNA,采用Smart SpecTMPlus分光光度计检测RNA的浓度和纯度,参照反转录试剂盒说明书将纯化的RNA反转录合成cDNA;以β-actin为内参,以cDNA作为模板进行qRT-PCR检测(表1)。qRT-PCR的反应条件:95℃预变性10 min;95 ℃ 变性10 s,59 ℃扩增 30 s,72 ℃延伸30 s,共40个循环。应用2-△△Ct法进行相对定量分析,计算M IR31HG的表达水平。实验重复3次。

表1 qRT-PCR引物序列
1.2.3 细胞转染及分组 选择增殖速度较快的AsPC-1、PANC-1、Capan-2细胞进行实验,取对数生长期的AsPC-1、PANC-1、Capan-2细胞接种于6孔板,待达到70%~90%的融合度时进行细胞转染,细胞转染严格按照LipofectamineTM2000说明书的步骤进行操作。将转染SiM IR31HG的AsPC-1、PANC-1、Capan-2细胞分别作为SiA组、SiB组、SiC组,将转染空载体的AsPC-1、PANC-1、Capan-2细胞分别作为NC1组、NC2组、NC3组(表2)。转染48 h后,采用Trizol提取细胞总RNA,通过qRT-PCR法检测转染后细胞中M IR31HG的表达情况,以验证转染效果,然后再次转染细胞用于后续实验。

表2 SiM IR31HG和空载体序列
1.2.4 CCK-8法检测细胞增殖能力 取转染48 h后的各组细胞,以2000/孔接种于96孔板中。设置5个重复孔,于固定时间吸净培养基,于待测的每孔细胞中加入l0μl CCK-8溶液的新鲜培养基100μl,孵箱中孵育2 h,在酶标仪450 nm处测量各孔细胞的光密度(optical density,OD)值。连续重复同样的步骤检测5天,然后根据测得的数据绘制各组细胞的生长曲线,观察各组细胞的增殖能力。实验重复3次,取平均值。
1.2.5 Transwell小室检测细胞迁移能力 取转染48 h后的各组细胞进行Transwell实验。采用无血清的DMEM培养液重悬细胞,调整细胞密度为4×105/ml。上室中加入200μl细胞悬液(无血清培养液),下室加入500μl含10%胎牛血清的完全培养液,每组设置3个重复孔。细胞继续培养24~48 h后,取出小室,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次,以95%乙醇固定细胞10 min,结晶紫染色30 min,PBS洗涤3次,擦除小室内部细胞,在光学显微镜下随机选取5个高倍视野(×200)进行穿膜细胞数目的计数。实验重复3次,取平均值。
1.2.6 体外药物敏感性实验 检测各组细胞5-氟尿嘧啶(5-FU)的半数抑制浓度(half inhibition concentration,IC50)的变化,取转染48 h后的各组(SiA组、SiB组、NC1组、NC2组)细胞,以6×103/孔细胞接种于96孔板中,每孔细胞加入100μl培养液。常规培养细胞贴壁后,移除孔内原培养液,加入100μl含不同浓度梯度的5-FU培养液,每个药物浓度设置5个重复孔。常规培养48 h后,每孔细胞加入10μl CCK-8溶液,继续培养2 h,于酶联免疫检测仪上测定450 nm波长处各孔的OD值,取5个重复孔的平均OD值计算细胞的增殖抑制率。采用GraphPad软件计算细胞的IC50。
检测同一浓度5-FU处理后72小时各组(SiA组、SiB组、NC1组、NC2组)细胞的存活率。转染24 h后,采用胰蛋白酶消化细胞,以培养液重悬,以6×103/孔细胞接种于96孔板中,每孔加入100μl培养液。常规培养细胞贴壁后,移除孔内原培养液,分别使用浓度为200、5000μg/ml的5-FU处理PANC-1和AsPC-1细胞,设置5个重复孔。设置多个时间点,每个孔加入10μl CCK-8溶液,继续培养2 h后终止培养。在酶联免疫检测仪上测定450 nm波长处各孔的OD值,同样取5个重复孔的平均OD值计算细胞的增殖抑制率。通过GraphPad软件比较各组细胞的增殖抑制率。实验重复3次,取平均值。
1.3 统计学分析
采用SPSS 16.0软件和GraphPad软件对-数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和率(%)表示,组间比较采用χ2检验或Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 MIR31HG的表达水平比较
qRT-PCR检测结果显示,胰腺癌组织中M IR31HG的表达水平为(0.81±0.09),明显高于癌旁正常组织的(0.12±0.02),差异有统计学意义(P<0.01)。 AsPC-1、PANC-1、Capan-1、Capan-2、SW 1990胰腺癌细胞中M IR31HG的表达水平分别为(1.75±0.06)、(2.37±0.17)、(3.85±0.59)、(2.44±0.07)、(10.21±1.23),均高于正常的人类胰腺导管上皮细胞HPDE6c-7的(1.00±0.13),差异均有统计学意义(t=5.247、6.444、4.741、9.885、7.432,P<0.05)。
2.2 MIR31HG表达与胰腺癌患者临床特征的关系
根据M IR31HG在80例胰腺癌组织和癌旁正常组织中的表达水平,以同组癌旁组织中M IR31HG的表达水平为标准进行划分,将高于此标准的作为高表达组(n=66),将低于此标准的作为低表达组(n=14)。结果显示,不同性别、年龄胰腺癌患者胰腺癌组织中M IR31HG的表达水平比较,差异均无统计学意义(P>0.05);肿瘤直径>3 cm、有远处转移、临床分期为Ⅲ~Ⅳ期、分化程度为低分化、CA19-9表达水平高的胰腺癌患者胰腺癌组织中M IR31HG的表达水平均高于肿瘤直径≤3 cm、无远处转移、临床分期为Ⅰ~Ⅱ期、分化程度为高分化、CA19-9表达水平低的胰腺癌患者,差异均有统计学意义(P<0.05)(表3)。
2.3 下调MIR31HG表达对胰腺癌细胞AsPC-1、PANC-1功能的影响
2.3.1 SiMIR31HG敲低效率验证 qRT-PCR检测结果显示,SiA组和SiB组细胞中M IR31HG的表达水平分别为(0.13±0.02)、(0.26±0.06),分别明显低于 NC1组和 NC2组细胞的(0.80±0.03)、(1.00±0.06),差异均有统计学意义(t=18.22、9.07,P<0.01)。

表3 不同临床特征胰腺癌患者胰腺癌组织中M IR31HG的表达情况比较
2.3.2 下调MIR31HG表达对胰腺癌细胞增殖能力的影响 CCK-8实验结果显示,第4、5天,SiA组和SiB组细胞的OD值分别明显低于NC1组和NC2组,差异均有统计学意义(P<0.01)。(图1)

图1 下调M IR31HG表达后PANC-1、AsPC-1细胞的增殖情况
2.3.3 下调MIR31HG表达对胰腺癌细胞迁移能力的影响 先期采用Transwell实验检测胰腺癌细胞的迁移能力,转染了AsPC-1细胞并证实其转染后M IR31HG的表达明显下调,后再进行Transwell实验,结果发现,SiA组和NC1组均未出现明显的迁移,遂将SiA组的AsPC-1细胞调整为易于迁移的Capan-2细胞。结果显示,SiB组和SiC组细胞的穿膜细胞数目分别为(13.33±0.88)、(28.33±1.20),均明显少于NC2组和NC3组的(70.33±3.18)、(57.33±1.45),差异均有统计学意义(t=17.270、15.380,P<0.01)。(图2)
2.4 下调MIR31HG表达对胰腺癌细胞IC50的影响
SiA组和SiB组细胞的IC50分别为1057、168.6 μg/ml,分别低于 NC1组和 NC2组的5030、234.3 μg/ml,差异均有 统计学意义(χ2=7.811、3.024,P<0.05)。(图3)
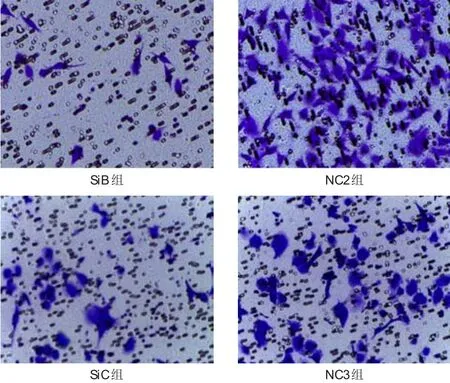
图2 下调M IR31HG表达后PANC-1、Capan-2细胞的迁移情况(结晶紫染色,×200)
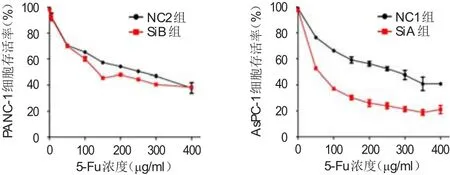
图3 下调M IR31HG表达后PANC-1、AsPC-1细胞的5-Fu IC50
2.5 下调MIR31HG表达对胰腺癌细胞存活率的影响
在同一浓度5-Fu处理下,在0~72小时内,SiB组和SiA组细胞的存活率分别低于NC2组和NC1组,差异均有统计学意义(χ2=3.175、3.903,P<0.05)。(图4)

图4 下调M IR31HG表达后同一浓度5-Fu处理下PANC-1、AsPC-1细胞的存活情况
3 讨论
胰腺癌的发病原因尚不清楚,它的发生发展是一个极其复杂的过程。近年来,相关研究表明,LncRNA在多种疾病的发生发展过程中发挥着重要的调控作用,如X染色体沉默、基因组印迹、染色质修饰、转录激活、转录干扰、核转运等。LncRNA也参与着细胞分化和发育的多层次调控,与疾病的发生密切相关。有学者指出lncRNA在肿瘤基因表达过程中的调节功能明显,能于不同层次完成对基因表达的调节,对细胞的发育、生长产生干扰,从而完成对肿瘤细胞形成、变化、转移的参与[17-18]。
研究表明,LncRNA不但在肿瘤等疾病中发挥着重要的作用,某些药物的作用机制也是通过LncRNA实现的,这就为药物的研究和开发提供了新的思路。在喉鳞状细胞癌中,顺铂和紫杉醇可以使LncRNA CDKN2B-AS1、HOTAIR和MALAT1的水平降低,并达到抑制肿瘤生长的效果[19]。在食管鳞状细胞癌中,β-榄香烯可以通过促进LncRNA CDKN2B-AS1的转录来抑制hTERT酶的表达,从而抑制肿瘤细胞的增殖[20]。在前列腺癌中,染料黄木酮通过下调原癌基因HOTAIR的表达,抑制前列腺癌细胞的生长[21]。在乳腺癌中,17β-雌二醇通过降低MALAT-1的表达水平抑制乳腺癌细胞的增殖、侵袭和迁移[22]。
本研究收集空军军医大学西京医院80例经冰冻切片和HE染色明确诊断为胰腺癌的经手术切除的胰腺癌组织及其癌旁正常组织,采用qRT-PCR检测M IR31HG的表达水平,发现M IR31HG在胰腺癌组织中的表达水平较高。然后,在正常的人类胰腺导管上皮细胞HPDE6c-7及胰腺癌细胞SW 1990、Capan-1、Capan-2、PANC-1、AsPC-1中应用qRT-PCR进行验证,发现与正常的人类胰腺导管上皮细胞HPDE6c-7中M IR31HG的表达水平相比,SW 1990、AsPC-1、Capan-1、Capan-2、PANC-1胰腺癌细胞中M IR31HG的表达水平均较高。Augoff等[23]认为miRNA-31和M IR31HG沉默是由CpG岛甲基化引起的,且认为转录的沉默可能是M IR31HG在癌旁正常组织、正常胰腺导管上皮细胞HPDE6c-7内低表达的部分原因。
由于大量的PCR结果证实M IR31HG在胰腺癌组织中异常表达,因此,有必要对M IR31HG的表达水平和胰腺癌患者临床特征的关系进行分析。本研究结果显示,临床分期为Ⅲ~Ⅳ期的胰腺癌患者胰腺癌组织中M IR31HG的表达水平高于临床分期为Ⅰ~Ⅱ期的胰腺癌患者,而临床分期与胰腺癌患者的生存时间又有直接的关系,这就提示M IR31HG的表达可能与胰腺癌患者的预后有关。本研究亦发现,肿瘤直径>3 cm、有远处转移、分化程度为低分化、CA19-9表达水平高的胰腺癌患者胰腺癌组织中M IR31HG的表达水平均高于肿瘤直径≤3 cm、无远处转移、分化程度为高分化、CA19-9水平低的胰腺癌患者(P<0.05),提示M IR31HG与胰腺癌的发生、发展有关,可作为胰腺癌患者筛查的潜在客观指标。以上研究表明,M IR31HG在胰腺癌的发生、发展中可能发挥着重要的调控作用。
细胞发育与增殖调控机制的失常是恶性肿瘤发生的主要原因,因此,检测细胞的增殖活性可以对肿瘤细胞的恶性特征进行有效的评价。CCK-8实验结果发现,PANC-1、AsPC-1细胞的增殖会因M IR31HG表达的下调而受到明显的抑制,下调M IR31HG表达后,第4、5天,AsPC-1和PANC-1细胞的增殖能力均被抑制。Transwell实验结果表明,SiB组和SiC组细胞的穿膜细胞数目明显少于NC2组和NC3组(P<0.01),表明胰腺癌细胞的迁移能力会因M IR31HG表达的下调而下降,说明M IR31HG在胰腺癌的转移过程中发挥了重要的作用。
本研究发现,下调M IR31HG的表达可引起AsPC-1、PANC-1细胞的IC50下调;另外,在同一浓度5-FU处理下,检测未下调M IR31HG表达的胰腺癌细胞和下调M IR31HG表达的胰腺癌细胞的存活情况发现,下调M IR31HG表达的胰腺癌细胞的存活率下降,表明下调M IR31HG的表达可以明显地增强胰腺癌细胞对5-Fu的敏感性,降低其耐药性,此过程中的细节机制目前尚未明确,有待进一步研究。
综上所述,本研究发现M IR31HG在胰腺癌组织中的表达水平明显高于癌旁正常组织,而且M IR31HG的高表达可能与胰腺癌患者较高的临床分期、有远处转移、分化程度低和CA19-9水平高有关。下调M IR31HG的表达可使胰腺癌细胞的增殖、迁移能力减弱,胰腺癌细胞5-Fu的IC50明显下降,并可明显增强胰腺癌细胞对5-Fu的敏感性,降低其耐药性。因此,M IR31HG可能成为胰腺癌新的潜在的干预靶点及化疗药物耐药的重要分子靶标。



