刘源,倪渐凤,李芳芳,尹先哲#
1南阳市第二人民医院肿瘤科,河南 南阳 473012
2南阳市第一人民医院肿瘤科,河南 南阳 473012
原发性肝细胞癌(简称肝癌)是常见恶性肿瘤,主要来源于肝细胞和肝内胆管上皮细胞,其中肝细胞肝癌占比超过90%[1-2]。原发性肝细胞癌恶性程度较高,由于肝细胞具有较强的代偿功能,因此,80%的患者确诊时已经处于中晚期,全球每年超过60万人死于肝癌,其中50%发生在中国,严重威胁中国居民的生命健康[3]。目前,手术切除是原发性肝细胞癌的首选治疗方法,但超过60%的原发性肝细胞癌患者术后出现了复发和转移,5年生存率不超过5%,因此,原发性肝细胞癌术后复发和转移成为肝癌治疗难点[4]。研究原发性肝细胞癌复发和转移的分子机制,寻找有针对性的治疗靶点,是目前肝癌防治的研究方向。靶向诱导肝癌细胞凋亡是一种比较理想的治疗方案,具有特异性强、效果好、不良反应少等特点,对肝癌的治疗具有很好的推广前景。
通过Oncomine数据库整合原发性肝细胞癌组织表达谱分析发现,胰岛素样生长因子2 mRNA结合蛋白1(insulin like growth factor 2 mRNA binding protein 1,IGF2BP1)在原发性肝细胞癌中的表达明显上调,表明IGF2BP1可能在原发性肝细胞癌发生发展中起关键作用[5-6]。抑制IGF2BP1的表达,可能抑制原发性肝细胞癌细胞的增殖和转移能力,为原发性肝细胞癌的治疗提供了方向。研究表明,微小RNA(microRNA,miRNA)可以从多个层面调控基因的转录和表达情况,参与机体各种生理生化的调控,与多种疾病的发生发展密切相关[7]。本研究探讨miRNA-196b靶向抑制IGF2BP1的表达对肝癌HepG2细胞增殖和凋亡的影响及可能机制,现报道如下。
1 材料与方法
1.1 细胞、主要试剂和仪器
肝癌HepG2细胞购自中国科学院典型培养物保藏委员会细胞库,miRNA-196b模拟物(mimics)和阴性对照均购自上海吉玛生物科技有限公司,DMEM培养基、胎牛血清均购自美国GIBCO公司,噻唑蓝(methylthiazolyldiphenyl tetrazolium,MTT)购自美国Amresco公司,膜联蛋白V(AnnexinⅤ)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒购自北京索莱宝科技有限公司,Trizol提取试剂盒购自美国Invitrogen公司,反转录试剂盒购自大连TaKaRa公司,实时荧光定量逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒购自宝成生物工程(大连)有限公司,细胞蛋白抽提试剂购自上海生工生物工程技术服务有限公司,鼠抗人IGF2BP1、鼠抗人caspase 3抗体均购自美国Santa Cruz公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的亲和纯化山羊抗小鼠免疫球蛋白G(immunoglobulin G,IgG)二抗、鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体均购自武汉艾美捷科技有限公司,NanoDrop 2000c型蛋白核酸检测仪购自美国Thermo公司,实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪、流式细胞仪均购自美国Bio-Rad公司,BIO-RAD垂直电泳仪购自美国BD公司,凝胶成像仪购自美国UVP公司。
1.2 实验方法
1.2.1 细胞培养及转染方法采用含胎牛血清的DMEM培养液培养肝癌HepG2细胞,37℃、5%CO2培养,隔天换液,取对数生长期细胞进行实验。将miRNA-196b mimics和阴性对照转染至肝癌HepG2细胞,分别作为mimics-196b组和阴性对照组,未处理的细胞作为空白对照组,培养48 h收集细胞,进行相关检测。
1.2.2 RT-PCR法检测miRNA-196b和IGF2BP1 mRNA的相对表达量取3组细胞胰蛋白酶消化后,根据RNA提取试剂盒操作说明书提取总RNA,测定mRNA浓度和纯度,根据反转录试剂盒说明合成互补DNA(complementary DNA,cDNA),根据荧光定量RT-PCR试剂盒说明进行扩增。反应条件:95℃预变性30 s、95℃变性5 s、60℃退火44 s共40个循环,以GAPDH作为内参,采用2-△△Ct法计算miRNA-196b和IGF2BP1mRNA的相对表达量。miRNA-196b上游引物为5'-GCAGCACGCTAGGTAGTTTCC-3',下游引物为5'-TATCGTTGTTCTCCACTCCTTGAC-3';IGF2BP1上游引物为5'-CCTGCTGGCTCAGTATGGT-3',下游引物为5'-GACATTCACCACTGCCGTCTC-3';GAPDH上 游引物为5'-TCCCATCACCATCTTCCAG-3',下游引物为5'-GGTATCCATCGCCATGCTC-3'。
1.2.3 蛋白质印迹法(Western blot)检测IGF2BP1和caspase3蛋白的相对表达量取3组细胞胰蛋白酶消化后,采用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次,加入蛋白抽提试剂冰浴2 h;离心后提取上清液,BCA法对蛋白浓度进行检测,调整蛋白浓度。每组加入1/5体积的5×结合缓冲液(binding buffer)进行变性,-80℃保存备用。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白,将凝胶蛋白低温下转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。加入一抗[鼠抗人IGF2BP1抗体(稀释浓度为1∶1000)、鼠抗人 caspase 3 抗体(稀释浓度为 1∶1500)],4℃孵育过夜,加入HRP标记的二抗(稀释浓度为1∶1500)4℃孵育2 h,进行显色,用凝胶成像系统采集图像,以GAPDH作为内参,以目的条带与内参条带灰度值比值表示IGF2BP1和caspase 3蛋白的相对表达量。
1.2.4 MTT 法检测细胞增殖能力取3组细胞胰蛋白酶消化后,以5×103/孔的浓度接种于96孔板,每孔 200 μl,待细胞融合后每孔加入 50 μl的 MTT溶液,继续培养4 h,弃掉上清液,每孔加入200 μl的二甲基亚砜(dimethyl sulfoxide,DMSO),振荡摇匀,测定光密度(optical density,OD)值,计算细胞增殖率,细胞增殖率=(mimics-196b组OD值-阴性对照组OD值)(/空白对照组OD值-阴性对照组OD值)。
1.2.5 流式细胞仪检测细胞凋亡情况取3组细胞胰蛋白酶消化后,转移至离心管内,离心弃上清,采用1×binding buffer调整细胞浓度为1×106/ml,根据细胞凋亡AnnexinⅤ-FITC/PI检测试剂盒说明书步骤,采用流式细胞仪检测细胞凋亡情况。
1.3 统计学方法
采用SPSS 19.0软件对所有数据进行统计学分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,多组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-196b和IGF2BP1mRNA相对表达量比较
3组细胞miRNA-196b和IGF2BP1mRNA相对表达量比较,差异均有统计学意义(P<0.01)。mimics-196b组细胞miRNA-196b相对表达量均高于阴性对照组细胞和空白对照组细胞,IGF2BP1mRNA相对表达量均低于阴性对照组和空白对照组细胞,差异均有统计学意义(P<0.05)。空白对照组和阴性对照组细胞miRNA-196b和IGF2BP1mRNA相对表达量比较,差异均无统计学意义(P>0.05)。(表1)
表1 3组细胞miRNA-196b和IGF2BP1 mRNA相对表达量比较(±s)
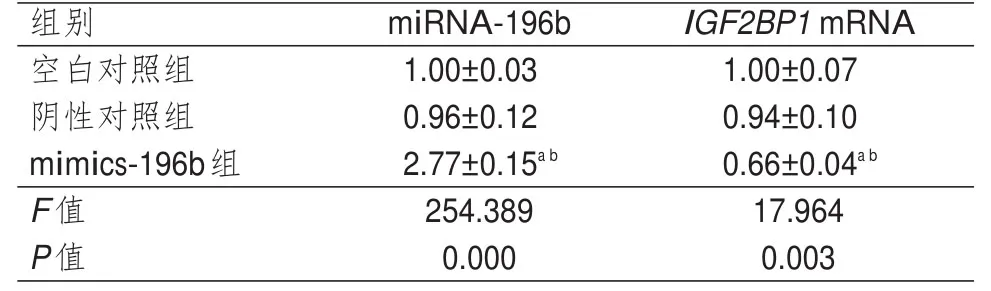
表1 3组细胞miRNA-196b和IGF2BP1 mRNA相对表达量比较(±s)
注:a与阴性对照组比较,P<0.05;b与空白对照组比较,P<0.05
组别miRNA-196bIGF2BP1 mRNA空白对照组1.00±0.031.00±0.07阴性对照组0.96±0.120.94±0.10 mimics-196b组2.77±0.15a b0.66±0.04a b F值254.38917.964 P值0.0000.003
2.2 IGF2BP1和caspase3蛋白相对表达量比较
3组细胞IGF2BP1和caspase 3蛋白相对表达量比较,差异均有统计学意义(P<0.01)。mimics-196b组细胞IGF2BP1蛋白的相对表达量均低于阴性对照组和空白对照组细胞,caspase 3蛋白相对表达量均高于阴性对照组和空白对照组细胞,差异均有统计学意义(P<0.05)。空白对照组和阴性对照组细胞IGF2BP1和caspase 3蛋白的相对表达量比较,差异均无统计学意义(P>0.05)。(表2)
2.3 细胞增殖和凋亡情况比较
3组细胞OD值和细胞凋亡率比较,差异均有统计学意义(P<0.05)。mimics-196b组细胞OD值均低于阴性对照组和空白对照组细胞,细胞凋亡率均高于阴性对照组和空白对照组细胞,差异均有统计学意义(P<0.05),但空白对照组和阴性对照组细胞OD值和凋亡率比较,差异均无统计学意义(P>0.05)。(表3)
表2 3组细胞IGF2BP1和caspase 3蛋白相对表达量比较(±s)
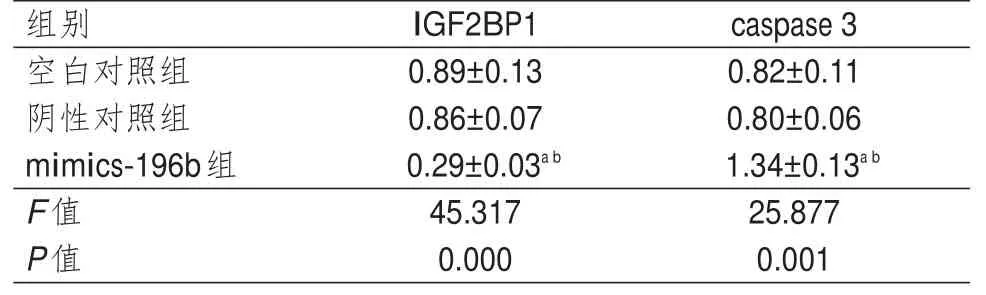
表2 3组细胞IGF2BP1和caspase 3蛋白相对表达量比较(±s)
注:a与阴性对照组比较,P<0.05;b与空白对照组比较,P<0.05
组别空白对照组阴性对照组mimics-196b组F值P值IGF2BP1 0.89±0.13 0.86±0.07 0.29±0.03a b 45.317 0.000 caspase 3 0.82±0.11 0.80±0.06 1.34±0.13a b 25.877 0.001
表3 3组细胞增殖和凋亡情况的比较(±s)
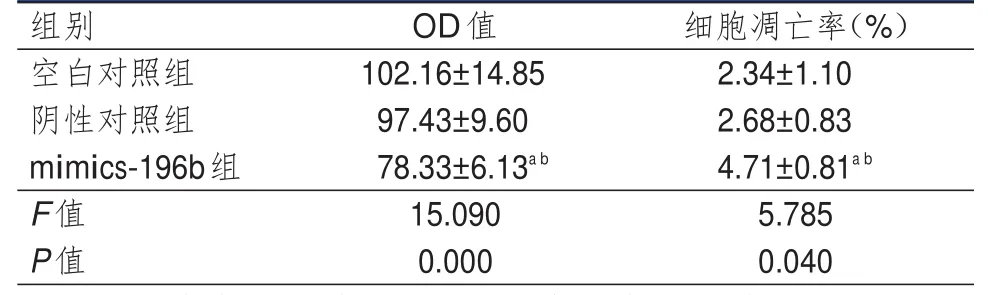
表3 3组细胞增殖和凋亡情况的比较(±s)
注:a与阴性对照组比较,P<0.05;b与空白对照组比较,P<0.05
OD值102.16±14.85 97.43±9.60 78.33±6.13a b 15.090 0.000细胞凋亡率(%)2.34±1.10 2.68±0.83 4.71±0.81a b 5.785 0.040组别空白对照组阴性对照组mimics-196b组F值P值
3 讨论
术后复发和转移是导致肝癌患者预后差、生存时间短的主要原因[8],研究显示,多种因素可导致肝癌的复发和转移[9]。miRNA广泛存在于真核细胞内,长度为22~23个核苷酸,具有高度保守性,参与细胞增殖、分化和凋亡过程,在恶性肿瘤的发生发展中发挥重要作用[10]。miRNA仅占基因总量的1%~3%,却可对超过30%的基因表达进行调控,约50%的肿瘤组织内可检测到miRNA的表达,且结果具有可重复性,表明miRNA可能与肿瘤发生发展密切相关[11-12]。不同肿瘤的miRNA在肿瘤组织中的表达情况不同,如肿瘤组织中miRNA-10b和miRNA-21等的表达上调,而miRNA-518b、miRNA-17p和miRNA-205等的表达下调,且miRNA的表达具有组织特异性,可以据此追踪肿瘤的起源[13]。通过miRNA靶向调控mRNA表达水平,是一种新型分子靶向治疗方法。miRNA与mRNA的结合具有互补的特点,但也不是完全互补匹配。通过相关软件预测miRNA与mRNA是否结合,可以寻找抗肿瘤治疗的特异性靶点,多种预测价值较高的软件同时进行预测和分析,结果较为可靠。miRNA-196b位于第7号常染色体,在乳腺癌、淋巴瘤、白血病等肿瘤组织中低表达,其表达情况与肿瘤患者的预后密切相关[14-15]。本研究结果显示,miRNA-196b mimics转染后,肝癌HepG2细胞中miRNA-196b的相对表达量升高。
研究显示,IGF2BP1与miRNA-196b结合的稳定性最高,特异度和保守性也较好。IGF2BP1是胰岛素样生长因子RNA结合蛋白家族中的重要成员,胰岛素样生长因子2 mRNA结合蛋白(insulin like growth factor 2 mRNA binding protein,IGF2BP)可以高度特异性地与miRNA结合,并参与细胞的增殖、分化、代谢等过程[16]。IGF2BP主要表达于肿瘤组织,在正常组织中低表达甚至不表达。研究显示,IGF2BP1在肝癌、胃癌等组织中的表达水平较高,但具体的机制尚不清楚[17]。因IGF2BP1在正常组织中基本不表达,而在多种肿瘤和(或)肿瘤来源细胞中表达上调,可以将IGF2BP1确定为“癌胚”。研究显示,通过miRNA抑制IGF2BP1的表达后,肿瘤细胞的增殖能力受到抑制,而凋亡率增加[18]。因此,IGF2BP1可能作为诊断恶性肿瘤的特异性生物标志物。caspase家族是细胞凋亡的执行者,caspase 2、caspase 9等凋亡启动因子激活时,可导致caspase级联反应,激活下游caspase 3、caspase 6、caspase 7等凋亡执行因子,一旦激活caspase 3,细胞凋亡将进入不可逆阶段[19]。本研究发现,mimics-196b组细胞IGF2BP1mRNA和IGF2BP1蛋白的相对表达量均降低,caspase 3蛋白的相对表达量均增加,OD值降低且细胞凋亡率升高,表明miRNA-196b可能通过靶向抑制IGF2BP1的表达,抑制肝癌HepG2细胞的增殖并促进其凋亡。
综上所述,通过转染miRNA-196b mimics可以提高miRNA-196b的相对表达量,抑制IGF2BP1的表达,抑制肝癌HepG2细胞的增殖并促进其凋亡,其可能机制与miRNA-196b靶向调控IGF2BP1有关,为肝癌的靶向治疗提供一定的理论依据。



