汪文利,许慧,蒋树林
1开封市人民医院耳鼻喉科,河南 开封475002
2解放军73101部队内科,江苏 徐州221008
微管在细胞中具有支架、物质运输及识别肿瘤 等生物学功能[1]。微管解聚蛋白stathmin为微管不稳定调节蛋白家族成员之一,具有促进微管解聚的作用,主要分布在细胞骨架、细胞质和细胞核中。stathmin通过调节微管的稳定性,参与细胞的周期调控、分化、运动及凋亡等过程[2]。stathmin与细胞内的丝裂原激活蛋白激酶3(mitogen-activation protein kinase 3,MAPK3)、周期蛋白依赖性激酶1(cyclindependent kinase 1,CDK1)、Aurora激酶 B(Aurora kinase B,AURKB)相互作用,参与多种信号通路[3]。stathmin 在肺癌[4]、结直肠癌[5]、前列腺癌[6]、脑胶质瘤[7]、黑色素瘤[8]、肝癌[9]、骨肉瘤[10]、胆管癌[11]中均异常表达。Lin等[12]在鼻咽癌的研究中报道,潜伏膜蛋白 1(latent membrane protein 1,LMP1)可以通过CDC2介导调节Oncoprotein 18(Op18)/stathmin信号通路发挥致癌作用。Wu等[13]研究报道,沉默stathmin可以抑制鼻咽癌细胞的增殖、侵袭和转移,并诱导细胞凋亡,且沉默stathmin联合紫杉醇可以增强微管对紫杉醇的敏感性。相关研究表明,在卵巢癌中沉默stathmin可以显着抑制顺铂(cisplatin,DDP)耐药卵巢癌细胞C13K的增殖,增强卵巢癌对DDP的敏感性[14]。但stathmin在DDP耐药鼻咽癌中的研究尚未见报道。Sonic Hedgehog(SHH)信号通路由信号蛋白SHH配体、跨膜蛋白受体PTCH(PTCH1、PTCH2)、跨膜蛋白SMO及下游转录因子GLI蛋白(GLI1、GLI2、GLI3)组成[15]。当缺乏 SHH配体信号的刺激时,该信号通路处于失活状态,当SHH配体存在时,则可激活转录因子GLI,将SHH信号传递到细胞内,调控细胞的生长[16]。SHH信号通路在肿瘤的发生发展进程中也具有重要作用,如胃癌、神经胶质瘤、肺癌、结肠癌、胰腺癌、肝癌等[17-18]。姚莉等[19]研究发现,SHH可以促进鼻咽癌间质血管生成,促进鼻咽癌细胞的侵袭、转移。但SHH信号通路在鼻咽癌DDP耐药性中的作用机制尚不十分清楚。本研究将建立DDP耐药鼻咽癌细胞CNE2/DDP,观察沉默stathmin对CNE2/DDP细胞耐药性的影响,现报道如下。
1 材料与方法
1.1 细胞、主要试剂与仪器
人鼻咽癌细胞CNE2购自美国模式菌种收集中心;DDP购自美国Sigma公司;RPMI1640培养基、人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、胎牛血清、噻唑蓝(methylthiazolyldiphenyl-tertrazolium bromide,MTT)均购自美国GIBCO公司;LipofectamineTM2000、人降钙素(human calcitonin,HCT)抗体、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白定量试剂盒、逆转录试剂盒均购自大连Takara公司;聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜购自德国罗氏诊断有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒、电化学发光(electronics components laboratory,ECL)发光液和RIPA裂解液均购自碧云天生物技术有限公司;si-stathmin、si-NC由上海吉玛公司合成;凝胶成像分析仪购自柯达公司;半干转膜仪购自美国BIO-RAD公司;ABI 7500型实时荧光定量聚合酶链反应(PCR)系统购自美国ABI公司;紫外分光光度计购自美国Thermo公司;细胞培养箱购自美国Forma Scientific公司;PCR仪购自美国BIORAD公司。
1.2 DDP耐药细胞CNE 2/DDP的建立
采用DDP诱导人鼻咽癌细胞CNE2,建立DDP耐药细胞CNE2/DDP。取对数生长期的CNE2细胞在含0.02 μg/ml DDP的培养基中培养24 h,当细胞能稳定生长并传代时,逐渐按0.0625、0.1250、0.2500、0.5000、1.0000 μg/ml增加培养基中DDP的浓度,当细胞可以在1.0000 μg/ml DDP培养基中稳定生长并传代超过10次后,标记为CNE2/DDP细胞。将CNE2、CNE2/DDP细胞接种于含10%胎牛血清的RPMI1640培养基中,置于37℃、5%CO2培养箱中常规培养。
1.3 细胞转染
选取对数生长期CNE2/DDP细胞,将si-stathmin、si-NC按照LipofectamineTM2000说明书要求转染至CNE2/DDP细胞,并分别标记为si-stathmin组、si-NC组,转染成功后进行后续实验。
1.4 MTT法检测细胞增殖抑制情况
采用浓度为 0.0625、0.1250、0.2500、0.5000、1.0000、2.0000 μg/ml的 DDP分别处理对数生长期CNE2细胞、CNE2/DDP细胞及si-stathmin组、si-NC组CNE2/DDP细胞,培养24 h后,分别加入20 μl 5 g/L的MTT溶液,继续培养4 h,取出后吸去上清,每孔加入150μl二甲基亚砜(dimethyl sulfoxide,DMSO),振荡待结晶充分溶解,在490 nm波长下检测细胞吸光度(absorbance,A)值。每组设5个复孔,实验重复3次。细胞抑制率(%)=1-OD样品/OD对照×100%。半抑制浓度(half maximal inhibitory concentration,IC50)为细胞增殖抑制率达到50%时的DDP浓度。耐药指数(resistance index,RI)=(CNE2/DDP细胞IC50)(/CNE2细胞IC50)。
1.5 Westernblot法检测stathmin及相关蛋白表达情况
取适量对数生长期的CNE2、CNE2/DDP细胞及si-stathmin组、si-NC组CNE2/DDP细胞,RIPA裂解后,提取细胞总蛋白,采用BCA法对蛋白浓度定量后变性,然后按照蛋白质印迹法(Western blot)操作步骤进行蛋白电泳-转膜-封闭-一抗孵育-二抗孵育-显影曝光。以目的条带灰度值与内参GADPH灰度值的比值表示目的蛋白stathmin、cleaved caspase 3、Bcl-2、SHH、PTCH1、GLI-1的相对表达量。
1.6 Annexin V-FITC/PI法检测细胞凋亡
取适量对数生长期的si-stathmin组、si-NC组CNE2/DDP细胞,采用 0、0.1250、0.2500 μg/ml的DDP处理24 h后,采用预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次。采用结合缓冲液500 μl悬浮细胞,分别加入5 μl的膜联蛋白V-异硫氰酸荧光素(Annexin V-fluorescein isothiocyanate,Annexin V-FITC)和碘化丙啶(propidium iodide,PI),混匀,室温避光静置15 min。采用流式细胞仪分析测定细胞的凋亡情况。细胞总凋亡率=早期凋亡率+晚期凋亡率。实验重复3次。
1.7 统计学方法
采用SPSS 18.0软件对数据进行分析。符合正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度DDP处理后CNE 2、CNE 2/DDP细胞增殖抑制率的比较
MTT法检测结果显示:CNE2细胞和CNE2/DDP细胞的增殖抑制率均呈DDP浓度依赖性;随着DDP浓度的增加(0.0625、0.1250、0.2500、0.5000、1.0000、2.0000 μg/ml),CNE2细胞和CNE2/DDP细胞的增殖抑制率均逐渐增加(F=158.7、207.1,P<0.01);同一浓度 DDP(0.0625、0.1250、0.2500、0.5000、1.0000、2.0000 μg/ml)处理后,CNE2/DDP细胞的增殖抑制率均明显低于CNE2细胞,差异均有统计学意义(P<0.01)(表1)。DDP对CNE2细胞的IC50为(0.243±0.012)μg/ml,对CNE2/DDP细胞的IC50为(1.347±0.070)μg/ml,耐药指数(RI)为5.591。

表1 不同浓度DDP处理后CNE 2细胞和CNE 2/DDP细胞增殖抑制率的比较
2.2 沉默stathmin对CNE 2/DDP细胞增殖抑制率的影响
MTT法检测结果显示:随着DDP浓度的增加(0.0625、0.1250、0.2500、0.5000、1.0000、2.0000μg/ml),si-NC组和si-stathmin组CNE2/DPP细胞的增殖抑制率均逐渐增加(F=248.7、263.8,P<0.01)。同一 浓 度DDP(0.1250、0.2500、0.5000、1.0000、2.0000 μg/ml)处理后,si-stathmin组CNE2/DPP细胞的增殖抑制率均明显高于si-NC组,差异均有统计学意义(P<0.01)(表2)。DDP对si-stathmin组CNE2/DDP细胞的IC50为(0.582±0.025)μg/ml,对si-NC组CNE2/DDP细胞的IC50为(1.320±0.058)μg/ml。
表2 不同浓度DDP处理后si-NC组和si-stathmin组CNE2/DDP细胞增殖抑制率的比较
2.3 CNE 2、CNE 2/DDP细胞中stathmin蛋白表达水平的比较
Western blot检测结果显示:CNE2/DDP细胞中stathmin蛋白的相对表达量为(1.23±0.08),明显高于CNE2细胞的(0.78±0.04),差异有统计学意义(t=12.324,P<0.01)。(图1)

图1 Western blot检测stathmin蛋白在CNE 2、CNE 2/DDP细胞中的表达情况
2.4 沉默stathmin对CNE 2/DDP细胞中stathmin蛋白表达的影响
si-stathmin组CNE2/DDP细胞中stathmin蛋白的相对表达量为(0.23±0.03),明显低于si-NC组的(0.92±0.07),差异有统计学意义(t=22.193,P<0.01)。(图 2)
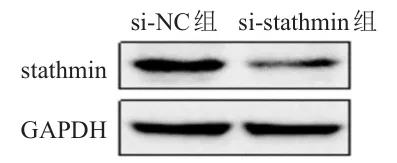
图2 Western blot检测si-NC组和si-stathmin组CNE 2/DDP细胞中stathmin蛋白的表达情况
2.5 沉默stathmin对CNE 2/DDP细胞凋亡的影响
不同浓度 DDP(0、0.1250、0.2500 μg/ml)处理CNE2/DDP细胞后,结果显示:随DDP浓度的增加,si-NC组和si-stathmin组CNE2/DDP细胞的凋亡率均增加,差异均有统计学意义(F=57.65、91.34,P<0.01);同一浓度 DDP(0、0.1250、0.2500 μg/ml)处理后,si-stathmin组CNE2/DDP细胞的凋亡率均明显高于si-NC组,差异均有统计学意义(P<0.01)。(图3、表3)
2.6 沉默stathmin对CNE 2/DDP细胞凋亡蛋白及SHH信号通路相关蛋白表达的影响
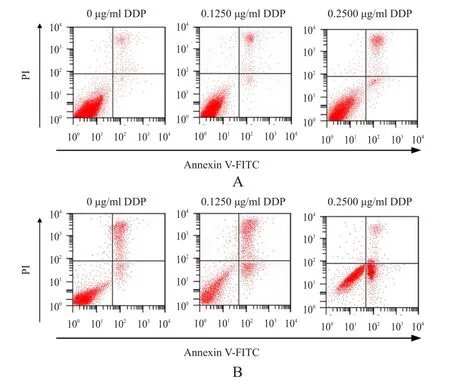
图3 流式细胞仪检测si-NC组和si-stathmin组CNE 2/DDP细胞的凋亡情况

表3 si-NC组和si-stathmin组CNE 2/DDP细胞凋亡率的比较
si-stathmin组CNE2/DDP细胞中cleaved caspase 3蛋白的相对表达量明显高于si-NC组,Bcl-2、SHH、PTCH1、GLI-1蛋白的相对表达量均明显低于si-NC组,差异均有统计学意义(P<0.01)。(图4、表4)
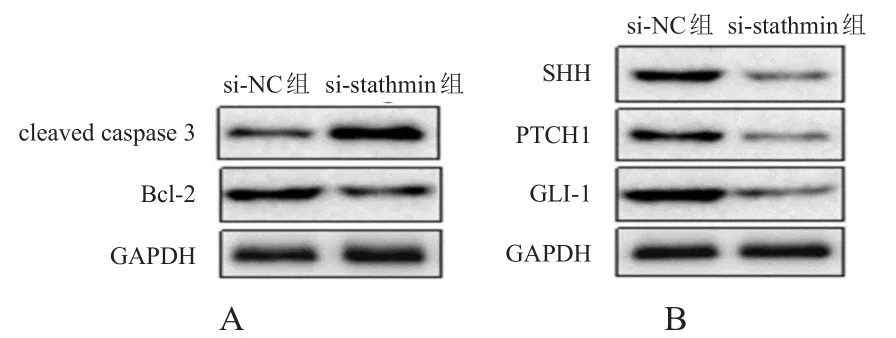
图4 Western blot检测si-NC组和si-stathmin组CNE 2/DDP细胞中凋亡蛋白、SHH信号通路相关蛋白的表达情况
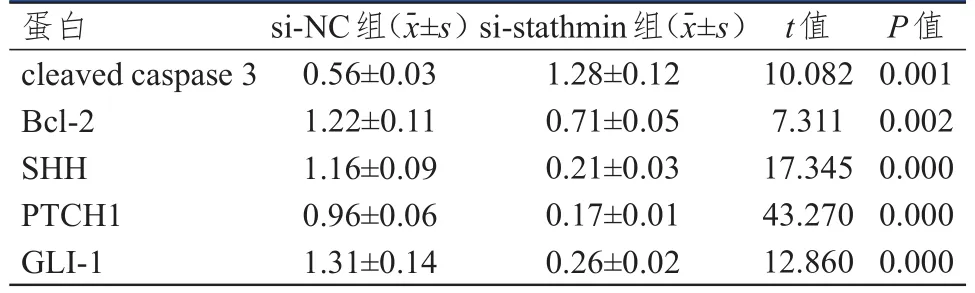
表4 si-NC组和si-stathmin组CNE 2/DDP细胞中凋亡蛋白、SHH信号通路相关蛋白表达水平的比较
3 讨论
stathmin是20世纪80年代发现的一种磷酸化蛋白质,其相对分子质量为1.6×104。stathmin家族成员包括stathmin1、SCG10、SCLIP、RB3。stathmin的磷酸化和去磷酸化均可以促进细胞有丝分裂纺锤体微管的解聚和组装,调控细胞有丝分裂的生物学过程[20]。stathmin的异常表达会导致微管稳态失衡,纺锤体组装异常,干扰细胞周期[21]。stathmin高表达与肿瘤的生长、分化及肿瘤细胞的迁移侵袭有关。相关研究表明,stathmin在人类多种恶性肿瘤中过度表达,促进肿瘤的发生发展,而stathmin表达下调则可以抑制肿瘤细胞增殖、迁移、侵袭,诱导恶性肿瘤细胞凋亡,于是抗stathmin的分子治疗成为人类恶性肿瘤研究的新方向[22]。范才文等[23]运用MTT实验和流式细胞仪分析细胞的增殖和细胞周期,结果发现沉默stathmin可以抑制鼻咽癌细胞5-8F增殖,并促进细胞凋亡,而且该研究还运用裸鼠成瘤实验验证了沉默stathmin对肿瘤生长的抑制作用,揭示了沉默stathmin可以抑制鼻咽癌细胞5-8F的恶性生物学表型,表明stathmin对鼻咽癌的恶性进展具有促进作用,其对恶性肿瘤的治疗抗性具有关键的调节作用。林雪迟等[24]报道,Op18/stathmin参与介导肿瘤细胞的耐药性,靶向Op18/stathmin可能成为耐药性肿瘤治疗的新方法。蒲骁麟等[25]在非小细胞肺癌的研究中揭示,长春碱治疗无效患者肿瘤组织内stathmin的表达水平较长春碱治疗有效患者明显升高,表明stathmin基因的表达水平与非小细胞肺癌患者对长春碱的敏感性呈负相关。石英等[14]在研究卵巢癌耐药中运用Western blot法测定DDP敏感细胞OV2008和DDP耐药细胞C13K中stathmin的表达,运用MTT法和流式细胞仪检测沉默stathmin对耐药细胞C13K增殖、凋亡的影响,结果显示stathmin在DDP耐药细胞C13K中高表达,且沉默stathmin可抑制DDP耐药细胞C13K的增殖,并促进细胞凋亡,逆转了耐药卵巢癌细胞对DDP的敏感性。本研究检测了鼻咽癌DDP耐药细胞CNE2/DDP和鼻咽癌细胞CNE2中stathmin的表达情况,结果发现CNE2/DDP细胞中stathmin蛋白的相对表达量明显高于CNE2细胞(P<0.01);为进一步研究stathmin对CNE2/DDP细胞耐药性的作用,本研究通过MTT法检测沉默stathmin后CNE2/DDP细胞的增殖抑制率,结果发现,沉默stathmin可逆转CNE2/DDP细胞对DDP的耐药性,增强DDP对CNE2/DDP细胞的增殖抑制率。
SHH信号通路在多种肿瘤中均处于活化状态,可能与肿瘤的恶性行为密切相关。但该通路与肿瘤耐药性的研究很少。刘瑞娟等[26]在研究卵巢癌耐药中证实,SHH和GLI-1在紫杉醇耐药乳腺癌细胞MCF-7/PTX中均呈高表达,化疗药物可通过上调SHH信号通路相关蛋白的表达导致乳腺癌的耐药。Song等[27]在卵巢癌耐药研究中阐明,在DDP耐药卵巢癌细胞A2780/DDP中,SHH信号通路蛋白SMO、PTCH和GLI-1的表达较A2780细胞明显升高。本研究采用Western blot检测了沉默stathmin后CNE2/DDP细胞中SHH信号通路相关蛋白SHH、PTCH1、GLI-1和凋亡蛋白cleaved caspase 3、Bcl-2的表达发现,si-stathmin组CNE2/DDP细胞中cleaved caspase 3蛋白的相对表达量明显高于si-NC组,Bcl-2、SHH、PTCH1、GLI-1蛋白的相对表达量均明显低于si-NC组(P<0.01)。表明沉默stathmin可以阻断SHH信号通路,促进DDP耐药CNE2/DDP细胞凋亡,逆转CNE2/DDP细胞对DDP的耐药性。
综上所述,沉默stathmin可以逆转DDP耐药的鼻咽癌细胞CNE2/DDP的耐药性,其机制可能与失活SHH信号通路,促进细胞凋亡有关,为耐药鼻咽癌的治疗提供了新方向。



