赵立平,孙艳秋,张菲菲
滨州医学院附属医院妇产科,山东滨州 256600
上皮性卵巢癌(epithelial ovarian carcinoma,EOC)占女性生殖系统恶性肿瘤的1/4,占卵巢癌全部病理类型的80%~90%,据统计,全球每年新增卵巢癌确诊例数约22 万例。由于卵巢癌患者确诊时多已进展至晚期,患者对治疗的反应较差,易复发,病死率居女性生殖系统恶性肿瘤之首。近年来,卵巢癌发病率显着增高,并呈现年轻化趋势,且5年生存率为35%~57%[1]。研究普遍认为,mRNA 翻译异常可促进肿瘤的发生发展,真核翻译起始因子(eukaryotic translation initiation factor,eIF)4F 的组装是帽依赖相关翻译的限速步骤,且eIF4F 与多种恶性肿瘤患者的预后不良及耐药相关。eIF4F 是由帽子结合蛋白eIF4E、大脚手架蛋白eIF4G 和DEAD-box 的RNA 解旋酶eIF4A 组成,其中eIF4A 是eIF4F 中含量最多的亚基,具有RNA依赖的腺苷三磷酸酶(adenosine triphosphatase,ATPase)和RNA 解螺旋酶活性,在mRNA 翻译起始的帽依赖翻译及恶性肿瘤发生发展中发挥重要作用[2]。eIF4A 在胃癌、结直肠癌、宫颈癌、肝细胞癌、乳腺癌等多种肿瘤组织中过表达,有研究发现,eIF4A 在宫颈癌中过表达,且下调eIF4A 的表达可显着抑制宫颈癌细胞存活、增殖,并促进其凋亡[3];沉默eIF4A基因能够延迟肿瘤细胞DNA 双链断裂(double-strand break,DSB)修复,从而提高宫颈癌对放疗的敏感性。Liang 等[4]研究认为,eIF4A 可能是增加宫颈癌放疗敏感性的一个有希望的靶点。近年来,eIF4A 作为肿瘤治疗的靶点已成为研究的热点,多种靶向eIF4A 的小分子抑制剂已经在临床前模型中得到证实,但有关eIF4A 与EOC 关系的报道较少。本研究通过检测eIF4A 蛋白在EOC 组织中的表达,分析其与患者临床特征的关系,探讨其在EOC 的发生、发展及预后中的作用,为未来EOC 的靶向治疗及预后评估提供有价值的参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年6月至2016年6月在滨州医学院附属医院进行手术治疗的疑似EOC 患者。纳入标准:①均经组织病理学检查确诊;②均为首次手术;③病历资料完整。排除标准:①合并其他部位恶性肿瘤;②非原发性、非上皮性卵巢癌;③严重的内科功能性或器质性病变。依据纳入和排除标准,本研究共纳入168 例疑似EOC 患者,经确诊,其中EOC 123 例,交界性卵巢癌30 例,卵巢良性病变15 例,另选取非卵巢疾病患者20 例(因妇科疾病需部分或全部切除卵巢,且术后病理证实无卵巢疾病)。123 例EOC 患者年龄34~65 岁,中位年龄49 岁,≤50 岁52 例,>50 岁71 例;国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期:Ⅰ~Ⅱ期34 例,Ⅲ~Ⅳ期89 例;世界卫生组织(WHO)组织学分级:高中分化(G1~2级)50 例,低分化(G3级)73 例;病理类型:浆液性囊腺癌84 例,黏液性囊腺癌39 例;有淋巴结转移64例,无淋巴结转移59 例;有腹腔积液84 例,无腹腔积液39 例。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 治疗和随访方法
早期EOC 患者(FIGO 分期为Ⅰ~ⅡA 期)给予卵巢癌根治术,晚期EOC 患者(FIGO 分期为ⅡB~Ⅳ期)给予肿瘤细胞减灭术,术后除1 例(FIGO 分期为ⅠB 期,组织学分级为G1级)患者未行化疗外,其余均给予铂类+紫杉醇联合化疗6 个疗程以上。
采用定期电话随访的方法对123 例EOC 患者进行随访,随访时间自患者出院至2021年12月,记录患者的生存情况。
1.3 免疫组化法检测eIF4A 蛋白的表达情况
取123 例EOC 组织、30 例交界性卵巢癌组织、15 例卵巢良性病变组织和20 例正常卵巢上皮组织,采用免疫组化链霉抗生物素蛋白-过氧化物酶(streptavidin-peroxidase,SP)法检测eIF4A 蛋白的表达情况。采用兔抗人eIF4A 多克隆抗体(稀释浓度为1∶50)作为一抗,采用磷酸盐缓冲液(phosphate buffered solution,PBS)代替一抗作为阴性对照。结果判定:在显微镜下于每张切片的边缘及中央各取5 个高倍视野,计算100 个细胞中阳性细胞所占比例取平均值,阳性细胞所占比例<5%计0分,5%~24%计1 分,25%~49%计2 分,50%~74%计3 分,≥75%计4 分;eIF4A 蛋白主要定位于细胞质,无着色计0 分,浅黄色染色计1 分,黄色染色计2分,棕黄色染色计3 分。将阳性细胞所占比例评分和染色强度评分相乘,≤3 分为(-),4~5 分为(+),6~8 分为(++),9~12 分为(+++),≤5 分判定为eIF4A 低表达,≥6 分为eIF4A 高表达。
1.4 荧光原位杂交(fluorescence in situ hybridization,FISH)检测eIF4A 基因扩增情况
选取免疫组化中eIF4A 蛋白高表达组织及10例正常卵巢组织的石蜡切片进行FISH,eIF4A 探针为eIF4A/17 号染色体探针,为双色探针,用OLYMPUS BX51 荧光显微镜在4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)/FITC/TR 三色滤光镜激发下,观察间期细胞荧光杂交信号并用软件进行分析,eIF4ADNA 探针作为检测探针杂交到17 号染色体17p13,荧光信号为红色四甲基罗丹明,17 号染色体的荧光信号为绿色,正常细胞为单个细胞核中红绿信号各2 个,eIF4A基因扩增异常细胞为单个细胞核中红信号>2 个,规定红/绿比值>2.5 为eIF4A基因扩增[5]。
1.5 统计学方法
采用SPSS 19.0 软件进行统计学处理,计量资料以均数±标准差(±s)表示;计数资料以例数和率(%)表示,组间比较采用χ2检验或Fisher 确切概率法;采用Kaplan-Meier 法绘制生存曲线,组间比较采用Log-rank 检验;EOC 患者预后的影响因素采用Cox 比例风险回归模型分析;以P<0.05 为差异有统计学意义。
2 结果
2.1 不同卵巢组织中eIF4A1 蛋白表达情况的比较
eIF4A 蛋白主要定位于细胞质,细胞质呈棕黄色染色为阳性表达,其在不同卵巢组织中的表达情况见图1。正常卵巢上皮组织、卵巢良性病变组织、交界性卵巢癌组织及EOC 组织中,eIF4A 蛋白高表达率依次升高,差异有统计学意义(χ2=57.316,P<0.05);进一步分析发现,EOC 组织中eIF4A 蛋白高表达率高于交界性卵巢癌组织、卵巢良性病变组织和正常卵巢上皮组织,差异均有统计学意义(χ2=14.200、29.260、38.080,P<0.05);交界性卵巢癌组织中eIF4A蛋白高表达率高于卵巢良性病变组织和正常卵巢上皮组织,差异均有统计学意义(χ2=5.410、7.640,P<0.05);卵巢良性病变组织与正常卵巢上皮组织中eIF4A 蛋白高表达率比较,差异无统计学意义(χ2=0.044,P=0.834)(表1)。
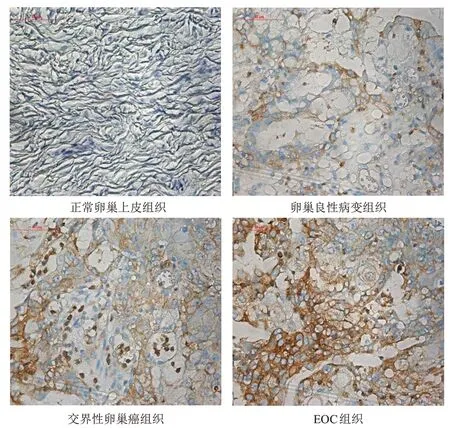
图1 eIF4A蛋白在不同卵巢组织中的表达情况(SP染色,×400)
2.2 不同临床特征EOC 患者EOC 组织中eIF4A蛋白表达情况的比较
123 例EOC 患者EOC 组织中,eIF4A 蛋白高表达93 例,低表达30 例。不同年龄、病理类型EOC患者EOC 组织中eIF4A 蛋白表达情况比较,差异均无统计学意义(P>0.05);FIGO 分期为Ⅲ~Ⅳ期、组织学分级为G3级、有淋巴结转移、有腹腔积液EOC 患者EOC 组织中eIF4A 蛋白高表达率分别高于临床分期为Ⅰ~Ⅱ期、组织学分级为G1~2级、无淋巴结转移、无腹腔积液的患者,差异均有统计学意义(P<0.05)。(图2、表2)
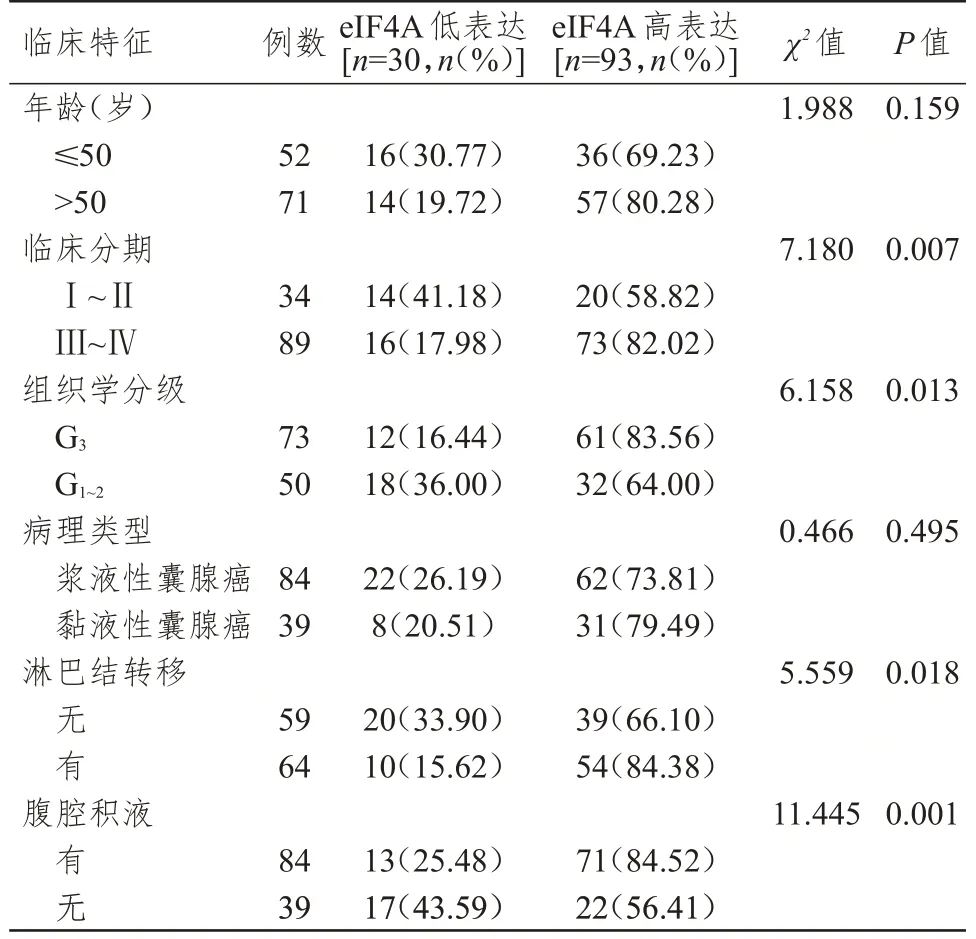
表2 不同临床特征EOC 患者EOC 组织中eIF4A 蛋白表达情况的比较(n=123)

图2 EOC组织中eIF4A蛋白的表达情况(SP染色,×400)
2.3 eIF4A 基因扩增情况
123 例EOC 患者EOC 组织中,eIF4A 蛋白高表达93 例,低表达30 例。免疫组化法检测eIF4A 蛋白(++)和(+++)的患者比例分别为43.01%(40/93)和56.99%(53/93);FISH 检测eIF4A基因的扩增与免疫组化法检测eIF4A 蛋白(++)和(+++)的符合率分别为40.00%(16/40)和39.62%(21/53)。(图3)
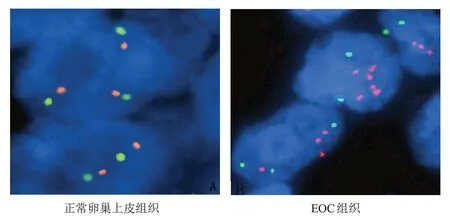
图3 正常卵巢上皮组织和EOC组织中eIF4A基因扩增FISH图
2.4 89 例Ⅲ~Ⅳ期EOC 患者EOC 组织中eIF4A 蛋白表达情况与化疗反应的关系
将化疗后完全缓解与部分缓解的患者视为化疗有效,将疾病稳定与疾病进展患者视为化疗无效,比较89 例Ⅲ~Ⅳ期EOC 患者EOC 组织中eIF4A蛋白低表达(n=16)和eIF4A 蛋白高表达(n=73)患者的化疗有效率,结果显示,eIF4A 蛋白低表达患者的化疗有效率为56.25%(9/16),高于eIF4A 蛋白高表达患者的24.66%(18/73),差异有统计学意义(χ2=6.198,P=0.013)。
2.5 预后情况的比较
截至2021年12月,123 例EOC 患者失访8 例,随访率为93.50%(115/123)。30 例eIF4A 蛋白低表达EOC 患者的中位总生存期为58 个月(95%CI:52.01~63.99),93 例eIF4A 蛋白高表达患者的中位总生存期为49 个月(95%CI:45.44~52.56);eIF4A蛋白低表达患者的5年总生存率为45.8%,明显高于高表达患者的28.8%,差异有统计学意义(χ2=8.815,P=0.003)(图4)。89 例Ⅲ~Ⅳ期EOC 患者复发45 例,未控(指肿瘤持续或进展)15 例,缓解29例,其中复发和未控EOC 患者EOC 组织中eIF4A蛋白高表达55例,缓解EOC患者EOC组织中eIF4A蛋白高表达18 例;复发和未控EOC 患者EOC 组织中eIF4A 蛋白高表达率为91.67%(55/60),明显高于缓解患者的62.07%(18/29),差异有统计学意义(χ2=11.615,P=0.001)。
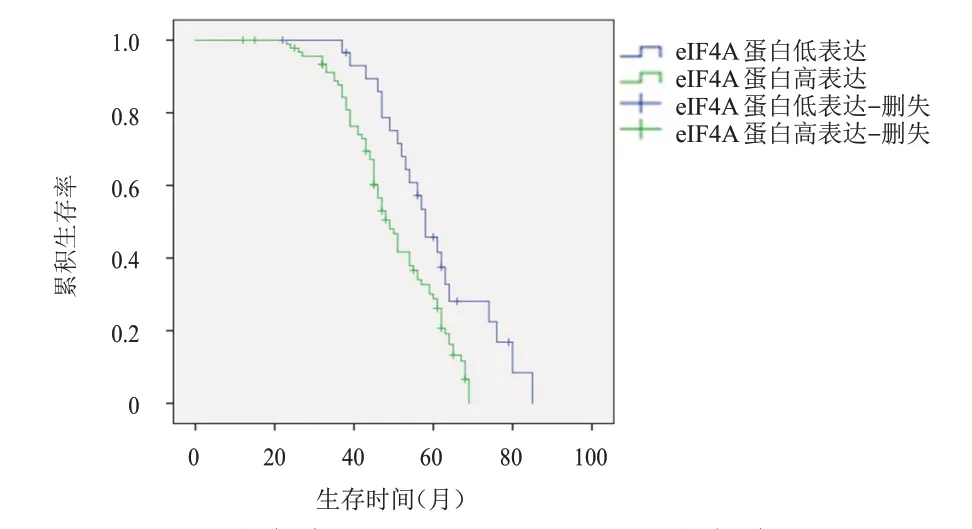
图4 eIF4A蛋白高表达(n=93)与eIF4A蛋白低表达(n=30)EOC患者的生存曲线
2.6 EOC 患者预后的影响因素分析
单因素分析结果显示,年龄、病理类型均可能与EOC 患者的预后无关(P>0.05);组织学分级、临床分期、淋巴结转移情况、腹腔积液情况、术后病变残余情况、eIF4A 蛋白表达情况均可能与EOC患者的预后有关(P<0.05)。Cox 比例风险回归模型分析结果显示,临床分期为Ⅲ~Ⅳ期、组织学分级为G3级、术后病变残余均是EOC 患者预后的独立危险因素(P<0.05)。(表3)
3 讨论
eIF4A 蛋白是相对分子质量最小的、最先被发现为翻译起始因子的DEAD-box RNA 解旋酶家族原型成员,既具有RNA 解螺旋酶活性,又具有RNA 依赖的ATP 酶活性。eIF4A 在人类体内以eIF4A1、eIF4A2、eIF4A3 三种形式存在,eIF4A1 蛋白(其基因位于17p13[6])和eIF4A2 蛋白(其基因位于18p11.2[7])主要存在于细胞质内并且有高达90%的同源性,主要作用是参与蛋白质翻译起始阶段对核糖体的募集;而eIF4A3 蛋白则主要存在于细胞核,参与RNA 代谢过程。本研究在蛋白水平上的研究限于细胞质中的蛋白,因技术所限无法进一步区分eIF4A1 蛋白、eIF4A2 蛋白而统称为eIF4A 蛋白。eIF4A 在生长活跃的细胞中高表达,抑制eIF4A 的表达可抑制肿瘤细胞的迁移[8]。Nishida 等[9]研究发现,eIF4A 在急性髓细胞性白血病(acute myelogenous leukemia,AML)中过表达,且通过罗欣替尼靶向抑制eIF4A 能诱导抗AML 作用,并证实了相关信号通路的存在。目前,eIF4A与EOC 的关系仍处于初期研究阶段,对eIF4A 进行深入、广泛的研究,有助于探索EOC 的转移机制,为EOC 的治疗提供理论依据。
本研究结果显示,EOC 组织中eIF4A 蛋白高表达率更高,提示其过表达与卵巢上皮细胞失控性增殖和恶性转化密切相关。eIF4A 蛋白高表达率在卵巢良性病变组织、交界性卵巢癌组织及EOC组织中逐渐升高,表明EOC 发生发展的过程是连续的,交界性卵巢癌是卵巢上皮细胞恶变不可或缺的阶段;虽然eIF4A 蛋白高表达率在卵巢良性病变组织与正常卵巢上皮组织之间无明显差异,但eIF4A 蛋白在卵巢良性病变组织中有一定程度的高表达,提示eIF4A 过表达在卵巢病变早期即存在,这与临床医师对卵巢良性上皮性肿瘤尽早行手术治疗的观点相一致。本研究结果显示,FIGO分期为Ⅲ~Ⅳ期、组织学分级为G3级EOC 患者EOC 组织中eIF4A 蛋白高表达率分别高于临床分期为Ⅰ~Ⅱ期、组织学分级为G1~2级的患者,与Thompson 等[10]的研究结果相符,该研究证实,eIF4A 能上调蛋白激酶B(protein kinase B,PKB,又称AKT)蛋白的表达及活性,并激活雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)/Notch 信号通路,促进肿瘤细胞的黏附和侵袭,因此推测eIF4A 高表达的患者更易发生复发和转移。
本研究结果显示,FISH 检测eIF4A基因的扩增与免疫组化法检测eIF4A 蛋白(++)和(+++)的符合率分别为40.00%(16/40)和39.62%(21/53),符合率较低,但值得肯定的是,eIF4A 蛋白高表达的EOC 组织中存在eIF4A基因扩增,这与Shuda 等[11]的肝细胞癌中eIF4AmRNA 的相对表达量上升了1.2~1.7 倍相一致;此外,Gao 等[12]通过高通量基因表达数据库发现,胃癌组织中eIF4AmRNA 的相对表达量明显高于正常胃壁组织。人17 号染色体上含有多个已知及未知的癌基因和抑癌基因,郑淑芳等[13]研究发现,卵巢癌细胞株SKVO3 及OV2 中存在17 号染色体上基因的扩增,造成这种基因扩增的原因可能有两种:①17 号染色体拷贝数增加;②某一基因本身扩增。本研究应用存在于17 号染色体上的eIF4A基因与17 号染色着丝粒共杂交,排除了染色体本身扩增导致的目的基因的扩增。而免疫组化与FISH 结果一致率较低的原因也可能有两种:①本研究样本量过少;②eIF4A1 和eIF4A2 主要存在于细胞质内,并且有高达90%的同源性,免疫组化染色结果可能是eIF4A1 和eIF4A2 共同作用的结果。本研究未证实eIF4A2基因的扩增,也无法证实二者在EOC 中各自作用的大小,下一步研究将扩大样本量,寻找eIF4A2基因探针,进一步分析eIF4A1及eIF4A2基因在EOC 中的表达、作用及与患者预后的关系。
本研究随访结果发现,eIF4A 低表达患者的5年总生存率为45.8%,高于高表达患者的28.8%;89例Ⅲ~Ⅳ期EOC 患者中,复发和未控患者EOC 组织中eIF4A 蛋白高表达率为91.67%,明显高于缓解患者的62.07%,与Gao 等[12]和Sridharan 等[14]的研究结果相符。Gao 等[12]研究发现,eIF4A1 高表达与胃癌患者的高TNM 分期、低分化及不良预后显着相关。Sridharan 等[14]研究显示,在紫杉醇耐药的三阴性乳腺癌细胞中,eIF4A 酶活性增加。Hashimoto等[15]研究证实,在胰腺导管癌中,eIF4A1 抑制剂——西藜芦醇(Silvestrol)能够与eIF4A1结合并抑制其基因活性,进而抑制下游的二磷酸腺苷核糖基化因子6(adenosine diphosphate ribosylation factor 6,ARF6)和MYC 的表达,增加其对程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)免疫治疗的敏感性,这为EOC 的靶向治疗提供了新的思路和方法,具体的方法和作用机制尚有待进一步研究。
本研究多因素分析结果显示,临床分期为Ⅲ~Ⅳ期、组织学分级为G3级、术后病变残余均是EOC患者预后的独立危险因素(P<0.05),尽管未能证实eIF4A 表达是EOC 患者预后的独立影响因素,但能证明eIF4A 蛋白过表达能促进肿瘤的发生、发展,未来可进一步增加样本量并采取多种随访方式进行更深入的研究探讨,并且国外已有一些实验证实了靶向抑制或沉默eIF4A基因能有效抑制肿瘤的发生。研究显示,eIF4A 抑制剂——西藜芦醇可增加乳腺浸润性导管癌细胞T-47D 对放疗的敏感性[16];CR-31 介导的eIF4A 抑制剂可以抑制胰腺导管癌细胞的生长,提高患者的生存率并避免全身毒性[17];沉默黑色素瘤WM858 细胞中的eIF4A1,可显着抑制其增殖和侵袭[18];罗卡格拉茨已被证明在体内和体外均可使mRNA 结合到eIF4A1 和eIF4A2,并增强其抗肿瘤活性[19];但遗憾的是,上述这些研究尚未成功应用于临床。
综上所述,eIF4A 参与了卵巢上皮组织由正常-良性病变-交界性肿瘤-癌的渐进过程,且EOC 患者预后与FIGO 分期、组织学分级、术后病变残余情况有关,eIF4A 高表达者的总生存率明显降低,eIF4A 有望成为EOC 靶向治疗及预后评估的分子标志物。



