常 亮,徐 璐,贾 妍,刘素云,李拥军
(河北医科大学第二医院心内科,河北 石家庄 050000)
心肌细胞肥大所致心肌肥厚是冠心病、瓣膜症和高血压等心脏疾病患者心脏结构不可逆性改变和心脏功能向失代偿期演变的关键阶段,是心力衰竭的主要病理基础[1,2]。心肌肥厚的分子病理机制极为复杂,对于引起心肌肥厚发生的信号转导通路仍然缺乏了解。内脂素属于脂肪细胞因子家族成员,在内脏脂肪细胞中高表达,具有烟酰胺磷酸核糖转移酶活性,在烟酰胺腺嘌呤二核苷酸的合成过程中发挥重要作用[3,4]。前期研究结果显示内脂素能够诱导心肌细胞肥大的发生[5]。但是对于内脂素诱导产生心肌细胞肥大的分子机制仍然缺乏了解,需要进一步深入探究。表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路的下游靶蛋白包括丝氨酸-苏氨酸激酶(serine-threonine kinase,AKT)、细胞外信号调节激酶1/2 (extracellular signal regulated kinase1/2 ,ERK1/2)和信号转导与转录激活因子3(signal transduction and transcriptional activator 3, STAT3),EGFR通路参与细胞增殖、分裂和周期调控等过程[6],与心肌病和心血管损伤等心血管疾病的发生密切相关[7,8]。本研究观察内脂素对大鼠心肌细胞肥大的影响,并对EGFR信号通路在其中的作用进行初步探讨。
1 材料与方法
1.1 动物
60只无特定病原体(specific pathogen free,SPF)级Wistar雄性大鼠购自湖南斯莱克景达实验动物科技有限公司,鼠龄均为6周,体重(158.27±13.64)g。饲养环境温度22~25℃,相对湿度51%~54%。所有大鼠需在SPF动物中心饲养1周,使大鼠适应SPF动物中心的饲养条件以及环境。随机分为对照组、内脂素组和内脂素+AG1478组,20只/组。对照组:按照3 mL·kg-1·d-1腹腔注射生理盐水,周期为7 d。内脂素组:按照3 mL·kg-1·d-1腹腔注射0.5 g/mL内脂素,周期为7 d。内脂素+AG1478组:按照3 mL·kg-1·d-1腹腔注射0.5 mg/mL内脂素与10 ng/mLAG1478混合液,周期为7 d。大鼠处理过程经过动物伦理委员会审核。
1.2 试剂
DMEM高糖培养基(货号:SH30022.01B)和胎牛血清(货号:30070.03)均购自美国Hyclone生物科技有限公司。心钠素(atriopeptin,ANP)(货号:ab5993)、磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)(货号:ab181602)、脑钠肽(brain natriuretic peptide,BNP)(货号ab243440)、EGFR(货号:ab52894)、磷酸化-丝氨酸-苏氨酸激酶(phosphorylated-serine-threonine kinase,p-AKT)(货号:ab38449)、磷酸化-细胞外信号调节激酶1/2(phosphorylated-extracellular signal regulated kinase1/2,p-ERK1/2)(货号:ab176640)和磷酸化-信号转导与转录激活因子3(phosphorylated-signal transduction and transcriptional activator 3,p-STAT3)(货号:ab76315)抗体均购自美国Abcam生物科技有限公司。EGFR抑制剂AG1478(货号:153436-53-4)购自美国Sigma生物科技有限公司。
1.3 仪器
化学发光凝胶成像仪(型号:ImageQuant Las4000)购自美国GE科技有限公司。垂直电泳槽(型号:Protean 165-8001)购自美国伯乐科技有限公司。高速冷冻离心机(型号:JIDI-16R)购自广州吉迪仪器有限公司。
1.4 指标检测
大鼠药物处理完成后立即处死,分离心脏后称重,分离左心室后称重,心脏重量指数=心脏重量/大鼠体重,左心室重量指数=左心室重量/大鼠体重[9]。使用PBS缓冲液冲洗心脏,切除心尖,用眼科剪将组织剪碎至0.5 mm3左右大小并置于10 cm培养皿中,加入5 mL的0.25%胰酶并置于37℃中消化10 min,将上清液收集至50 mL离心管中,此操作重复3次。30 mL上清液中加入20 mL的DMEM高糖培养基(含10%胎牛血清)终止消化,5 000 r/min离心5 min,离心半径12 cm,弃去上清液,使用10 mL的DMEM高糖培养基(含20%胎牛血清)重悬沉淀并转移至T25培养瓶中培养,5%CO2、37℃条件下培养2 h。差速贴壁法分离心肌细胞,接种于另一TT25培养瓶中继续培养。培养48 h后心肌细胞贴壁完全,将培养基吸尽,加入PBS缓冲液冲洗细胞2次,加入0.25%胰酶1 mL消化心肌细胞。3 min后加入DMEM高糖培养基(含20%胎牛血清)2 mL终止消化,细胞吹打混匀后收集至15 mL离心管中,5 000 r/min离心5 min,离心半径12 cm,弃去上清液,使用DMEM高糖培养基(含20%胎牛血清)5 mL重悬心肌细胞,将细胞悬液滴加于载玻片上于倒置显微镜下观察并拍照,随机选取4个视野,每个视野中选取10个细胞测量直径,并根据直径计算细胞体积。收集1×105个细胞,5 000 r/min离心5 min,离心半径12 cm,弃去上清液,加入200 μL细胞裂解液,采用考马斯亮蓝染色法检测每组心肌细胞的总蛋白含量。
1.5 蛋白免疫印迹(western blotting)检测蛋白表达量
收集1×106个心肌细胞,1 000 r/min离心后将上清液弃去,沉淀中加入细胞裂解液200 μL并用枪头反复吹打直至将沉淀完全重悬。4℃裂解30 min后,4℃,10 000 r/min离心10 min,将上清液转移至另一干净EP管中。通过BCA蛋白定量试剂盒检测细胞裂解液中蛋白浓度。进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE),每孔蛋白上样量为10 μg,120 V电泳50 min后通过湿转法将蛋白转至聚偏氟乙烯 (polyvinylidene fluoride membrane,PVDF)膜上。将PVDF膜取出并浸泡于5%脱脂奶粉中封闭1 h,使用PBS-吐温20洗涤剂(PBS-tween20,PBST)冲洗PVDF膜3次,10 min/次。Anti-ANP、Anti-BNP、Anti-EGFR和anti-GAPDH按1∶500比例稀释、anti-p-AKT、anti-p-ERK1/2和anti-p-STAT3按1∶100比例稀释,稀释液为3%BSA。将各蛋白所处位置处的PVDF膜裁下并浸泡于对应蛋白的一抗溶液中,4℃孵育过夜。PBST冲洗3次,10 min/次。加入二抗溶液室温孵育30 min,孵育结束后用PBST冲洗3次,10 min/次,化学发光检测蛋白表达情况。以蛋白条带的灰度值作为蛋白的蛋白表达量,目标蛋白相对表达量=目标蛋白表达量/GAPDH蛋白表达量。
1.6 统计学处理
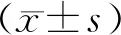
2 结果
2.1 内脂素对大鼠心脏重量指数和左心室重量指数的影响
内脂素组心脏重量指数和左心室重量指数均明显高于对照组,组间差异具有统计学意义(P<0.05)。见表1。
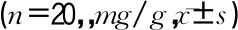
表1 内脂素对大鼠心脏重量指数和左心室重量指数的影响
2.2 内脂素对大鼠心肌细胞肥大的影响
内脂素组心肌细胞体积、蛋白含量、ANP和BNP蛋白相对表达量均明显高于对照组,组间差异具有统计学意义(P<0.05),见表2。Western blot结果见图1。
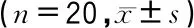
表2 内脂素对大鼠心肌细胞体积、蛋白含量、ANP和BNP蛋白相对表达量的影响
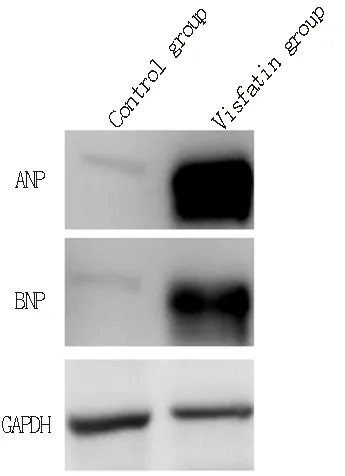
图1 内脂素对大鼠心肌细胞ANP和BNP表达的影响
2.3 内脂素对大鼠心肌细胞中EGFR信号通路的影响
内脂素组心肌细胞中EGFR、p-AKT、p-ERK1/2和p-STAT3蛋白相对表达量均明显高于对照组和内脂素+AG1478组,组间差异具有统计学意义(P<0.05)。而对照组和内脂素+AG1478组心肌细胞EGFR、p-AKT、p-ERK1/2和p-STAT3蛋白相对表达量比较,组间差异无统计学意义(P>0.05),见表3。Western blot结果见图2。
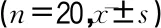
表3 内脂素对大鼠心肌细胞中EGFR信号通路的影响
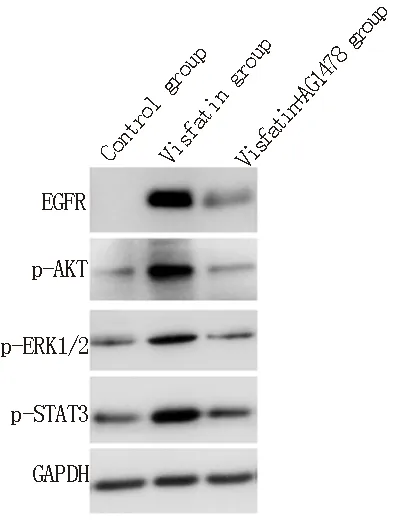
图2 内脂素对大鼠心肌细胞中EGFR信号通路的影响
2.4 EGFR信号通路介导了内脂素诱导的大鼠心肌细胞肥大改变
内脂素组心肌细胞中ANP和BNP蛋白相对表达量均明显高于对照组和内脂素+AG1478组,组间差异具有统计学意义(P<0.05)。而对照组和内脂素+AG1478组心肌细胞ANP和BNP蛋白相对表达量比较,组间差异无统计学意义(P>0.05),见表4。Western blot结果见图3。
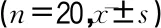
表4 各组心肌细胞ANP和BNP蛋白相对表达量比较

图3 各组心肌细胞ANP和BNP蛋白相对表达量比较
3 讨论
心肌肥厚是心力衰竭的前期病变,是猝死、脑卒中和冠心病等心脑血管疾病发生的独立危险因素[10-12]。脂肪细胞因子主要包括内脂素、脂联素和瘦素等,由内脏脂肪细胞分泌产生,与心肌肥厚的发生密切相关[13,14]。对内脂素在心肌细胞肥大过程中的调节机制进行深入探究,并且从中寻找与心肌细胞肥大密切相关的标志物分子,有利于心肌肥厚的诊断和治疗。
本研究发现内脂素处理大鼠后出现明显的心肌细胞肥大表型,分析其原因可能是由于内脂素水平异常会引起心肌细胞产生氧化应激。Carbone等[15]的研究发现内脂素具有烟酰胺磷酸核糖转移酶活性,能够调节烟酰胺腺嘌呤二核苷酸的生物学合成。由于烟酰胺腺嘌呤二核苷酸参与线粒体呼吸电子传递链中的电子传递,并且是重要的质子和电子受体。因此内脂素水平异常会引起烟酰胺腺嘌呤二核苷酸合成异常,使得电子呼吸传递链紊乱,导致大量超氧离子和过氧离子等氧自由基的形成,形成氧化应激反应。氧化应激过程中形成的氧自由基与心肌细胞内的代谢酶结合造成代谢酶类蛋白质空间结构破坏并抑制其活性,使得心肌细胞的糖代谢和脂质代谢紊乱,最终引起心肌细胞肥大的发生[16]。Behrends等[17]的研究发现烟酰胺腺嘌呤二核苷酸是糖酵解过程中的关键质子受体,糖酵解过程中产生的质子能够与烟酰胺腺嘌呤二核苷酸结合形成还原型烟酰胺腺嘌呤二核苷酸,其具有较强的还原性,将质子传递至乙酰辅酶A的同时释放大量三磷酸腺苷。糖酵解代谢过程中产生的三磷酸腺苷能够为细胞中微丝的组装提供大量能量,微管蛋白经三磷酸腺苷磷酸化后形成二聚体并进一步组装成微丝,因此内脂素水平升高会促进心肌细胞产生大量三磷酸腺苷,使得微管蛋白大量组装成微丝结构,微丝大量合成使得心肌细胞发生极化,最终引起心肌细胞出现肥大表型[18]。
进一步研究发现内脂素能够激活心肌细胞中的EGFR信号通路,并且EGFR信号通路介导了内脂素诱导的大鼠心肌细胞肥大改变。分析其原因可能是由于EGFR信号通路参与细胞周期调控。Kenigsberg等[19]的研究发现EGFR信号通路参与细胞周期调控。细胞周期发展至有丝分裂中期会形成纺锤丝,此阶段微丝大量形成,使得细胞体积增大。因此内脂素水平升高会导致EGFR信号通路的异常活化,导致细胞周期阻滞的发生。心肌细胞周期停滞在中期,微丝大量组装,导致心肌细胞体积增大而出现心肌细胞肥大表型[20]。同时,Darabi等[21]的研究发现白介素和肿瘤坏死因子等炎症因子是EGFR信号通路的下游靶基因。因此内脂素作用于心肌细胞并激活EGFR信号通路后能够诱导白介素和肿瘤坏死因子等炎症因子的表达,进而促进心肌细胞局部炎症反应的形成。炎症因子作用于心肌细胞后引起心肌细胞代谢紊乱,最终导致心肌细胞肥大的形成[22]。
综上所述,内脂素诱导大鼠心肌细胞出现肥大表型,而EGFR信号通路介导了内脂素诱导的大鼠心肌细胞肥大改变,EGFR抑制剂AG1478能够抑制内脂素诱导的心肌细胞肥大,在心肌细胞肥大的治疗中具有一定临床意义。



