陈柏岑,梁 娜,颜冬菁,陈 彤,肖 曼,蔡望伟
(海南医学院生物化学与分子生物学重点实验室,海南 海口 571199)
肝癌是全球第5 大常见癌症,每年有将近百万例新发和死亡病例[1]。其中,肝细胞癌(hepatocellular carcinoma,HCC)约占原发性肝癌的90%以上,是癌症相关死亡的第2 大常见原因,也是目前最常见和最致命的癌症之一,这也成为一个主要的全球公共健康问题[1]。目前HCC 的预防、诊断和治疗方面已经取得了重大进展,并且随着靶向药物和免疫治疗的实施,HCC 相关的不良结局正在发生显着变化,患者的预期寿命也得到了改善[2]。近十年来,传统的一线治疗方法是采用索拉非尼(Sorafenib)或仑伐替尼[3]。其中,索拉非尼一直是治疗的主要用药。Sorafenib 是一种口服多靶点的激酶抑制剂,通过抑制肿瘤细胞增殖,从而抑制肿瘤的恶性生长,是首个能改善晚期HCC 患者生存期的一线药物[4]。70%的患者在初始治疗的前3 年内复发早期HCC通常是可切除的,然而,临床上索拉非尼药物耐药正变得越来越普遍,HCC 患者的生存质量大大降低[5-7]。了解导致耐药性的机制,是提高HCC 患者的生存期的有效途径,因此本研究旨在确定导致耐药性的因素和减轻耐药性的方法。
长链非编码RNA (long non-coding RNAs,lncRNAs)具有许多生物学功能,越来越多的研究表明,lncRNAs 在癌症的发生、发展中起着非常重要的作用。lncRNAs 的异常表达与细胞增殖、分化、侵袭、迁移、上皮细胞-间充质转化、血管生成等密切相关[8]。近年来的研究发现,lncRNA 参与药物的代谢,与 药 物 耐 药 性 密 切 相 关[9,10]。因 此,研 究lncRNA 与肿瘤耐药性之间的关系,将有助于阐明lncRNA 在肿瘤耐药性发生过程中的生物学机制,为提高药物治疗的有效性提供了新的依据。
长链非编码RNA LINC00662 是人类19q11 染色体编码的一段长度为2 085 的序列。近年有研究表明,LINC00662 作为一种致癌lncRNA,是癌细胞的增殖、迁移和侵袭的重要调节因子[11]。但是,LINC00662 在肝癌细胞耐药性发生中的作用尚未完全清楚。本研究探讨了LINC00662 对肝癌细胞索拉非尼耐药性的影响及相关的机制。
1 材料与方法
1.1 材料
人肝癌HCC 细胞株(HepG2、HCCLM3)均来自于陆军第三大医科大学何凤田教授研究组馈赠;DMEM basic 培养基、胎牛血清购自美国Gibco 公司货号分别为(C11965500B、C0232);miRNA 逆转录试剂盒、内参U6 验证引物、miRNA 模拟物(miR-106a-5p mimics)均购于中国广州易锦生物,货 号 分 别 为(QP113、HmiR-SN0026、HmiRSN0026);总 RNA 提 取 试 剂 盒 购 于 美 国Eastep®Super,货号(LS1040);cDNA 合成试剂盒及实时定量PCR 扩增试剂盒购于中国上海翌圣,货号分别为(11111ES92、11202ES03);小干扰RNA(siRNA)购于上海艾博思生物科技有限公司,Lipo8000 ™转染试剂购于中国碧云天生物,货号(C0533)双荧光素酶报告基因检测试剂盒购于中国南京诺唯赞生物,货号(DD1205);细胞活性检测试剂盒(CCK-8)购于DOJINDO,货号(CK04);小窝蛋白-1(cavitin-1,CAV1)兔多克隆抗体、内参GAPDH 兔单克隆抗体、羊抗兔 IgG 二抗购于上海艾博抗生物公司。
1.2 实验方法
1.2.1 细胞培养 HepG2、HCCLM3 肝癌细胞采用含浓度10%胎牛血清的DMEM 培养基,在37 ℃、含5% CO2的细胞培养箱中培养。待细胞融合度到达80%时,加入0.5 mL 胰酶消化至细胞变形脱落,加入完全培养基终止消化,按照一定比例移入至新的25T 细胞培养瓶中继续培养。
1.2.2 CCK-8 法检测细胞活力 将HCC 细胞使用细胞计数仪计数,按照2 500 个/孔接种到96 孔板中,置 于 培 养 箱 培 养48 h 时,将 10 μL 的CCK-8 溶液添加到每孔中。记录450 nm 处吸光度(OD)值。细胞存活率=实验组OD/对照组OD×100%。
1.2.3 细胞转染 收集生长对数期细胞,以每孔1×106个细胞的浓度接种在6 孔板,细胞铺满瓶底70% 时 利 用 Lipo8000 ™转 染 试 剂 将 si-NC、si-LINC00662、mimics-NC、miR-106a-5p mimics、si-CAV1 分别转染HCC-SR 细胞,培养48 h 后,收集细胞进行后续分析。
1.2.4 双荧光素酶报告基因检测 培养箱中取出待测细胞培养板,加入相应试剂检测。检测萤火虫荧光素酶及海肾荧光素酶吸光度。
1.2.5 实时荧光定量PCR(RT-qPCR)检测LINC00662、miR-106a-5p 和CAV1 mRNA 表 达。先用试剂盒提取细胞内的总RNA。使用miRNA 逆转录试剂盒、cDNA 合成试剂盒进行反转录,利用qPCR SYBR Green Master Mix 试剂进行RT-PCR,引物序列见表1。

表1 引物序列Tab 1 Primer sequence
1.2.6 Western blotting 检测CAV1 蛋白表达 提取细胞总蛋白,检测蛋白浓度。以10%凝胶进行SDS-PAGE 凝胶电泳。电泳条件为80 V,30 min;120 V,1 h。此后以湿转法恒流200 mA 转膜2 h,转膜完成后,将PVDF 膜浸泡于购买的封闭液中,室温下封闭30 min,加入稀释后的一抗4 ℃摇床孵育过夜(一抗稀释比例为:CAV1,1∶1 000 再加入HRP标记的羊抗兔二抗或羊抗鼠二抗孵育2 h(二抗稀释比例均为 1∶5 000)。使用化学发光系统成像扫描,Image J 软件分析条带的灰度值,以GAPDH 作内参进行定量。
1.3 统计学处理
2 结果
2.1 HepG2、HCCLM3 索拉非尼耐药细胞株的建立
通过CCK8 法测定HepG2、HCCLM3 细胞的对索拉非尼的IC50,再比较索拉非尼耐药株HepG2-SR、索拉非尼耐药株HCCLM3-SR 对索拉非尼的IC50,确定耐药指数RI。实验结果发现HepG2、HCCLM3 对索拉非尼的IC50时的浓度分别为(10.00±0.30)、(8.00±0.12)μmol/L,且 进 一 步验证HepG2-SR、HCCLM3-SR 的索拉非尼的IC50浓度分别为(40.00±0.22)、(30.00±0.15)μmol/L,因此HepG2-SR 的耐药指数IR 为(4.00±1.40),t=3.19,HCCML3-SR 的耐药指数IR 为(3.75±0.08),t=3.09,表明索拉非尼耐药细胞株构建成功,结果见图1。
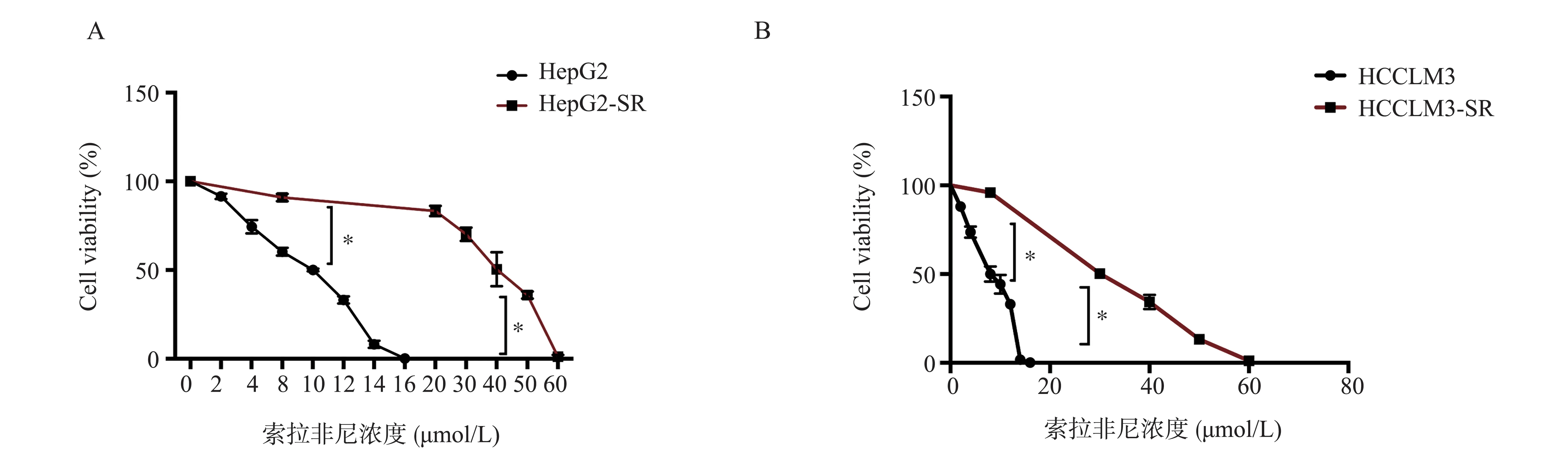
图1 不同浓度的索拉非尼对HepG、HCCLM3 与其耐药株的细胞存活率检测Fig 1 Cell survival rate of HepG,HCCLM3 and their resistant strains at different concentrations of sorafenib
2.2 LINC00662 可以吸附miR-106a-5p,miR-106a-5p靶向调控LINC00662和CAV1 mRNA的表达
越来越多的证据表明lncRNA 可以作为竞争性内源性RNA(competing endogenous RNAs,ceRNA),干扰miRNA 的功能,进而干扰miRNA 靶向基因的表达。为了研究LINC00662 的作用机制,通过生物信息学网站 LncBase Predicted v.2 预测LINC00662结 合 的 miRNA,结 果 显 示 LINC00662 与miR-106a-5p 之间存在结合位点,提示LINC00662具有吸附miR-106a-5p 的作用,见图2A。进一步通过Targetscan 预测miR-106a-5p 的靶点,结果显示miR-106a-5p 与CAV1-3'-UTR 之间存在结合位点,见图2B。双荧光素酶报告实验显示,与转染miR-NC 比 较,转 染miR-106a-5p mimics 可 降 低WT-LINC00662 和WT-CAV1 的相对荧光素酶活性,差异具有统计学意义(分别t=10.11,P<0.01 和t=11.21,P<0.01),而 对 MUT-LINC00662(MUT-CAV1)相对荧光素酶活性无显着变化,见图2C、D。结果表明,LINC00662 通过吸附作用抑制miR-106a-5p 的表达,而miR-106a-5p 可以靶向结合LINC00662 和CAV1mRNA,抑制LINC00662 和CAV1 的表达。
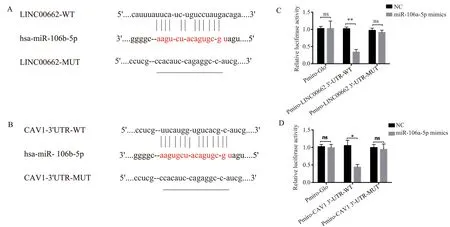
图2 双荧光素酶报告实验验证miR-106a-5p 对 LINC00662 、CAV1 靶向调控Fig 2 Dual luciferase reporter assay verifies miR-106a-5p targeting and regulation of LINC00662 and CAV1
2.3 索拉非尼耐药细胞株中LINC00662、miR-106a-5p、CAV1 的表达情况
为 了 研 究LINC00662、miR-106a-5p、CAV1 与索拉菲尼耐药性的关系,分析了HepG2、HCCLM3、HepG2-SR 和 HCCLM3-SR 细 胞 中LINC00662 的表达情况,结果显示,与其对照细胞HepG2、HCCLM3 相比,HepG2-SR、HCCLM3-SR中LINC00662 相对表达明显增高,差异具有统计学意义(分别为t=24.74,P<0.01 和t=51.70,P<0.01);对miR-106a-5p 的分析结果显示,HepG2-SR和HCCLM3-SR 细胞miR-106a-5p 的表达水平明显低于其对照细胞HepG2、HCCLM3,差异具有统计学意义(分别为t=13.59,P<0.001 和t=17.63,P<0.001);进一步分析CAV1 的表达水平,结果显示HepG2-SR 和HCCLM3-SR 细 胞CAV1 的mRNA相对表达水平明显增高,差异具有统计学意义(分别 为t=27.72,P<0.001 和t=27.58,P<0.001),CAV1 的蛋白水平明显高于其对照细胞HepG2、HCCLM3,差异具有统计学意义(分别t=30.40,P<0.001 和t=16.89,P<0.01),结果见图3。结果表明,HepG2-SR 和HCCLM3-SR 细胞中LINC00662的表达与miR-106a-5p 的表达之间存在负相关,而与CAV1 的表达存在正相关,提示LINC00662、miR-106a-5p 和CAV1 3 者之间的表达关系可能与索拉菲尼的耐药性相关。
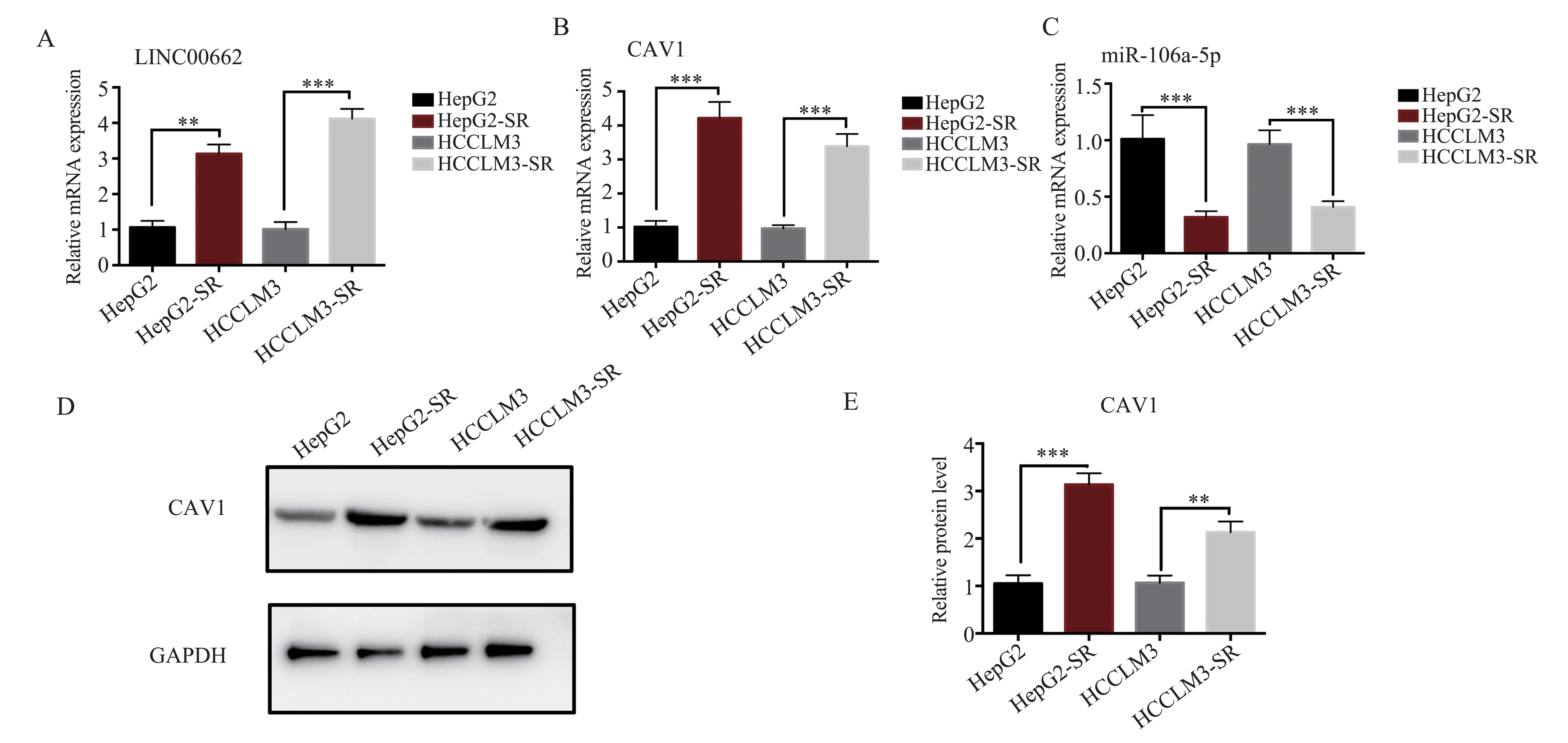
图3 HepG2、HCCLM3 及对应耐药株中各基因的表达情况Fig 3 Expression of each gene in HepG2,HCCLM3 and corresponding drug-resistant strains
2.4 抑制LINC00662 的表达可增加HCC-SR 对索拉非尼的敏感性
为了验证LINC00662 的作用,用siRNA 研究LINC00662 对miR-106a-5p 和CAV1 的表达以及肝癌细胞索拉菲尼耐药性的影响。结果显示,与si-NC 组 比 较,si-LINC00662 组HepG2-SR、HCCLM3-SR 细胞LINC00662 的表达明显降低,差异具有统计学意义(分别为t=30.02,P<0.01 和t=19.94,P<0.05),而miR-106a-5p 的表达明显增高,差 异 具 有 统 计 学 意 义(t=30.02,P<0.01 和t=19.94,P<0.05);对CAV1 表达的分析结果显示,si-LINC00662 组HepG2-SR、HCCLM3-SR 细 胞CAV1 蛋白表达明显低于其对照组,差异具有统计学意义(分别为t=31.06,P<0.01 和t=29.54,P<0.01),见 图4A、B、C;敲 低 LINC00662 的HepG2-SR 和HCCLM3-SR 细胞的索拉非尼IC50浓度 为(30.00±0.25)μmol/L、(24.00±0.14)μmol/L,低于其对照组,差异具有统计学意义(t=3.06,P<0.05 和t=2.14,P<0.05,),结果见图4D、E。结果提示,敲低LINC00662 可以导致CAV1 的表达降低,并能增加肝癌细胞对索拉菲尼的敏感性。
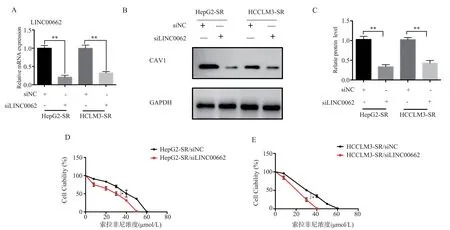
图4 siLINC00662 可增加HepG2-SR、HCCLM3-SR 细胞对索拉非尼的敏感性Fig 4 siLINC00662 increases the sensitivity of HepG2-SR and HCCLM3-SR cells to sorafenib
2.5 过表达miR-106a-5p 可以增加HCC-SR 对索拉非尼的敏感性
为了证实miR-106a-5p 的作用,研究miR-106a-5p 的表达对肝癌细胞索拉菲尼耐药性的影响。与对照组mimics-NC 相比,转染miR-106a-5p mimics的HepG2-SR、HCCLM3-SR 细 胞 中CAV1 蛋 白 表达水平降低,差异具有统计学意义(t=28.40,P<0.01 和t=28.59,P<0.01),见图5A、B、C,而且对索拉非尼的敏感性明显增高,达到IC50时索拉非尼的浓度为(29.00±0.15)μmol/L、(19.0±0.04)μmol/L,差异具有统计学意义(分别为t=2.41,P<0.05 和t=2.39,P<0.05,),结果见图5D、E。结果表明,miR-106a-5p 能够提高HCC-SR 对索拉非尼的敏感性。
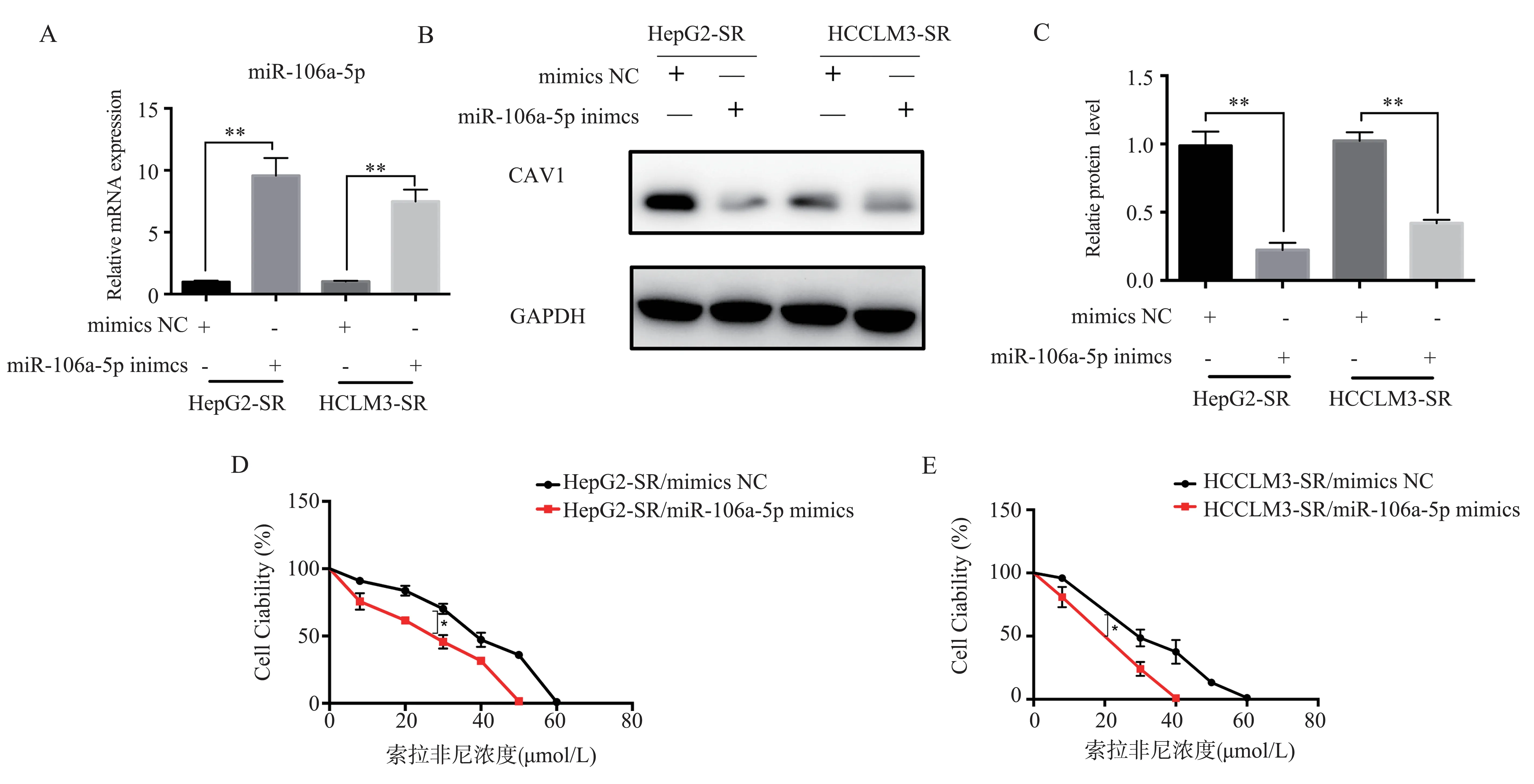
图5 过表达miR-106a-5p 可以增加HepG2-SR、HCCLM3-SR 对索拉非尼的敏感性Fig 5 Overexpression of miR-106a-5p increases the sensitivity of HepG2-SR,HCCLM3-SR to sorafenib
3 讨论
研究发现,LINC00662 在与肿瘤的发生、发展和治疗抵抗等方面有关[12]。其中,在胃癌、肺癌、乳腺癌、结直肠癌等多种癌症中LINC00662 的表达显着增高,并与这些肿瘤的不良预后显着相关[12,13]。同时,研究发现LINC00662 能与miR-497-5p/YAP1轴形成ceRNA 机制,促进胃癌细胞增殖与转移,更加剧了其对化疗药物的耐受性[14]。在本研究中,LINC00662 在肝癌索拉非尼耐药细胞(HCC-SR)中高表达,且干扰LINC00662 在HCC-SR 细胞中的表达可以增强其对索拉非尼的敏感性,提示LINC00662 的表达可能与肝癌细胞的索拉菲尼耐药性相关。
研究表明,LncRNA 可以通过ceRNAs 机制抑制miRNA 作用,LINC00662 具有致癌功能,作为ceRNA 在一些肿瘤的发生发展过程中中发挥致癌作 用[15,16]。为 了 探 讨LINC00662 的 表 达 与 肝 癌 细胞索拉菲尼耐药性的关系及其机制,本课题组通过生物信息预测LINC00662 的miRNA 结合位点,发现LINC00662 存在与miR-106a-5p 结合位点,双荧光素酶报告基因实验和 RT-qPCR 显示,LINC00662 对miR-106a-5p 具有靶向负调控作用,表明LINC00662 可能通过对miR-106a-5p 的负调控影响其靶mRNA 的表达。
miR-106a-5p 是miR-17 家族的成员。最近的研究表明,miR-106a-5p 在多种肿瘤中存在异常表达,既 可 以 作 为 癌 基 因[17,18],也 可 以 作 为 肿 瘤 抑 制 基因[19],与化疗的耐药性密切相关[20],但与肝细胞癌索拉菲尼耐药性之间的关系尚未清楚。本研究发现miR-106a-5p 在HCC-SR 中表达降低,过表达miR-106a-5p 可增加HCC-SR 对索拉非尼敏感性,且抑制细胞存活率。通过生物信息学网站预测发现miR-106a-5p 与CAV1 存在结合位点,提示miR-106a-5p 可能通过靶向CAV1 影响肝癌细胞对索拉菲尼敏感性。CAV1 是细胞膜上小窝的结构蛋白,是一种与内吞作用、细胞外基质组织、胆固醇分布、细胞信号转导相关的膜蛋白,也是肝功能的调节因子。CAV1 还具有致癌和抑癌的双重作用[21,22]。越 来 越 多 的 证 据 表 明,CAV1 的 高 表 达 可以促进一些癌症耐药性的发生,并与化疗反应较差相关[23]。本研究发现,HCC-SR 细胞中CAV1 表达升高,表明CAV1 的表达可能与肝细胞癌的耐药性相关。进一步通过双荧光素酶报告基因和Western Blot 实 验 发 现,HCC-SR 细 胞 中miR-106a-5p 的 表 达与CAV1 的表达呈负相关,而与HCC-SR 对索拉菲尼的敏感性呈正相关,表明miR-106a-5p 可以通过靶向抑制CAV1 的表达增加肝癌细胞对索拉菲尼的敏感性。
基于上述结果,本课题组推测LINC00662 通过ceRNA 机 制 抵 消miR-106a-5p 的 作 用,使CAV1 的表达增加,从而促进肝癌细胞产生索拉菲尼耐药性。因此,进一步用siRNA 技术敲低HCC-SR 细胞中LINC00062 的表达,观察敲低LINC00062 对肝癌细胞内miR-106a-5p、CAV1 的表达以及肝癌细胞对索拉菲尼敏感性的影响。结果显示,与对照组细胞相比,siLINC00062 组细胞中miR-106a-5p 表达量增高,而CAV1 表达量降低,对索拉菲尼的敏感性增加,提示LINC00662 通过ceRNA 机制抵消miR-106a-5p 的作用,促进CAV1 表达,进而抑制了HCC 细胞对索拉非尼的敏感性。
综上所述,本研究发现肝癌索拉非尼耐药细胞株(HCC-SR)中LINC00662、CAV1 表 达 增 加,miR-106a-5p 表达降低,抑制LINC00662 可增强HCC-SR 对索拉非尼的敏感性,其机制与调控miR-106a-5p/CAV1 轴有关,这个发现也为HCC 中LncRNA 参与耐药的调控机制提供了新的研究意义。
作者贡献度说明:
蔡望伟,陈柏岑:负责实验设计,实验指导,论文撰写及文章审校;肖曼,颜冬菁:对实验提供技术指导;陈彤,梁娜负责实验实施、指标检测、数据分析。
所有作者声明不存在利益冲突关系。



