高婷婷,王兆林,师增增,李雪峰,梁 立△,王 丽
1.中国人民解放军空军军医大学唐都医院妇产科,陕西西安 710038;2.西安医学院,陕西西安 710077
宫颈癌是全世界范围内发病率较高的女性恶性肿瘤,发病率高居世界女性恶性肿瘤第2位,仅次于乳腺癌[1]。我国宫颈癌患病人数占全世界患病人数的33%,病死人数占全世界因宫颈癌病死人数的11.30%,严重威胁女性的生命健康[2]。宫颈鳞状细胞癌是宫颈癌的主要发病类型,约占宫颈癌的95%,尽管目前医学技术飞速发展,但宫颈鳞状细胞癌的有效筛查及早期诊断情况仍不尽人意[3-4]。染色体结构维持蛋白4(SMC4)是染色体ATP酶超家族成员之一,近年研究发现,SMC4在宫颈癌组织中异常表达,认为SMC4过表达可通过激活NF-κB通路促进宫颈癌的发展[5]。细胞毒性T淋巴细胞相关抗原4(CTLA4)是存在于活化T及B淋巴细胞表面的一种跨膜蛋白,可介导T淋巴细胞增殖及分化过程,帮助肿瘤细胞脱离免疫监视,从而参与多种恶性肿瘤的发生及发展[6-7]。本研究观察分析了宫颈鳞状细胞癌组织中SMC4、CTLA4表达变化及其早期诊断价值,现报道如下。
1 资料与方法
1.1一般资料 选择2016年1月至2017年1月中国人民解放军空军军医大学唐都医院(以下简称本院)收治的112例早期宫颈鳞状细胞癌患者为观察组,其中国际妇产科联盟(FIGO)宫颈癌分期ⅠB1期69例(61.61%),ⅡA期43例(38.39%);有淋巴结转移42例(37.50%),无淋巴结转移70例(62.50%);肿瘤最大径<4 cm 62例(55.36%),肿瘤最大径≥4 cm 50例(44.64%);组织分化程度为低分化49例(43.75%),中高分化63例(56.25%)。(1)纳入标准:①所有患者均符合《妇产科学》[8]中宫颈鳞状细胞癌诊断标准,且经病理检查确诊;②首次诊断,FIGO分期为ⅠA~ⅡB期,既往未进行放化疗;③依从性良好,可配合检查及治疗。(2)排除标准:①重要器官存在严重功能障碍;②哺乳期或妊娠期女性;③合并宫颈相关疾病;④年龄>70岁。选择同期140例怀疑宫颈疾病于本院进行病理检查的女性为对照组,均排除宫颈癌。所有研究对象均签署知情同意书,本研究经本院医学伦理委员会批准。
1.2方法
1.2.1临床资料收集 收集各组受检者流产史、绝经情况、首次性交年龄、首次生育年龄、孕次、妇科疾病史、家族肿瘤史、饮酒、吸烟、年龄、民族、婚姻状态等临床资料。
1.2.2血清指标检测 采集两组受检者清晨空腹静脉血,3 000 r/min离心10 min,收集血清标本于—40 ℃低温冰箱中保存待测,避免反复冻融。采用罗氏Cobas 6000化学发光分析仪检测糖类抗原(CA)125、CA199、癌胚抗原(CEA)、人附睾蛋白-4(HE4)水平。
1.2.3免疫组化法检测SMC4及CTLA4 取各组受检者宫颈组织标本,10%甲醛固定后石蜡包埋,制成石蜡切片,厚度为4 μm,恒温箱烤片30 min,切片抗原修复,磷酸盐缓冲液(PBS)冲洗3次,3%过氧化氢滴加于切片中,室温下孵育15 min,PBS冲洗3次,山羊血清封闭30 min,滴加SMC4、CTLA4一抗(SMC4一抗购于上海优宁维生物科技股份有限公司,CTLA4一抗购于武汉博欧特生物科技有限公司),4 ℃恒温箱中孵育15 h,PBS冲洗3次,滴加辣根过氧化物酶标记的兔抗山羊IgG二抗(购于北京博尔西科技有限公司)室温孵育20 min,二氨基联苯胺(DAB)显色苏木素复染1 min,1%盐酸酒精分化,PBS水洗反蓝,脱水透明后封胶,显微镜下观察各组宫颈组织着色强度。高倍视野下判断染色强度及阳性率:不着色为0分,黄色为1分,棕黄色为2分,黄褐色为3分。阳性细胞率记分:0分为阳性细胞≤5%,1分为>5%~25%;2分为>25%~50%;3分为>50%~75%;4分为>75%。阴性为两种积分之和为0~1分,弱阳性为2分,阳性为3~4分,强阳性为5分及以上。0~2分为低表达,3分及以上为高表达。根据SMC4表达评分分为SMC4高表达组(SMC4表达评分≥3分)及SMC4低表达组(SMC4表达评分<3分),根据CTLA4表达评分分为CTLA4高表达组(CTLA4表达评分≥3分)及CTLA4低表达组(CTLA4表达评分<3分)。
1.2.4随访评估 通过电话及复诊随访所有宫颈鳞状细胞癌患者,随访日期截至2021年1月31日,记录并比较不同SMC4及CTLA4表达情况患者的生存周期。
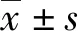
2 结 果
2.1两组各项检测指标及临床资料比较 与对照组比较,观察组宫颈组织SMC4及CTLA4表达评分、CA125、HE4、CA199、CEA水平明显升高,同时观察组有流产史、已绝经、首次性交年龄<20岁、首次生育年龄<20岁、孕次>5次、有妇科疾病史患者比例均明显升高,差异有统计学意义(P<0.05)。见表1。SMC4及CTLA4免疫组化染色结果见图1、2。
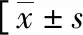
表1 两组各项检测指标及临床资料比较或n(%)]
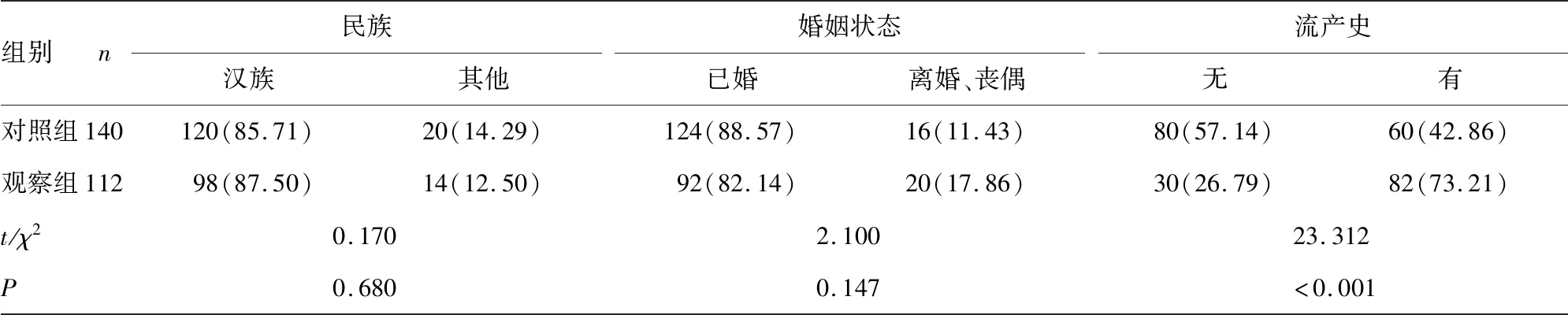
组别n民族汉族其他婚姻状态已婚离婚、丧偶流产史无有对照组140120(85.71)20(14.29)124(88.57)16(11.43)80(57.14)60(42.86)观察组11298(87.50)14(12.50)92(82.14)20(17.86)30(26.79)82(73.21)t/χ20.1702.10023.312P0.6800.147<0.001
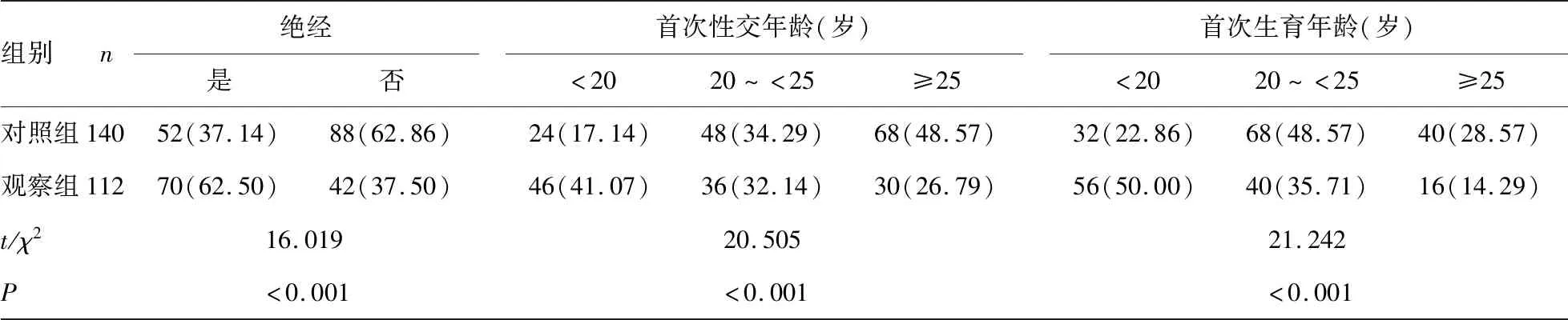
组别n绝经是否首次性交年龄(岁)<2020~<25≥25首次生育年龄(岁)<2020~<25≥25对照组14052(37.14)88(62.86)24(17.14)48(34.29)68(48.57)32(22.86)68(48.57)40(28.57)观察组11270(62.50)42(37.50)46(41.07)36(32.14)30(26.79)56(50.00)40(35.71)16(14.29)t/χ216.01920.50521.242P<0.001<0.001<0.001
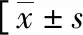
续表1 两组各项检测指标及临床资料比较或n(%)]
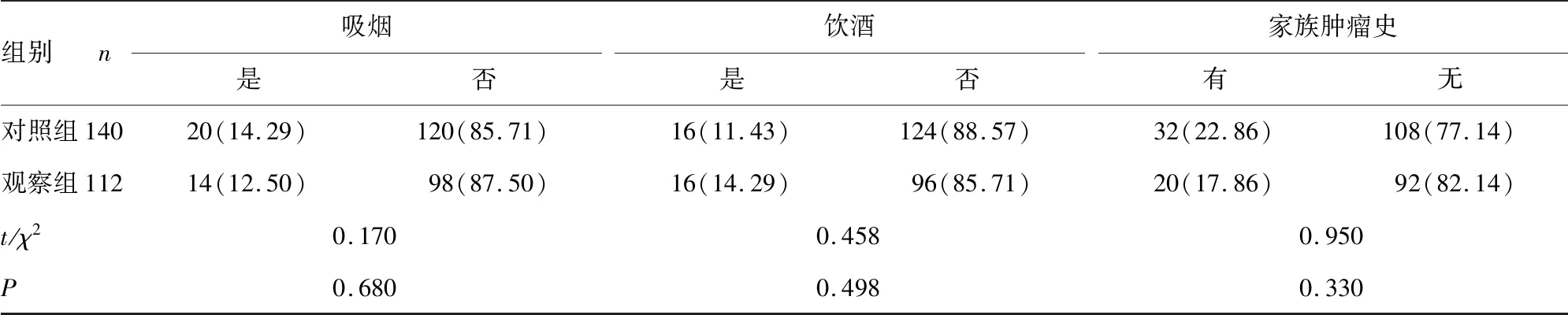
组别n吸烟是否饮酒是否家族肿瘤史有无对照组14020(14.29)120(85.71)16(11.43)124(88.57)32(22.86)108(77.14)观察组11214(12.50)98(87.50)16(14.29)96(85.71)20(17.86)92(82.14)t/χ20.1700.4580.950P0.6800.4980.330
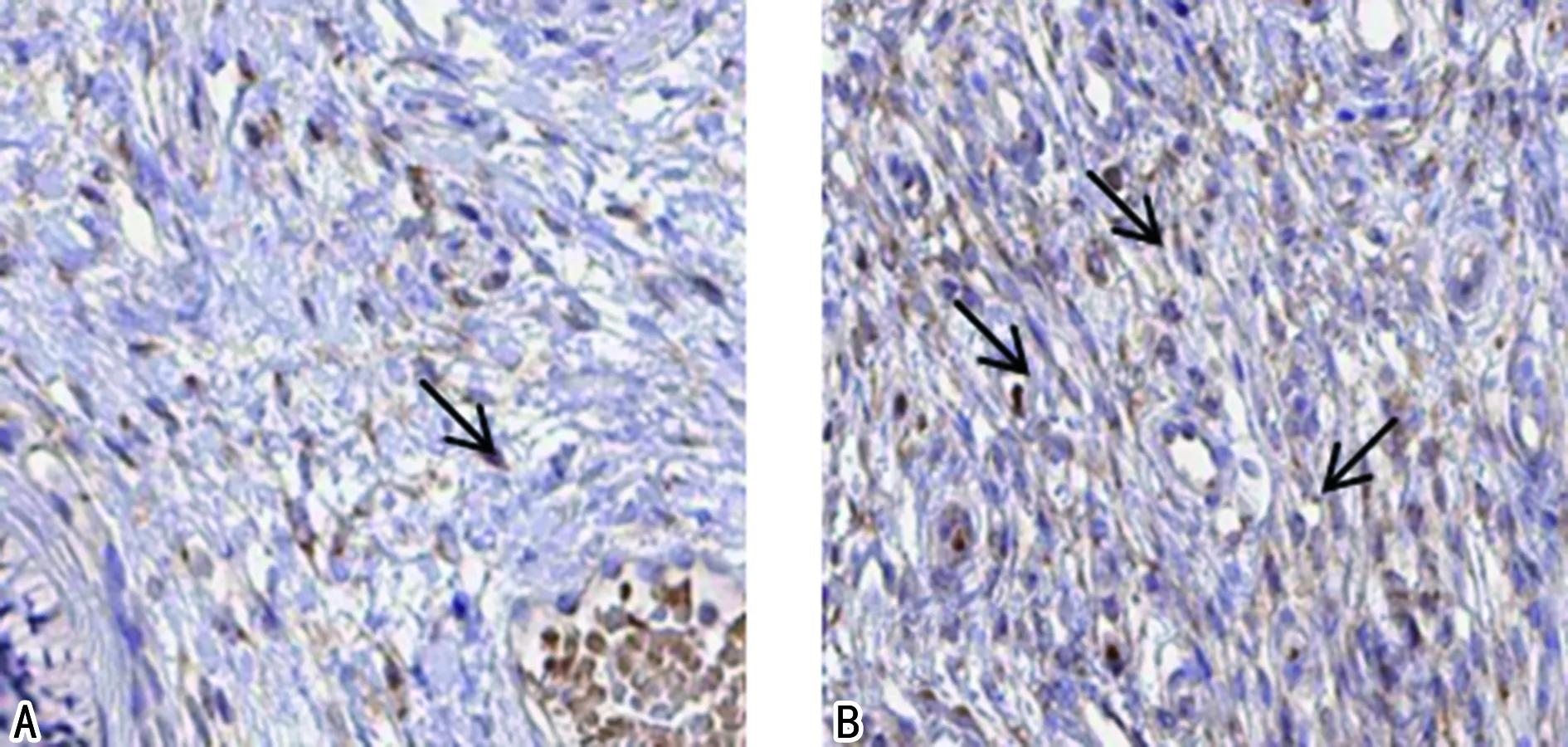
注:A为对照组宫颈组织SMC4免疫组化染色图片;B为观察组宫颈组织SMC4免疫组化染色图片。
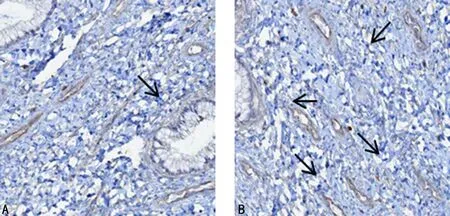
注:A为对照组宫颈组织CTLA4免疫组化染色图片;B为观察组宫颈组织CTLA4免疫组化染色图片。
2.2影响宫颈鳞状细胞癌发生的危险因素分析 多因素Logistic回归分析发现,SMC4高表达、CTLA4高表达、有流产史、已绝经、首次性交年龄<20岁、首次生育年龄<20岁、孕次>5次、有妇科疾病史,以及CA125、HE4、CA199、CEA水平升高均为宫颈鳞状细胞癌发生的危险因素(P<0.05)。见表2。
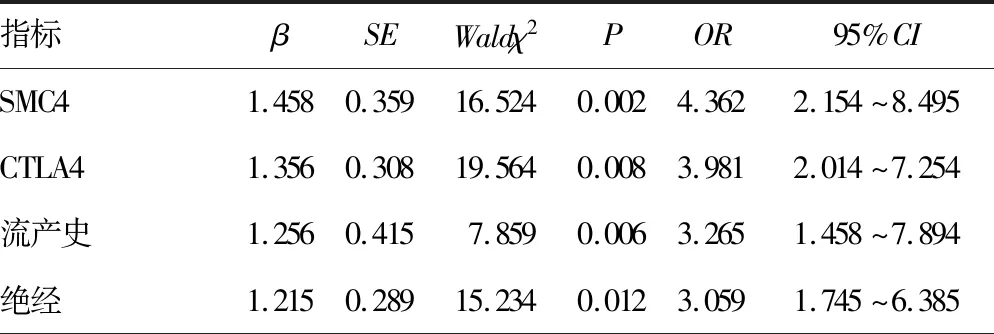
表2 影响宫颈鳞状细胞癌发生的危险因素分析
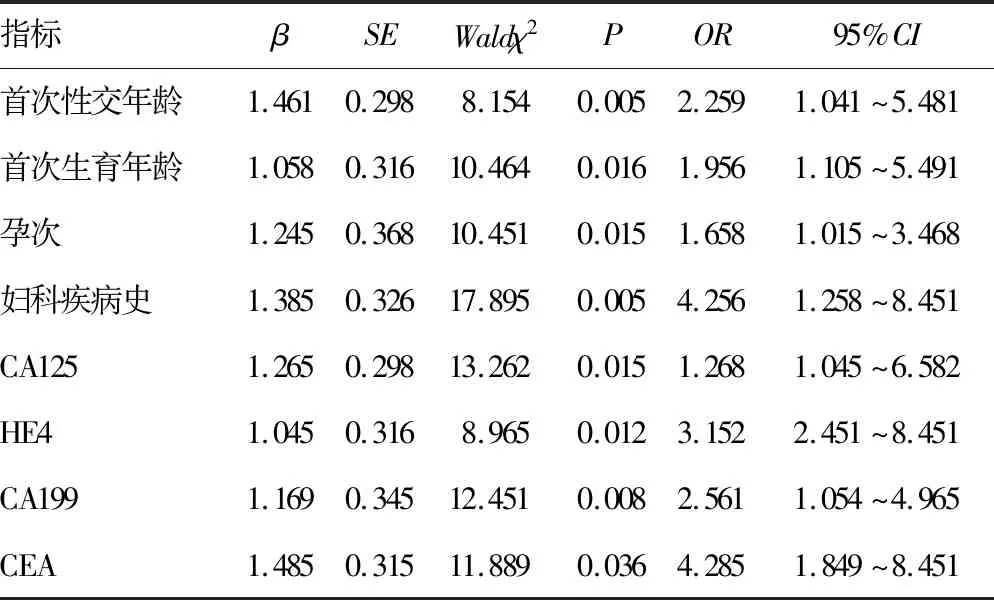
续表2 影响宫颈鳞状细胞癌发生的危险因素分析
2.3不同SMC4、CTLA4表达情况患者生存曲线分析 56例宫颈鳞状细胞癌患者成功随访,平均随访时间为34个月(5~60个月),Kaplan-Meier生存曲线分析结果显示,SMC4高表达患者(26例)总生存率为61.54%(16/26),明显低于SMC4低表达患者(30例)的80.00%(24/30),差异有统计学意义(P<0.05)。CTLA4高表达患者(28例)的总生存率为60.71%(17/28),明显低于CTLA4低表达患者(28例)的82.14%(23/28),差异有统计学意义(P<0.05)。见图3。
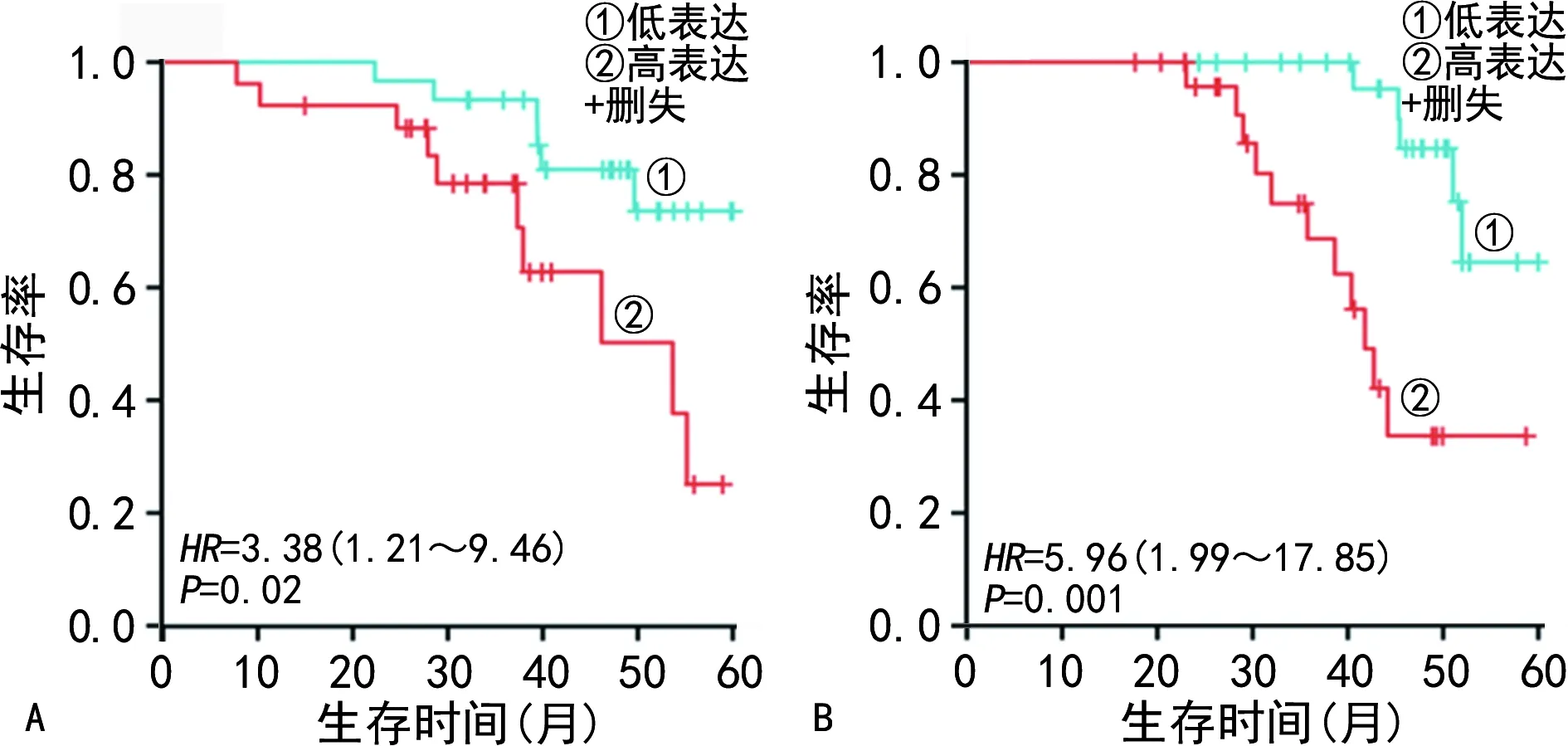
注:A为不同SMC4表达情况患者生存曲线;B为不同CTLA4表达情况患者生存曲线。
2.4SMC4、CTLA4诊断宫颈鳞状细胞癌的价值分析 ROC曲线分析发现,SMC4、CTLA4诊断宫颈鳞状细胞癌的AUC分别为0.715、0.752,SMC4+CTLA4诊断宫颈鳞状细胞癌的AUC为0.875,二者联合诊断宫颈鳞状细胞癌的AUC明显大于SMC4、CTLA4单独检测(Z=5.714、3.075,P<0.05)。见表3、图4。
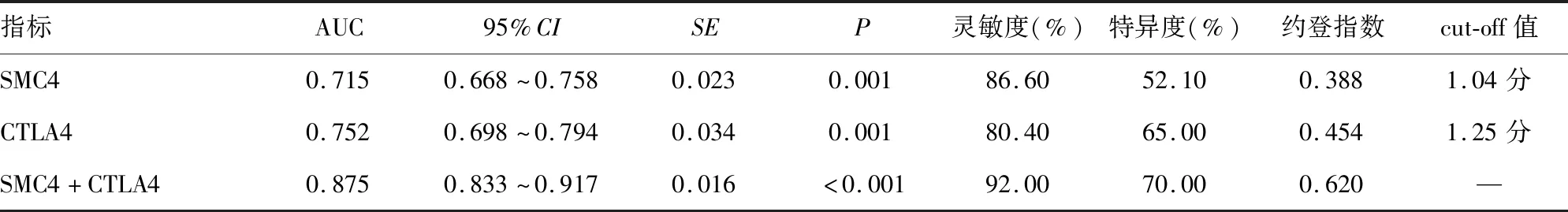
表3 SMC4、CTLA4诊断宫颈鳞状细胞癌的价值分析
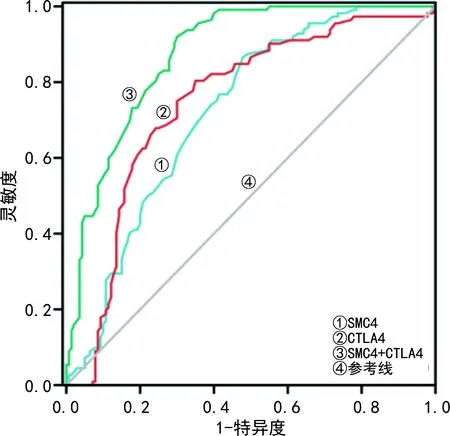
图4 SMC4、CTLA4诊断宫颈鳞状细胞癌的ROC曲线
3 讨 论
宫颈鳞状细胞癌是全世界范围内常见的女性恶性肿瘤,近年统计发现,全世界每年有50万人确诊为宫颈鳞状细胞癌,其中发展中国家的人数占90%以上[9]。随着近年生活节奏的加快及生活压力的增加,宫颈鳞状细胞癌患病率不断增加,且呈现年轻化趋势,成为医学界关注的焦点。目前,临床治疗宫颈鳞状细胞癌的主要方式为手术治疗,但由于宫颈鳞状细胞癌早期症状不典型,多数患者确诊时已处于中晚期,耽误手术治疗的最佳时机,预后情况较差[10-11],因此,寻找有效筛查及早期诊断宫颈鳞状细胞癌的方法成为妇科领域关注热点。
SMC4是近年研究恶性肿瘤的常见因子,可通过调控染色体的聚合及分离过程介导肿瘤细胞的增殖及迁移过程[12-13]。目前研究发现SMC4在乳腺癌、肝癌、胰腺癌、结肠癌等多种恶性肿瘤组织中呈明显高表达,具有一定致癌性,通过参与肿瘤细胞的增殖、侵袭及转移过程促进肿瘤的发展[14]。宿主免疫系统变化影响着肿瘤的发生及发展进程,CTLA4作为一种跨膜蛋白,可通过调节T淋巴细胞的增殖及活化过程抑制机体的免疫应答,促进肿瘤细胞的转移及侵袭。目前研究发现,CTLA4在胆管癌、乳腺癌及鼻咽癌等多种恶性肿瘤中明显高表达,且其水平越高,患者预后情况越差[15-16]。近年研究发现,CTLA4在宫颈癌中呈异常表达状态,可能参与宫颈癌的发生及发展[17]。本研究结果显示,与对照组比较,观察组宫颈组织SMC4、CTLA4表达评分明显升高。这提示SMC4、CTLA4的表达可能与宫颈鳞状细胞癌的发生及发展存在密切联系,与林瑶等[18]研究中SMC4作为促癌基因促进宫颈鳞状细胞癌的发生的结论相近。究其原因,可能与SMC4通过介导染色体形态变化调控肿瘤细胞的增殖过程有关。同时本研究采用多因素Logistic回归分析发现,SMC4高表达、CTLA4高表达、有流产史、已绝经、首次性交年龄<20岁等因素为影响宫颈鳞状细胞癌发生的危险因素。Kaplan-Meier生存曲线分析发现,SMC4高表达患者总生存率明显低于SMC4低表达患者,CTLA4高表达患者总生存率明显低于CTLA4低表达患者。由此说明,SMC4、CTLA4两指标的高表达与宫颈鳞状细胞癌发生及预后情况密切相关。进一步分析SMC4、CTLA4在早期诊断宫颈鳞状细胞癌中的价值,发现SMC4、CTLA4诊断宫颈鳞状细胞癌的AUC分别为0.715、0.752,二者联合诊断宫颈鳞状细胞癌的AUC为0.875。这提示SMC4、CTLA4在诊断宫颈鳞状细胞癌方面具有一定价值,其中相较于单一指标,二者联合诊断价值更高,有助于宫颈鳞状细胞癌的有效筛查及早期诊断,改善患者预后。
综上所述,SMC4、CTLA4在宫颈鳞状细胞癌中表达明显上调,可能参与宫颈鳞状细胞癌的发生及发展过程,可作为宫颈鳞状细胞癌的早期诊断生物学标志物,二者水平升高可能预示着预后不良。



