张 睿,李 岚,周欢欢,辛天芳,朱正鹏
湖北医药学院附属国药东风总医院病理科,湖北十堰 442008
宫颈癌是最常见的妇科恶性肿瘤,其发病率和病死率都在逐年上升,且越来越趋于年轻化。2020年国际癌症研究机构最新数据显示,全球新增癌症患者1 930万,死亡人数超过995万,宫颈癌的发病率及病死率分别为3.1%及3.4%,在女性癌症中发病率及病死率排名仅次于乳腺癌[1],该病仍然是女性生命健康的一大杀手。研究数据显示,非洲地区宫颈癌的发病率及病死率均居世界第1,发病率是北美、澳大利亚、新西兰及西亚地区的7~10倍,病死率则高达18倍,高度贫困地区女性宫颈癌的发病率及病死率均远远高于低度贫困地区[2]。高迁移率族蛋白B1(HMGB1)属于高迁移率族蛋白家族成员,是一种非组蛋白染色体蛋白,也是一种具有双重功能的丰富核蛋白,在细胞核内作为一种DNA结合蛋白,在DNA复制、重组、转录及修复过程中发挥重要作用,在细胞外介导炎症反应、免疫应答、组织修复、肿瘤生长等一系列的病理生理过程[3]。HMGB1诱导的细胞信号传导与多种疾病的发生机制有关,包括癌症、败血症、类风湿关节炎、脑卒中和动脉粥样硬化[4]。HMGB1在结直肠癌、胰腺癌、肝细胞癌、头颈部鳞状细胞癌、胃癌等多种癌症中高表达,并且被认为与肿瘤的发生、浸润、转移及患者预后显着相关[5],有望成为恶性肿瘤治疗的新靶标。宫颈癌预后较差,一般被发现时病程已经较晚,且极易发生转移,因此寻找新的有效靶标显得尤为迫切。尽管已有很多报道阐述了HMGB1在宫颈癌中的作用,但尚缺乏确切的循证医学证据,本研究应用Meta分析方法,归纳总结HMGB1在宫颈癌中的表达特点及临床意义,以及与肿瘤各临床病理参数的关系,以期为宫颈癌的治疗提供循证医学指导。
1 资料与方法
1.1文献检索策略 检索维普中文科技期刊全文(VIP)数据库、中国期刊网全文(CNKI)数据库、万方数据库、中国生物医学文献(CBM)数据库和Pubmed、Embase、Cochrane、Web of Science数据库。收集公开发表的关于HMGB1表达与宫颈癌关联的文献资料。检索中使用的中文关键词包括:宫颈癌、宫颈肿瘤、高迁移率族蛋白B1、HMGB1;使用的英文主题词包括:Uterine Cervical Neoplasms、 HMGB1,并查找其所有自由词一起进行文献检索,搜集所有相关文献。
1.2文献资料纳入和排除标准 (1)纳入标准:①文献仅限于国内外公开发表的关于HMGB1在宫颈癌中表达的临床意义相关的病例对照研究,语种包括中文和英文;②研究对象为病理诊断明确的宫颈癌患者,其种族、国籍和病程等不限;③对照组明确,且文中报告数据完整,或可正确推导出相关试验数据;④当多篇文献数据相同或者重叠时,纳入数据量最大或最新发表的文献;⑤检测方法为免疫组化法。(2)排除标准:①样本量≤30例的文献;②综述、系统评价、会议报告等文献;③细胞或动物实验;④没有明确设置对照组的文献; ⑤无法获取全文或数据的文献;⑥同批标本重复报道的文献。
1.3数据提取及文献质量评价 由2位评价者独立根据预先制订好的纳入和排除标准筛选文献,按设计好的表格提取纳入研究的患者信息、肿瘤临床分期、淋巴结转移、肿瘤分化程度、肿瘤最大径、浸润深度等数据作为统计指标,纳入文献根据纽卡斯尔-渥太华量表(NOS)进行质量评价[6],分别从“selection”“comparability”“exposure”3个方面给每一个独立研究打☆,满分为9颗☆,剔除<6颗☆的研究。
1.4统计学处理 采用STATA14.0软件进行数据分析,使用比值比(OR)和95%置信区间( 95%CI) 进行合并分析,评估HMGB1在宫颈癌中的表达特点和临床意义。通过Q检验及I2检验判断研究结果之间的异质性,当P≥0.1且I2≤50%时,说明研究结果之间不存在异质性或异质性较小,采用固定效应合并效应量,反之则采用随机效应进行数据分析。采用STATA14.0软件进行敏感性分析,并采用Egger′s 检验和Begg′s漏斗图进行发表偏倚检测并绘制Begg′s漏斗图检测是否存在发表偏倚。
2 结 果
2.1文献检索结果 本研究从中文及英文数据库中共检索到文献438篇,排除重复文献233篇,通过阅读题目和摘要排除综述、系统评价等文献10篇,并剔除内容不符合文献155篇,初筛得到40篇文献,通读全文复筛后确定纳入研究25篇,其中中文22篇[7-28],英文3篇[29-31](图1)。纳入的25篇文献的基本信息及质量评价情况见表1。
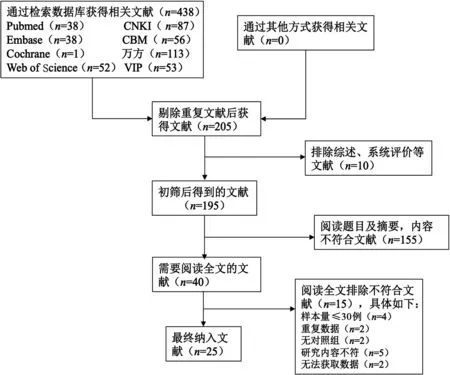
图1 文献检索流程
2.2宫颈癌组与对照组中HMGB1表达情况 本研究共纳入25篇文献,均采用免疫组化法检测并比较癌组织与对照组织中HMGB1的阳性率差异,异质性检验结果显示I2=62.9%,Q检验P<0.001,故采用随机效应合并效应量。25篇文献合并OR=35.936,95%CI:22.861~56.490,P<0.001(表2),表明HMGB1在宫颈癌组织中的阳性率远高于癌旁或正常宫颈组织,差异有统计学意义(P<0.001)。
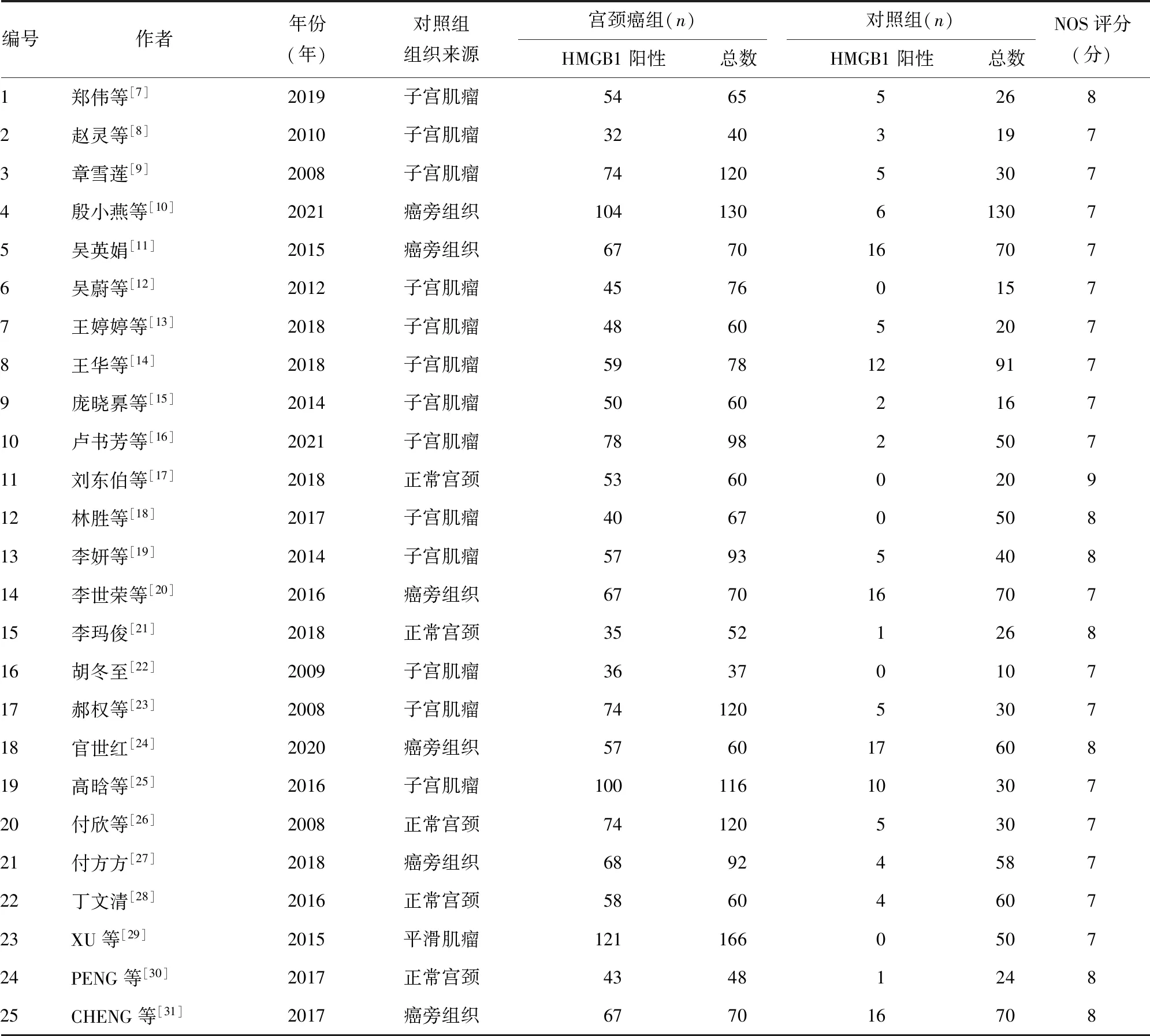
表1 纳入文献基本信息及质量评价情况
2.3HMGB1表达与临床分期的关系 纳入的25篇文献中涉及国际妇产科联盟(FIGO)临床分期的共有15项[8-10,12-16,18,22,25,27,29-31],分为Ⅰ期和Ⅱ期,异质性检验结果显示I2=0.0%,Q检验P=0.730,故采用固定效应合并效应量,合并OR=2.993,95%CI:2.202~4.068,P<0.001(表2),表明临床分期为Ⅱ期宫颈癌组织HMGB1阳性率为Ⅰ期宫颈癌组织的2.993倍,差异有统计学意义(P<0.001)。
2.4HMGB1表达与淋巴结转移的关系 纳入的25篇文献中涉及HMGB1表达在淋巴结转移与无淋巴结转移组织中表达差异的研究共有17项[8-10,12-16,18,22,23,25-27,29-31],异质性检验结果显示I2=0.0%,Q检验P=0.866,故采用固定效应合并效应量,合并OR=4.379,95%CI:3.091~6.205,P=0.001(表2),表明有淋巴结转移患者的HMGB1阳性率为无淋巴结转移患者的4.379倍,差异有统计学意义(P=0.001)。
2.5HMGB1表达与肿瘤分化程度的关系 纳入的25篇文献中涉及HMGB1在肿瘤不同分化程度的表达差异的研究共有17项[8-18,22-23,25-26,30-31],分为高中分化组及低分化组,异质性检验结果显示I2=16.0%,Q检验P=0.270,故采用固定效应合并效应量。合并OR=1.965,95%CI:1.455~2.654,P<0.001(表2),提示HMGB1在低分化宫颈癌组织中的阳性率是高中分化宫颈癌组织的1.965倍,差异有统计学意义(P<0.001)。
2.6HMGB1表达与肿瘤浸润深度的关系 纳入的25篇文献中涉及HMGB1在肌层不同浸润深度的表达差异的研究共有3项[10,14,22],分为浸润深度≤1/2肌层及> 1/2肌层,异质性检验结果显示I2=0.0%,Q检验P=0.970,故采用固定效应合并效应量,合并OR=3.086,95%CI:1.482~6.428,P=0.003(表2),提示肿瘤浸润深度>1/2肌层宫颈癌组织HMGB1的阳性率是浸润深度≤1/2肌层宫颈癌组织的3.086倍,差异有统计学意义(P=0.003)。
2.7HMGB1表达与肿瘤最大径的关系 纳入的25项研究中涉及HMGB1表达在不同肿瘤最大径表达差异的研究有7项,排除2例分界值分别为3 cm及5 cm的研究,剩余5篇[12,14,25-26,29]分为肿瘤最大径≤4 cm和>4 cm,异质性检验结果显示I2=75.6%,Q检验P=0.003,故采用随机效应合并效应量,合并OR=1.097,95%CI:0.469~2.571,P=0.830(表2),表明HMGB1在不同肿瘤最大径宫颈癌组织中的HMGB1阳性率比较,差异无统计学意义(P=0.830)。
2.8敏感性分析 敏感性分析结果显示,无论删除哪一项研究,结果稳定,均在95%CI之内(图2);采用Egger′s 检验和Begg′s漏斗图进行发表偏倚检测,Egger′s 检验的P=0.005,得到的漏斗图有轻微不对称,表明存在一定的发表偏倚,经剪补法分析得到对称的漏斗图(图3)。
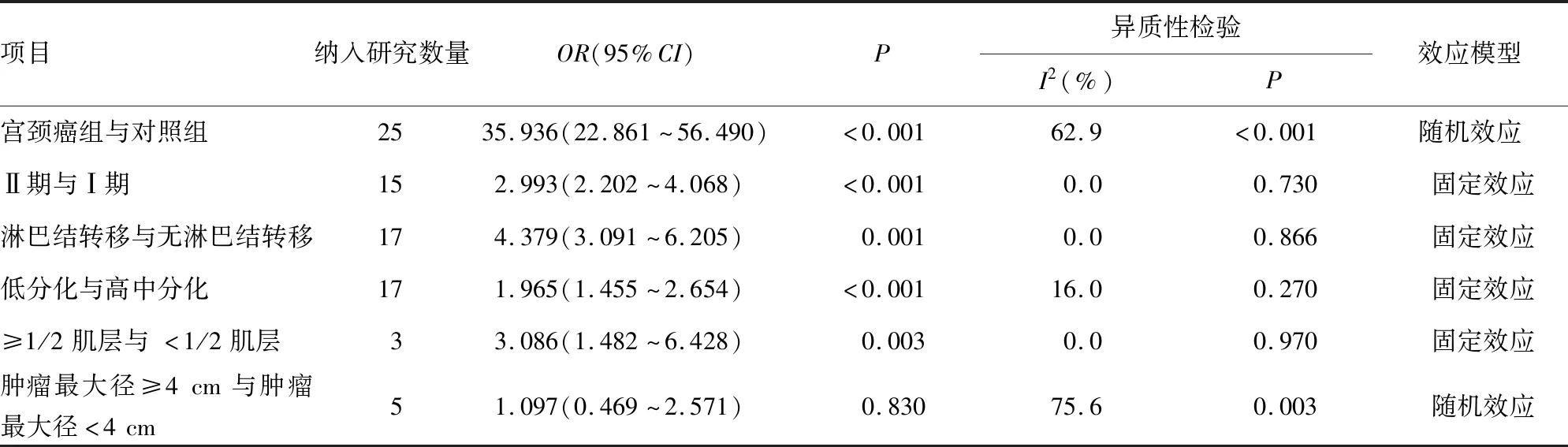
表2 HMGB1表达与宫颈癌患者临床病理特征关系的Meta分析结果
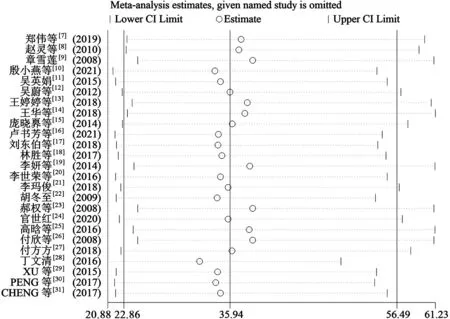
图2 HMGB1在宫颈癌组织与正常宫颈组织中表达差异的敏感性分析
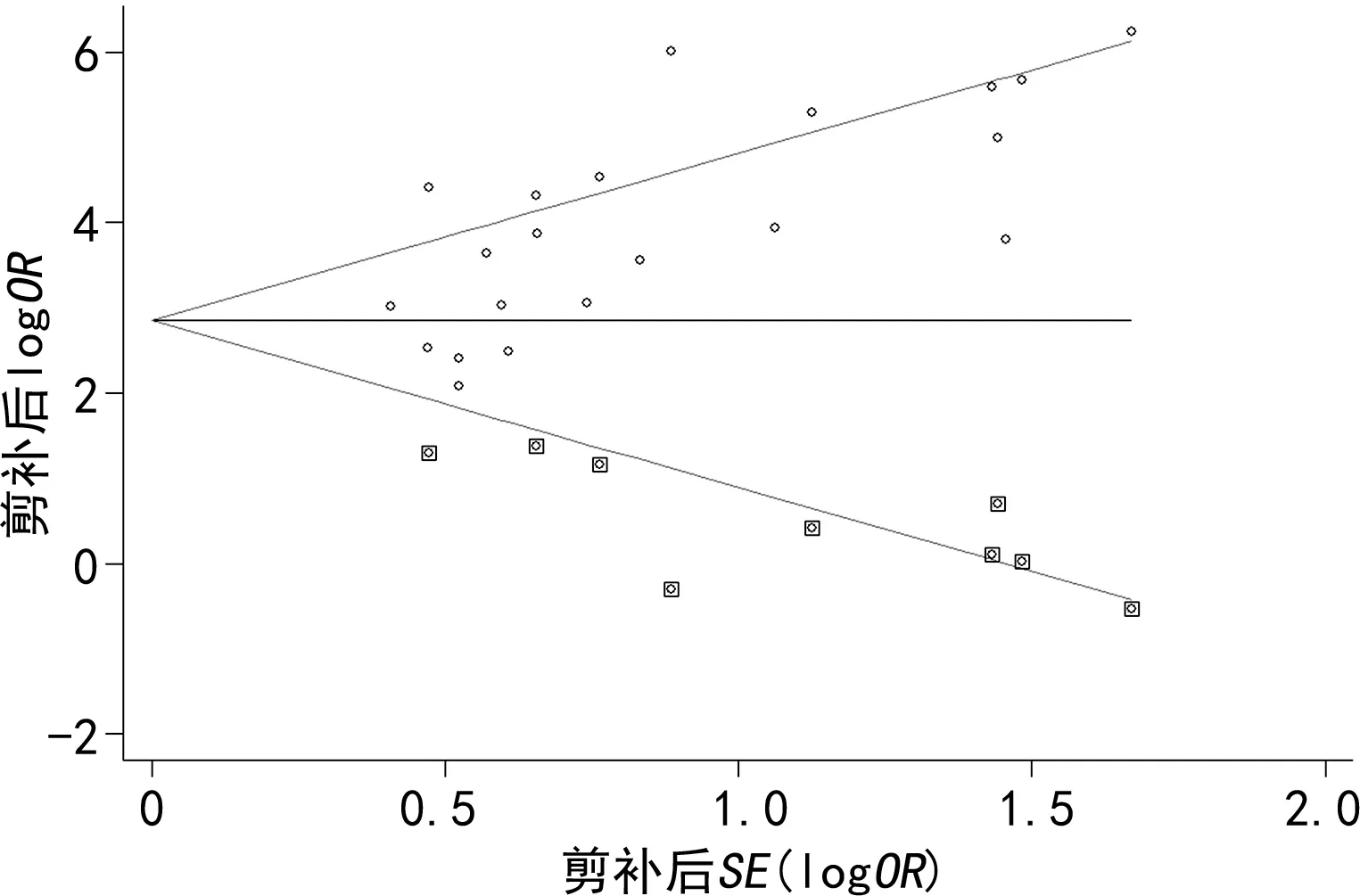
图3 HMGB1在宫颈癌组织与正常宫颈组织中表达差异的漏斗图
3 讨 论
HMGB1在1973年被首次发现,由215个氨基酸组成,由于其在聚丙烯酰胺凝胶电泳中迁移率较高而得名[32]。HMGB1在进化过程中高度保守,人与其他哺乳动物HMGB1同源性高达98%,而人HMGB1与小鼠的氨基酸序列仅有C末端最后一个氨基酸不同。作为一种DNA结合蛋白,HMGB1在结构上可以分为3个不同的结构域:两个串联的HMG盒结构域-两个不同的同源性DNA结合区A盒、B盒,一个含有30个氨基酸的酸性C末端。HMG盒在进化过程中保持着良好的保守性,始终保持L型的3个α-螺旋[33]。A盒是受体结合位点但不发挥生物学功能,B盒主要发挥细胞因子的活性作用,是其发挥促炎症效应的关键结构,而C末端则介导并调节HMGB1与DNA的结合[34]。随着研究的深入,研究者认为HMGB1与肿瘤生长及发展的10种功能有关,包括维持增殖信号、躲避生长抑制剂、保护免疫应答、确保复制过程持续进行、促肿瘤炎症、激活侵袭和转移、诱导血管生成、致基因组不稳定和突变、抗细胞死亡、细胞能量学调控紊乱[35]。HMGB1参与癌症进展的过程非常复杂,可以通过促进细胞迁移、调节细胞的黏附特性及修饰细胞外基质成分直接参与肿瘤细胞转移,而在某些情况下通过增强NF-κB P65等的活性,以间接方式促进肿瘤细胞侵袭和迁移[36]。因此,HMGB1不一定非得由肿瘤细胞分泌才能增强其侵袭和转移潜能。新血管生成是肿瘤生长和发展过程的限速步骤,而HMGB1作为一种细胞因子能够促进炎症反应及新血管生成。
本研究综合分析了25篇文献,发现HMGB1在宫颈癌组织中的阳性率约为正常宫颈组织的35.936倍(95%CI:22.861~56.490,P<0.001),并且不同临床分期、淋巴结转移、分化程度及肿瘤浸润深度患者的癌组织中的HMGB1阳性率比较,差异均有统计学意义(P<0.05),而不同肿瘤最大径患者的癌组织中的HMGB1阳性率比较,差异无统计学意义(P>0.05)。与其他恶性肿瘤相比,宫颈癌预防性较好,通过注射人乳头瘤病毒(HPV)疫苗可以有效预防宫颈癌的发生,但由于费用问题,并不能做到普遍接种HPV疫苗,尤其是贫困地区。很多地区医疗条件差,体检意识较差,患者确诊为宫颈癌时可能已经发展到中晚期,放化疗的效果并不理想,5年生存率较低。宫颈癌组织HMGB1阴性患者的5年生存率在94%以上,但HMGB1阳性患者的5年生存率仅为61%[14,19]。另外,体外细胞实验显示HMGB1可能通过调控宫颈癌细胞内自噬的水平,影响其对顺铂类药物的敏感性[37]。综上所述,HMGB1在宫颈癌组织中表达情况对宫颈癌的生物学行为有重要影响,有望成为判定宫颈癌侵袭、转移、耐药及预后的重要标志物。
敏感性分析结果显示,无论剔除哪一项研究,汇总结果均稳定;通过绘制Begg′s漏斗图,发现漏斗图稍微不对称,Egger′s 检验的P<0.05,表示本研究存在一定的发表偏倚,但是偏倚不大,在可接受范围内。造成有一定发表偏倚的原因可能包括:(1)虽进行了全面检索,但纳入研究的研究对象全为中国人群,群体结构较为单一,缺乏多中心、多区域的研究。(2)所纳入的研究均是采用免疫组化法定性检测组织中HMGB1表达水平,受试验条件、试剂及操作人员技术影响较大,且判读人员的标准可能不统一。(3)样本量不足,且纳入的25篇文献中有多篇文献数据的对照组样本量较小。
综上所述,HMGB1高表达可能是宫颈癌发生、发展的重要影响因素,但潜在的作用机制尚不清楚,其与各临床病理参数关联性的内部机制还需要更多的基础研究来探索。为进一步将HMGB1运用于临床,并将其作为宫颈癌早期诊断、判断预后的指标及肿瘤治疗的靶点,还需要更多大样本的临床研究来证实。



