龙春兰,周 宇,易 勤,谭 彬,许 皓,魏光辉,朱 静△
1.国家儿童健康与疾病临床医学研究中心,重庆400014; 2.扬州大学附属淮安市妇幼保健院儿童康复科,江苏淮安 223001;3.儿童发育疾病研究教育部重点实验室,重庆400014;4.儿科学重庆市重点实验室,重庆400014;5.重庆医科大学附属儿童医院检验科,重庆400014;6.重庆医科大学附属儿童医院泌尿外科,重庆 400014
Prdm14在早期多能性细胞、原始生殖细胞(PGCs)以及胚胎干细胞(ESCs)中表达,具有维持细胞干性和抑制细胞分化的效应[4-5]。ESCs中,多能性主要由转录因子Oct4、Sox2和Nanog等构成的核心转录调控网络来维持[6]。全基因组定位分析显示,Prdm14与Oct4、Nanog、Sox2等其他关键转录因子广泛共定位,表明Prdm14已整合到核心转录调控网络中[7-8]。在PGCs 发育过程中,重获多向分化潜能是PGCs命运决定的重要调控事件之一,而Prdm14是PGCs 能否重新获得多向分化潜能的关键调控因子。在PGCs 中,Prdm14与Tfap2c和Blimp1协同作用,上调生殖细胞和多能性基因,同时抑制WNT信号和体细胞标记物[9]。Prdm14的表达随着 PGCs 分化而受到抑制,在一定条件下,来源于Prdm14+/+胚胎的PGCs 能够去分化形成多能性的胚胎生殖细胞,而Prdm14-/-胚胎的原始生殖样细胞(PGCLCs)几乎不能形成胚胎生殖细胞样克隆,并且Prdm14-/-的PGCLCs中,其核心多能性基因及生殖细胞相关基因未能重新激活[10]。
Prdm14也有助于在缺乏多向分化潜能的细胞中诱导多能性。研究显示,当 Prdm14 与 Oct4、Sox2、Klf4 共同表达时能够提高成纤维细胞的重编程效率[7]。与植入后的外胚层和ESCs相比,外胚层干细胞(EpiSC)不表达Prdm14,并且不具备向PGCs特化的潜能,外源性Prdm14能与Klf2协同作用,加速和促进小鼠EpiSCs向幼稚多能状态的ESCs逆转及向PGC特化[11-12]。
Prdm14可通过干性因子等构成的转录调控网络来调节ESCs、生殖细胞的多能性,然而,Prdm14在其他细胞中的表达及作用如何,尚不清楚。因此,本研究拟探讨Prdm14对C3H10T1/2细胞增殖及干性的影响。
1 材料与方法
1.1材料 C3H10T1/2细胞(中国科学院细胞库)。
1.2仪器与试剂 CO2恒温培养箱(美国 Thermo公司),荧光定量PCR仪(美国 Bio-Rad公司),凝胶成像仪(美国 Bio-Rad公司),倒置荧光显微成像系统(日本 Nikon公司),柱式RNA提取试剂盒、反转录试剂盒及荧光定量PCR试剂盒[宝生物工程(大连)有限公司],过表达Prdm14慢病毒(上海吉凯基因化学技术有限公司),胎牛血清、DMEM/F12培养基(美国Gibco公司),胰蛋白酶(美国Sigma公司),RIPA裂解液(上海碧云天生物技术有限公司),兔抗Prdm14 抗体(Abcam公司,批号:187881),兔抗Sox2抗体(ProteinTec公司,批号:11064-1-AP),兔抗Oct4抗体(ProteinTec公司,批号:11263-1-AP),兔抗Nanog抗体(Zenbio公司,批号:385080),小鼠抗β-actin、山羊抗兔二抗、山羊抗小鼠二抗、Cy3山羊抗兔二抗、Cy3山羊抗小鼠二抗(北京中杉金桥生物技术有限公司)、Hoechst 33342(上海碧云天生物技术有限公司)。
1.3方法
1.3.1细胞培养 取生长良好的对数期C3H10T1/2细胞,消化传代后,补充新鲜完全培养基(含10%胎牛血清)至10 mL,晃动培养皿,使细胞均匀分布,于37 ℃、5%CO2恒温细胞培养箱中培养。
1.3.2构建Prdm14过表达细胞株 本研究选用Tet-on可诱导基因表达慢病毒系统,可在目的细胞中获得可灵敏调控的目的基因表达。在细胞培养基中不含多西环素(Dox)时,目的基因本底表达量极低,加入Dox后,目的基因诱导表达量极高。载体信息如下: 基因名称为Prdm14(NM_001081209),载体名称为CV259,元件顺序为 TetIIP-MCS-3FLAG-CMV-EGFP-Ubi-TetR-IRES-Puromyc。本实验分为空白组(正常C3H10T1/2)、阴性对照组(感染慢病毒空载体的C3H10T1/2)以及实验组(感染Prdm14慢病毒的C3H10T1/2)。
基于对青少年自我价值感及道德判断能力与价值观关系的研究,在自我价值感中,自我观与人际情感之间具有正向关系,其他则为负向。换言之,自我观越重的学生,其自我价值感越强,并以此更加关注自身的成长,形成良性循环。与此同时,群体观与自我价值感却存在着互相关联,自我观强导致群体观低、人际价值感高。
按2×104个细胞/孔于无菌6孔板中均匀接种细胞,培养12 h后,加入适量病毒,感染24 h后更换为完全培养基,继续培养48 h,倒置荧光显微镜下观察荧光蛋白表达情况,以确定慢病毒是否感染成功。嘌呤霉素筛选后,经Dox诱导48 h,收集细胞用作后续检测。
1.3.3实时荧光定量PCR(RT-qPCR)检测Prdm14 mRNA表达 参考RNA柱式提取试剂盒说明书,提取总RNA进行反转录,随后将经反转录产物进行RT-qPCR,以β-actin为内参,以2-ΔΔCt计算基因相对表达量,检测3组细胞中Prdm14 mRNA表达情况,引物见表1。
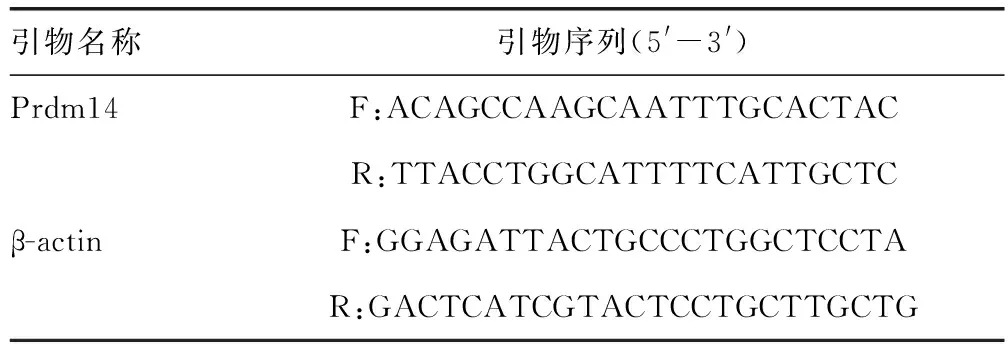
表1 引物序列
1.3.4蛋白质印迹法(WB)检测 收集细胞沉淀,加入400 μL裂解液[含10%苯甲基磺酰氟(PMSF)],直接混匀,冰上裂解10 min离心,取上清液,即为总蛋白;变性后的蛋白经聚丙烯酰胺凝胶(SDS-PAGE)电泳、转膜、封闭后,加入稀释好的一抗(Prdm14、Sox2、Oct4、Nanog),4 ℃过夜。次日,聚偏二氟乙烯(PVDF)膜经复温、TBST缓冲液漂洗后,加入相应的二抗,室温孵育1 h,随后采用电化学发光(ECL)试剂,于化学发光显影成像系统成像,采集图片,通过Image J对图像灰度值进行分析。
1.3.5碱性磷酸酶(ALP)检测 ALP主要存在于物质交换活跃处。ESCs、PGCs 前体细胞等干性细胞均呈ALP阳性,为进一步探索高表达 Prdm14对 C3H10T1/2细胞的作用,本研究进行了ALP 活性检测。分别收集阴性对照组和实验组细胞,制成细胞悬液,取100 μL细胞悬液滴于防脱载玻片,室温充分干燥后,4%多聚甲醛固定,滴加配制好的ALP孵育液,进行ALP染色,镜检,ALP活性部位为蓝色;根据ALP活性检测试剂盒说明书,检测在不同组别培养上清液中的ALP活性,以DEA酶活力单位表示。
1.3.6细胞增殖能力检测 96孔板中按3 000个细胞/孔加入细胞悬液,每组细胞设6个复孔,轻晃培养板,使细胞均匀分布,于37 ℃、5%CO2恒温细胞培养箱中培养;实验设置5个Dox诱导时间点:0、24、48、72、96 h,每日观察细胞生长状况并及时更换新的诱导培养基,在不同时间点吸弃板中的旧培养基,每孔重新加入含10 μL CCK-8的完全培养基100 μL,于恒温细胞培养箱中孵育2 h,用酶标仪测定450 nm 处吸光度(A)。
1.3.7细胞克隆形成实验 取生长良好的对数期细胞,以每孔400、800、1 600个细胞的梯度密度分别接种于6 cm培养皿中,混匀,置37 ℃、5% CO2条件下,静置培养14 d,培养7 d时换液。14 d后,终止培养。多聚甲醛固定后采用结晶紫染色,洗去染色液,空气干燥。采用Image J测定克隆直径,并计数大于10个细胞的克隆数。
2 结 果
2.1构建 C3H10T1/2-Prdm14 过表达细胞株 采用Tet-on系统构建 C3H10T1/2-Prdm14 过表达细胞株,经嘌呤霉素筛选后,Dox 诱导 48 h,可以在荧光显微镜下观察到绿色荧光,见图 1A。进一步采用 qRT-PCR 和WB分别检测 Prdm14 的 mRNA 和蛋白表达情况,结果显示,与阴性对照组相比,实验组中 Prdm14 的 mRNA 和蛋白水平均明显升高(P<0.05),见表2和图1B、C。
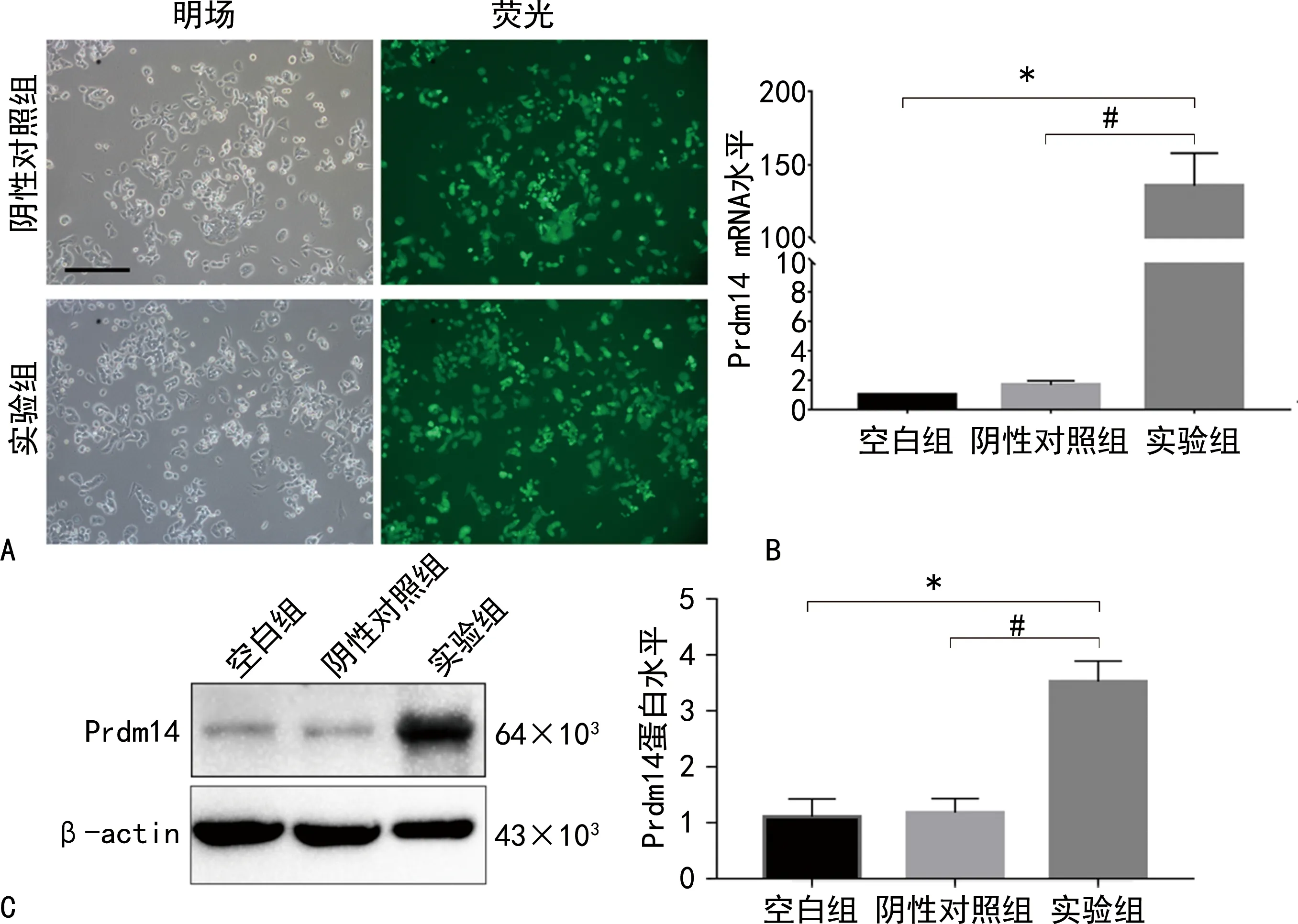
注:A表示慢病毒感染细胞经Dox诱导48 h后,绿色荧光蛋白表达情况; B表示不同组别细胞中Prdm14 mRNA表达情况;C表示不同组别细胞中Prdm14蛋白水平;实验组与空白组相比,*P<0.05;实验组与阴性对照组相比,#P<0.05。图1 C3H10T1/2-Prdm14 过表达细胞株构建及鉴定
表2 各组Prdm14 的 mRNA 和蛋白水平比较
2.2细胞增殖能力检测 采用CCK-8检测了阴性对照组和实验组细胞的增殖能力,结果显示,实验组细胞增殖能力较阴性对照组明显增加(P<0.05),见图2A。细胞克隆形成实验显示,实验组克隆数与阴性对照组相比,差异无统计学意义(P>0.05),但实验组平均克隆直径增加,差异有统计学意义(P<0.05),见图2B和表3。
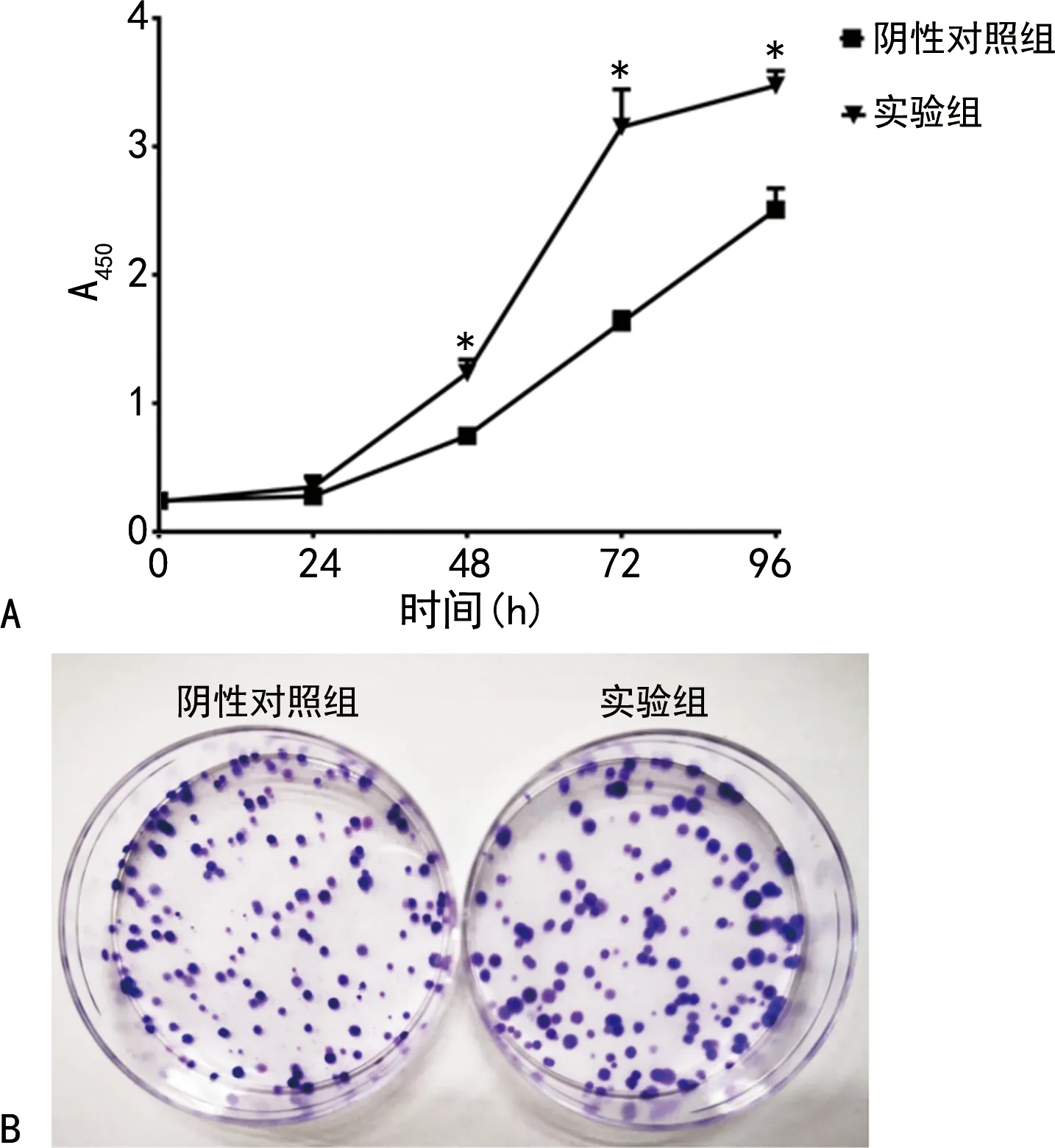
注:A表示细胞增殖能力情况;B表示细胞克隆形成能力情况;同一时间点实验组与阴性对照组相比,*P<0.01。图2 Prdm14高表达对细胞增殖能力的影响
表3 细胞克隆数和克隆直径情况
2.3ALP检测 ALP检测结果显示:C3H10T1/2 过表达 Prdm14 后,细胞膜、细胞质出现蓝色颗粒(图3A),其分泌的ALP活性[(20.76±0.52)个DEA酶活力单位]也较阴性对照组[(8.37±1.44)个DEA酶活力单位]明显增加(P<0.05),见图3B。
2.4干性因子表达检测 C3H10T1/2细胞中过表达Prdm14后,采用WB检测主要干性因子的表达情况。结果显示,实验组干性因子Sox2、Nanog蛋白水平均较阴性对照组升高(P<0.05),Oct4蛋白水平与阴性对照组比较,差异无统计学意义(P>0.05),见表4和图4。
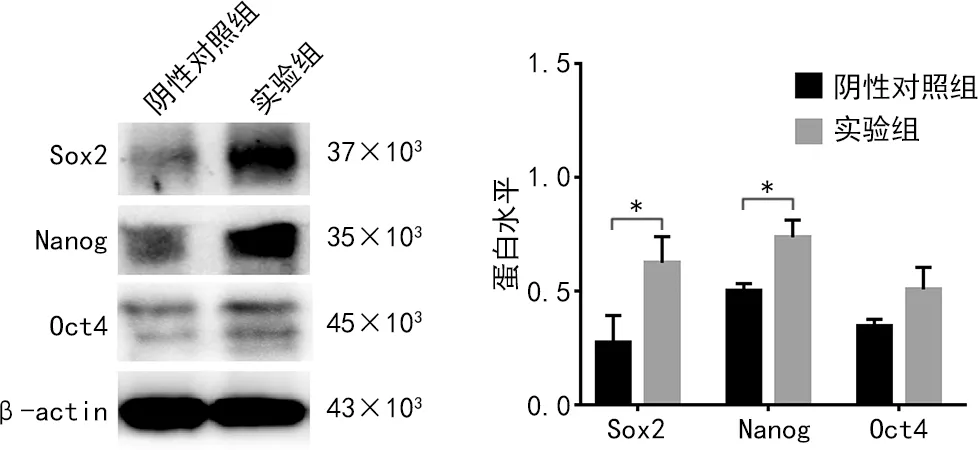
注:A为WB检测不同组别细胞中干性因子Sox2、Nanog以及Oct4蛋白水平;B为对A图进行灰度值量化结果;实验组与阴性对照组相比,*P<0.05。图4 C3H10T1/2高表达Prdm14后干性因子的表达情况
表4 Sox2、Nanog以及Oct4蛋白水平变化情况
3 讨 论
间充质干细胞(MSCs)来源于胚胎发育早期的中胚层未成熟的胚胎结缔组织,是一类具有自我更新和多种分化潜能的成体干细胞,在特定情况下可诱导分化为多种组织细胞。作为优选的组织工程种子细胞,在细胞替代治疗、基因治疗以及组织器官再造中具有重要的临床应用价值。C3H10T1/2细胞是由REZNIKOFF等[13]于1972年从C3H系小鼠胚胎分离建立的MSCs株,其形态为成纤维细胞样,也称为小鼠胚胎成纤维细胞,它具有多能分化的功能,可向脂肪、骨、肌等分化[14-16]。在体外培养早期,未分化的MSCs可表达转录因子Oct4、Nanog和Sox2,但随着培养时间的延长,其增殖能力、分化潜能减弱,甚至检测不到Oct4表达[17]。与之类似,本研究发现,在C3H10T1/2细胞中,主要干性因子Sox2、Nanog、Oct4表达均不高;并且ESCs、PGCs 前体细胞等干性细胞表达的ALP在C3H10T1/2细胞也表现为阴性,这可能与MSCs经过长时间的体外培养自身的干性减弱,发生自发性分化有关。离体培养的MSCs干细胞注入体内后,其干性降低,往往不能按照预期的方向进一步分化,进而限制了其应用。因此,干细胞干性的维持对其临床应用具有重要意义。
Prdm14为PRDM家族的重要成员,通过表观遗传学重编程、转录激活、抑制等过程,调节ESCs多能性、生殖细胞特化和发育[5,10,18-19],然而,Prdm14在MSCs中的表达及作用少见报道。本研究发现,C3H10T1/2细胞中内源性Prdm14水平较低,当过表达Prdm14后,C3H10T1/2细胞增殖能力增强,ALP活性增加,表明Prdm14在一定程度上能提升C3H10T1/2细胞自我更新能力。OKASHITA等[12]报道,在外胚层样细胞(EpiLCs)中,诱导Prdm14表达可上调干性相关基因。与之类似,本研究也发现Prdm14在C3H10T1/2细胞过表达能上调干性因子Sox2、Nanog的表达,进一步证实Prdm14对C3H10T1/2细胞的干性具有一定的促进作用。有研究显示,Prdm14在多种肿瘤中表达,能赋予癌细胞干性特性,促进细胞生存及肿瘤发生[20]。但在本研究中,Oct4的表达并未明显增加,细胞克隆数亦无明显变化,表明Prdm14对于C3H10T1/2细胞干性的诱导是有限的,并不会导致其向肿瘤方向发展。
值得注意的是,Prdm14既能与Oct4、Sox2等基因位点结合,自身的位点又是Nanog、Sox2等的靶点[3]。因此,尽管Prdm14能促进C3H10T1/2细胞干性因子表达,但其功能可能存在差异。在ESCs中,Prdm14与核心干性因子共同调控多能性相关基因网络,抑制促分化基因,维持ESCs可塑状态[18]。但在EpiLCs建立过程中,幼稚状态的ESCs多能性网络解体,EpiLCs的Nanog结合模式在全基因组范围内发生了变化:ESCs中,Nanog结合多能性因子,促进多能性状态,而EpiLCs中,Nanog结合并激活PGCs特化的关键因子Prdm1和Prdm14的增强子,进而诱导EpiLCs分化为PGCLCs[21]。
Prdm14在不同细胞中发挥的作用不尽相同。C3H10T1/2细胞中,Prdm14过表达能促进其增殖以及干性相关因子表达增加,但是否能进一步向生殖系方向分化及其调控机制均值得进一步深入研究。



