窦志华 陈敏 罗琳 孟萍 顾薇
1.南通大学附属南通第三医院药学部,江苏南通226006;2.南通大学药学院,江苏南通226019
茵陈蒿汤方剂配伍对黄疸模型小鼠血清生化指标的影响
窦志华1▲陈敏1▲罗琳2孟萍1顾薇1
1.南通大学附属南通第三医院药学部,江苏南通226006;2.南通大学药学院,江苏南通226019
目的研究茵陈蒿汤不同方剂配伍对黄疸模型小鼠的治疗作用。方法将144只ICR小鼠按随机数字表法随机分成正常组、模型组、茵陈蒿汤组、缺茵陈方组、缺栀子方组、缺大黄方组、单味茵陈组、单味栀子组和单味大黄组,每组16只。除正常组外,其余各组于实验第1、4、7、10天灌胃异硫氰酸-1-萘酯复制黄疸模型。正常组和模型组灌胃生理盐水,其余各组每天1次灌胃茵陈蒿汤及其各缺味方和单味药治疗,连续12 d,第12天给药后1 h取血,检测血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、总胆红素(TBIL)、直接胆红素(DBIL)和总胆汁酸(TBA)。结果与模型组比较,茵陈蒿汤组、单味大黄组、缺栀子方组、缺茵陈方组ALT、AST、ALP、TBIL、DBIL、TBA明显下降(P<0.01或P<0.05),单味栀子组AST、ALP、TBA明显升高(P<0.05)。结论茵陈蒿汤全方配伍合理,其中大黄在方中发挥主要作用,栀子单用具有一定肝毒性,大黄与栀子配伍及全方配伍可减毒增效。
茵陈蒿汤;方剂配伍;黄疸;转氨酶;胆红素;总胆汁酸;碱性磷酸酶
茵陈蒿汤由茵陈18 g、栀子12 g、大黄6 g组成[1],始载于汉代张仲景所着《伤寒论》,为中医临床治疗湿热黄疸的经典名方[2]。现代研究提示,该方具有抗肝损伤、防治脂肪肝、抗肝纤维化等作用[3],在肝病治疗领域有着广阔的应用前景[4]。方剂配伍规律是近年来中药方剂研究的重点课题[5]。方剂配伍药物效应动力学研究是方剂配伍规律研究的内容之一[6],该方法是从药效学方面研究方剂配伍变化与药效变化的关系,验证方剂组方的合理性或发现产生药效对应的组分[7]。方剂配伍药效学研究通常采用拆方法,拆方形式包括单味药、撤药分析等[6]。有鉴于此,本研究复制了异硫氰酸-1-萘酯(ANIT)小鼠黄疸模型,比较了茵陈蒿汤全方及各撤药缺味方和单味药对模型动物血清总胆红素(TBIL)、直接胆红素(DBIL)、总胆汁酸(TBA)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)等生化指标的影响,以期阐明茵陈蒿汤的配伍机制。
1 材料与方法
1.1 实验动物
SPF级ICR小鼠,雌雄各半,6周龄,体重(19.1± 3.9)g,购自南通大学实验动物中心,实验动物使用许可证号:SYXK(苏)2012-0031,合格证号:0036300。小鼠在南通大学实验动物中心SPF级环境下饲养。温度保持在19~25℃,相对湿度为60%~65%,环境光照保持12 h明12 h暗时刻表,可以自由进食和饮水,小鼠在进行正式试验之前进行1周左右的适应。所有动物实验都经南通大学医学院动物伦理委员会同意,所有实验操作严格遵守国际试验动物保护与使用准则。
1.2 药物与试剂
茵陈(产地江苏,批号120701)购自徐州彭祖中药饮片公司,栀子(产地江西,批号130520)、大黄(产地甘肃,批号130703)购自南通三越中药饮片公司,经南通市食品药品监督检验中心龚旭东主任中药师鉴定,茵陈、栀子、大黄的饮片来源分别为菊科植物茵陈蒿Artemisia capillaris Thunb.的干燥地上部分、茜草科植物栀子Gardenia jasminoides Ellis的干燥成熟果实和蓼科植物掌叶大黄Rheum palmatum L.的干燥根和根茎;ANIT(批号18320LD)购自美国Sigma公司。
1.3 仪器
数显智能型恒温水浴槽(GKC型,上海波络实验设备有限公司);超声波清洗器(SK5200H型,上海科导超声仪器有限公司);离心机(TGL-16G型,上海安亭科学仪器厂);全自动生化分析仪(7170型,日本日立公司)。
1.4 灌胃用药的制备
按质量比3∶2∶1称取茵陈、栀子、大黄,60%乙醇回流3次(乙醇加入量分别为8倍、8倍、6倍,回流时间分别为1、1、0.5 h),3次乙醇回流液合并,回收乙醇后的溶液作为全方供试药物;分别称取茵陈、栀子、大黄,同法制备茵陈、栀子、大黄供试药物;分别按质量比3∶2称取茵陈和栀子、3∶1称取茵陈和大黄、2∶1称取栀子和大黄,同法制备缺大黄方、缺栀子方、缺茵陈方供试药物。各供试药物灌胃剂量均相当于茵陈蒿汤及单味药的成人等效剂量。
1.5 动物分组及处理
ICR小鼠144只,雌雄各半,雌雄小鼠均使用随机数字表产生的随机数字分成9组:正常组、模型组、茵陈蒿汤组、缺茵陈方组、缺栀子方组、缺大黄方组、单味茵陈组、单味栀子组和单味大黄组,每组雌雄各8只。除正常组外,其余各组于实验第1、4、7、10天按剂量80mg/kg灌胃给予0.8%ANIT(将ANIT溶于植物油中,配成0.8%的ANIT溶液),所有小鼠自由饮水,常规饲养。除正常组和模型组灌胃生理盐水外,其余各组每天1次灌胃相应剂量供试药物,连续12 d,第12天所有动物先禁食12 h,末次给药后1 h颈动脉取血,置冰箱4℃静置6 h后,900 r/min离心10min,自动生化分析仪检测血清中ALT、AST、ALP、TBIL、DBIL、TBA。
1.6 统计学方法
使用Stata 7.0软件进行统计分析,计量资料以均数±标准差(x±s)表示,行单因素方差分析(ANOVA)和Scheffe检验,以P<0.05为差异有统计学意义。
2 结果
与正常组比较,模型组小鼠血清中ALT、AST、ALP、TBIL、DBIL、TBA均显着升高(P<0.01),说明造模成功。与模型组比较,茵陈蒿汤组、缺茵陈方组、缺栀子方组及单味大黄组以上指标均明显下降(P<0.01或P<0.05),单味栀子组AST、ALP和TBA反而明显升高(P<0.05)。见表1。
3 讨论
笔者先期研究结果显示,水煎液60%乙醇沉淀后的上清液部分为茵陈蒿汤保肝利胆的药效部位[8],提示其药效物质溶解于60%乙醇,故本实验直接采用60%乙醇提取制备灌胃用药。
ANIT是复制动物黄疸模型的经典造模剂,血清ALT、ALP、TBIL、TBA是黄疸的4项常规指标[8],实验结果显示,模型组小鼠血清中这4项指标均较正常组显着升高(P<0.01),说明造模成功。
本研究结果提示,茵陈蒿汤全方配伍、单味大黄、缺茵陈方、缺栀子方均具有明显的保肝及促进胆红素和胆汁酸代谢作用,单味茵陈及缺大黄方作用不明显,提示茵陈蒿汤全方具有合理性,大黄在方中发挥主要作用,这一结论与传统的茵陈为君药、栀子为臣药、大黄为佐药[9]不一致,但却得到了近年来本课题和其他相关研究的证实。近期本课题组分别制备了茵陈蒿汤全方灌胃给药后不同时间点含药血清和拆方配伍后相同时间点含药血清,一方面测定了含药血清指纹图谱[3],另一方面将含药血清作用于H2O2诱导的HL-7702肝细胞损伤模型进行了药效评价,最后通过谱-效关系分析,指认了含药血清指纹图谱中与药效相关的色谱峰,结果发现,1个来源于大黄的蒽醌类成分体内代谢产物活性较强[10]。日本研究人员采用大鼠肝纤维化模型研究发现,茵陈蒿汤具有明显的抗肝纤维化作用,大黄是方中唯一发挥该作用的药味[11-12]。魏国丽等[13]研究了茵陈蒿汤方剂配伍对急性胰腺炎小鼠模型的作用,发现大黄可能起君药作用。刘莹等[14]采用正交试验法进行了茵陈蒿汤拆方治疗非酒精性脂肪性肝炎的实验研究,结果发现大黄的作用最为全面。
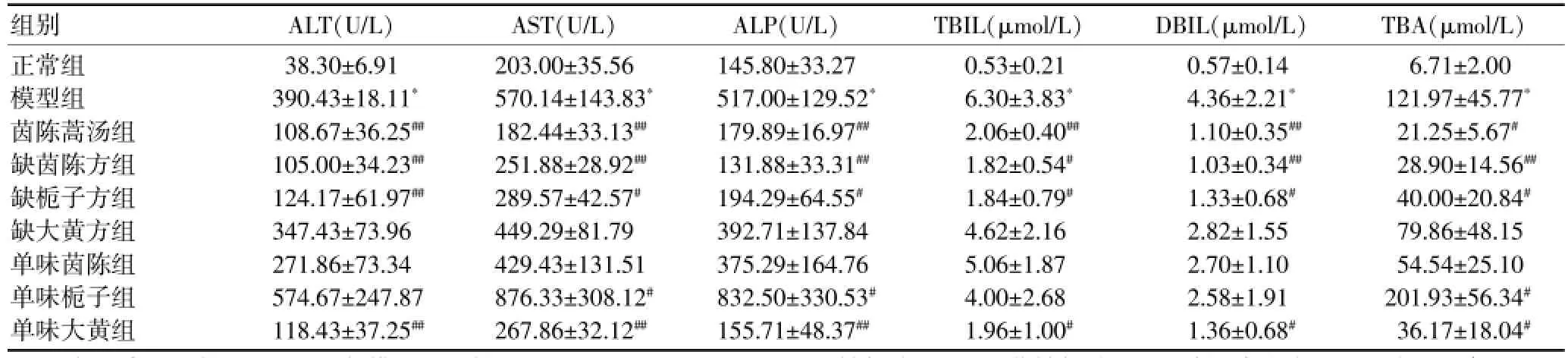
表1 方剂配伍对小鼠血清生化指标的影响(x±s,n=16)
本研究结果同时提示,栀子单用具有一定的肝毒性,大黄与栀子配伍及全方配伍可减毒增效。栀子的肝毒性可能与栀子所含的栀子苷等环烯醚萜类成分具有低剂量保肝高剂量则产生肝毒性的双重作用有关[15-18]。肖小华等[19]研究了不同剂量的栀子苷和西红花苷Ⅰ对ANIT诱导的小鼠肝损伤的保护作用,结果发现,西红花苷Ⅰ低剂量具有保护作用,高剂量西红花苷Ⅰ及低剂量栀子苷均没有保护作用,高剂量栀子苷反而具有肝毒性,笔者推测以上结果与剂量设计有关,栀子苷低剂量没有保肝作用是因为保护和毒性作用抵消,西红花苷Ⅰ高剂量也具有肝毒性,之所以没有显示出来,也是因为保护和毒性作用抵消。本课题组对茵陈蒿汤不同时间点含药血清的谱效关系研究结果也发现,西红花苷Ⅰ等西红花酸类成分及其体内代谢产物可能具有肝细胞保护和毒性双重作用(论文另发)。大黄与栀子配伍及全方配伍可降低栀子苷、西红花苷Ⅰ和西红花苷Ⅱ的提取率[20],可能与这两种配伍的减毒增效有关。
[1]贾波,李冀.方剂学[M].2版.上海:上海科学技术出版社,2012:209.
[2]许波,窦志华,罗琳,等.茵陈蒿汤血清药化学研究[J].北京中医药大学学报,2016,39(2):162-168.
[3]窦志华,许波,刘青青,等.茵陈蒿汤含药血清指纹图谱研究[J].中国药学杂志,2016,51(5):6-12.
[4]Yokoyama Y,Nagino M.Current scenario for the hepatoprotectiveeffectsof Inchinkoto,a traditionalherbalmedicine,and its clinical application in liver surgery:a review[J]. Hepatol Res,2014,44(4):384-394.
[5]张静宇,年莉,尹进.方剂配伍实验研究方法概述[J].中医杂志,2015,56(6):526-530.
[6]徐砚通.方剂配伍的现代科学内涵探讨[J].中草药,2015,46(4):465-469.
[7]杨爱华.茵陈蒿汤药效部位筛选及配伍机理初步研究[D].南京:南京中医药大学,2013.
[8]窦志华,罗琳,候金燕,等.茵陈蒿汤保肝退黄药效部位筛选[J].时珍国医国药,2014,25(10):2371-2373.
[9]徐维佳,范应,陈少东,等.均匀设计法筛选茵陈蒿汤抗脂肪肝脂质代谢异常的效应组分[J].中国医院药学杂志,2011,31(4):274-277.
[10]候金燕.茵陈蒿汤保肝作用的药效物质基础研究[D].南京:南京中医药大学,2015.
[11]Imanishi Y,Maeda N,Otogawa K,et al.Herb medicine Inchin-ko-to(TJ-135)regulates PDGF-BB-dependent signaling pathways of hepatic stellate cells in primary culture and attenuates development of liver fibrosis induced by thioacetamide administration in rats[J].JHepatol,2004,41(2):242-250.
[12]Imanishi Y,Maeda N,Matsui H,et al.Suppression of rat stellate cell activation and liver fibrosis by a Japanese herbalmedicine,inchinko-to(TJ135)[J].Comp Hepatol,2004,3(Suppl 1):S11.
[13]魏国丽,郑学宝,刘强,等.茵陈蒿汤方剂配伍对急性胰腺炎小鼠模型作用的研究[J].中华中医药学刊,2011,29(7):1670-1672.
[14]刘莹,陈晓伟,李健,等.茵陈蒿汤拆方对非酒精性脂肪性肝炎的正交实验研究[J].中国中西医结合消化杂志,2013,21(4):182-188.
[15]张海燕,邬伟魁,李芳,等.栀子保肝利胆作用及其肝毒性研究[J].中国中药杂志,2011,36(19):2610-2164.
[16]Ding Y,Zhang T,Tao JS,et al.Potential hepatotoxicity of geniposide,the major iridoid glycoside in dried ripe fruits of Gardenia jasminoides(Zhi-zi)[J].Nat Prod Res,2013,27(10):929-933.
[17]程生辉,唐超,李会芳,等.栀子苷对正常大鼠急性肝、肾毒性的时-毒关系分析[J].中国实验方剂学杂志,2016,22(1):162-165.
[18]程生辉,张妍妍,李会芳,等.基于黄疸模型大鼠的栀子苷急性肝肾毒性研究[J].中国实验方剂学杂志,2015,21(4):174-174.
[19]肖小华,徐丽瑛,周艳艳,等.栀子苷和西红花苷Ⅰ对ANIT致小鼠肝损伤的保肝作用研究[J].时珍国医国药,2014,25(7):1600-1601.
[20]窦志华,罗琳,姜晓燕,等.方剂配伍对茵陈蒿汤中15种成分提取率的影响[J].中草药,2015,46(12):1753-1758.
Effects of prescription com patibility of Yinchenhao Decoction on the serum biochem ical parameters of jaundice in m ice
DOU Zhihua1▲CHENMin1▲LUO Lin2MENG Ping1GUWei1
1.Department of Pharmacy,Nantong Third Affiliated Hospital of Nantong University,Jiangsu Province,Nantong 226006,China;2.College of Pharmacy,Nantong University,Jiangsu Province,Nantong 226019,China
Ob jective To study the therapeutic effect of different prescription compatibility of Yinchenhao Decoction on jaundice in mice.M ethods One hundred and forty four ICR mice were randomly divided into normal group,model group,Yinchenhao Decoction group,Yinchenhao Decoction without Herba Artemisiae Scopariae group,Yinchenhao Decoction without Fructus Gardeniae group,Yinchenhao Decoction without Radix et Rhizoma Rhei group,Herba Artemisiae Scopariae group,Fructus Gardeniae group and Radix et Rhizoma Rhei group by random number table,with 16 mice in each group.The jaundicemice were induced by gavage of alpha-naphthylisothiocyanate at 1,4,7,10 d,except the mice in normal group.The normal group and model group were given normal saline by gavage,the other groupswere given Yinchenhao Decoction and its lacking one herb of component and single herb by intragastric administration for 12 days.The serum was collected at 1 h after the last administration.The levels of alanine transaminase(ALT),aspartate aminotransferase(AST),alkaline phosphatase(ALP),total bilirubin(TBIL),direct bilirubin(DBIL)and totalbileacids(TBA)were detected.Results Compared withmodelgroup,the levelsof ALT,AST,ALP,TBIL,DBIL,TBA in the Yinchenhao Decoction group,Radix etRhizoma Rhei group,Yinchenhao Decoction without Fructus Gardeniae group,Yinchenhao Decoction without Herba Artemisiae Scopariae group were all significantly decreased(P<0.01 or P<0.05),while the levels of AST,ALP,TBA in the Fructus Gardeniae group were significantly increased(P<0.05). Conclusion The concerted application of Yinchenhao Decoction is reasonable prescription,among which,Radix et Rhizoma Rhei plays themain effect,single application of Radix et Rhizoma Rhei can induce some hepatotoxicity,while concerted application of Radix et Rhizoma Rhei and Fructus Gardeniae or Yinchenhao Decoction can reduce toxicity and enhance effect.
Yinchenhao Decoction;Prescription compatibility;Jaundice;Aminotransferase;Bilirubin;Total bile acids;Alkaline phosphatase
R285.5
A
1673-7210(2016)05(a)-0093-04
2016-01-02本文编辑:张瑜杰)
江苏省中医药局科研项目(HZ07071);江苏省省属高校自然科学基础研究项目(08KJB360009)。
窦志华(1966-),男,博士,主任中药师,硕士研究生导师,主要从事中药药效物质基础及质量控制研究。
罗琳(1976-),女,博士,副教授,主要从事药理学研究。
▲共同第一作者



