汪端 王安徽 傅文生
[摘要] 目的 研究非小细胞肺癌(NSCLC)患者血清程序性细胞死亡5(PDCD5)及增殖细胞核抗原(PCNA)的表达及与近期预后的关系。 方法 选取2017年2月~2018年2月安徽省宿州市立医院诊治的NSCLC患者79例作为癌症组,以同期40名健康体检者作为对照组。应用酶联免疫吸附试验检测两组血清PDCD5、PCNA的表达水平。分析NSCLC患者PDCD5、PCNA表达与临床病理特征之间的关系。分析NSCLC患者PDCD5、PCNA不同表达水平与1年总生存期(OS)的关系。 结果 癌症组血清PDCD5表达水平低于对照组,而PCNA表达水平高于对照组,差异有统计学意义(均P < 0.05)。血清PDCD5、PCNA表达与TNM分期、淋巴结转移有关(均P < 0.05)。血清PDCD5与PCNA表达呈显着负相关(r = -0.621,P = 0.000)。低PDCD5表达患者1年OS低于高PDCD5表达患者(P < 0.05);高表达PCNA患者1年OS低于低PCNA表达患者(P < 0.05)。 结论 NSCLC患者血清PDCD5表达降低,PCNA表达升高,二者与TNM分期、淋巴结转移有关,有希望成为新的NSCLC血清肿瘤标志物。
[关键词] 非小细胞肺癌;程序性细胞死亡5;增殖细胞核抗原;短期预后
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-7210(2020)05(b)-0098-04
Relationship between serum PDCD5 and PCNA expression with clinicopathological characteristics and short-term prognosis in patients with non-small cell lung cancer
WANG Duan WANG Anhui FU Wensheng
Department of Cardiothoracic Surgery, Suzhou Municipal Hospital, Anhui Province, Suzhou 234000, China
[Abstract] Objective To study the expressions of programmed cell death 5 (PDCD5) and proliferating cell nuclear antigen (PCNA) in serum of patients with non-small cell lung cancer (NSCLC) and their relationship with the short-term prognosis. Methods From February 2017 to February 2018, 79 cases with NSCLC patients who diagnosed and treated in Suzhou Municipal Hospital of Anhui Province were selected as cancer group, and 40 healthy medical examinees in the same period were used as control group. Enzyme-linked immunosorbent assay was used to detect the expression of PDCD5 and PCNA in the serum of two groups. The relationship between PDCD5, PCNA expression and clinicopathological characteristics of NSCLC patients were analyzed. The relationship between different levels of PDCD5 and PCNA expressions and the 1-year overall survival (OS) rate in NSCLC patients were analyzed. Results The expression levels of PDCD5 in cancer group were lower than those in control group, while the expression levels of PCNA in cancer group were higher than those in control group, and the difference was statistically significant(P < 0.05). The expressions of PDCD5 and PCNA in serum of the cancer group were related to TNM stage and lymph node metastasis (P < 0.05). Serum PDCD5 was significantly negatively correlated with PCNA expression (r = -0.621, P = 0.000). Patients with low PDCD5 expression had lower OS than patients with high PDCD5 expression for 1-year (P < 0.05). The 1-year OS of patients with high PCNA expression was lower than that of patients with low PCNA expression (P < 0.05). Conclusion The expression of serum PDCD5 of NSCLC patients is decreased, while the expression of PCNA is increased, which are related to the staging of TNM and lymph node metastasis, and are expected to become a new tumor marker in NSCLC serum.
[Key words] Non-small cell lung cancer; Programmed cell death 5; Proliferating cell nuclear antigen; Short-term prognosis
肺癌是人类常见的恶性肿瘤,全球每年新发病例数约180万,死亡例数约159万,占所有癌症特异死亡例数的19%[1]。肺癌的治疗方式包括手术、化疗及分子靶向治疗等,但中晚期肺癌患者复发率及转移率仍较高,5年生存率低于55%[2]。肺癌中以非小细胞肺癌(NSCLC)最为常见,但由于患者早期无明显临床表现,诊断时多为中晚期,手术及放化疗治疗效果不佳[3]。因此,有必要深入研究NSCLC的发生发展机制,寻找新的有助于临床诊断治疗及评估预后的血清肿瘤标志物。程序性细胞死亡5(PDCD5)基因位于19q13.11,该基因编码蛋白在细胞凋亡期间表达升高,并且从细胞质迅速转移到细胞核。功能上,PDCD5通过抑制赖氨酸乙酰基转移酶5蛋白酶体依赖性降解,参与调控DNA转录、损伤应答和细胞周期控制[4]。近年来研究显示[5],肿瘤细胞中存在PDCD5异常表达的现象,并可作为肿瘤诊断、治疗及预后标志物。增殖细胞核抗原(PCNA)基因位于20p12.3,该基因编码的蛋白质存在于细胞核中,是DNA聚合酶δ的辅因子。该基因编码的蛋白质形成同源三聚体,并促进DNA复制过程中前导链合成,DNA损伤时,该蛋白被泛素化并参与RAD6依赖的DNA修复途径[6]。肿瘤发生时,肿瘤组织中PCNA表达水平升高,并促进肿瘤细胞的增殖及迁移等生物学行为,有可能成为判断肿瘤预后的标志物[7]。近年来有研究发现[8-9],肺癌患者血清中PDCD5、PCNA存在异常表达,并可能有助于判断肿瘤患者的预后。本研究通过检测NSCLC患者血清中PDCD5、PCNA表达,分析其与临床病理特征及短期预后的关系,初步探讨两者的临床意义。
1 资料与方法
1.1 一般资料
选取2017年2月~2018年2月安徽省宿州市立医院(以下简称“我院”)诊治的NSCLC患者79例作为癌症组。纳入标准:①经病理检查确诊为NSCLC;②均为首次诊治;③临床病理及随访资料完整。排除标准:①合并有感染性疾病,免疫系统疾病等;②合并其他系统恶性肿瘤;③合并心肺等脏器功能不全;③有放化疗等治疗史。其中男43例,女36例;年龄43~62岁,平均(48.1±5.7)岁;病理类型:腺癌45例,鳞癌34例;肿瘤大小:≤5 cm 51例,>5 cm 28例;TNM分期:Ⅰ期21例,Ⅱ期24例,Ⅲ期23例,Ⅳ期11例。肿瘤分化程度:高分化20例,中分化26例,低分化33例;伴淋巴结转移44例,无淋巴结转移35例。以同期40名健康体检者作为对照组,男23例,女17例;年龄39~65岁,平均(47.6±5.5)岁。两组性别、年龄一般资料比较,差异无统计学意义(P > 0.05),具有可比性。所有患者及家属对本研究均知情同意并签字,本研究经我院医学伦理委员会批准。
1.2 方法
酶联免疫吸附试验(ELISA)双抗体夹心法检测两组血清PDCD5、PCNA的表达水平。取癌症组入院后、对照组体检时清晨空腹12 h静脉血5 mL,EDTA抗凝,静置2 h后,5000 r/min离心10 min,离心半径10 cm,分离上层血清,置于EP管中,-80℃保存。实验步骤严格按照试剂盒说明书进行,PDCD5试剂盒购自武汉优尔生有限公司(生产批号:20170119),PCNA试剂盒购自上海艾博抗有限公司(生产批号:20170118)。PDCD5检测范围为7.8~5000.0 pg/mL,PCNA检测范围为150~10 000.0 pg/mL。
1.3 观察指标
①比较两组血清PDCD5、PCNA表达水平;②分析癌症组血清PDCD5、PCNA表达与临床病理特征的关系;③分析血清PDCD5、PCNA表达的相关性;④癌症组所有患者自出院之日起进行随访,每月随访1次,以门诊或电话方式进行,随访12个月,随访内容包括患者生存情况,随访截止至随访结束或患者的死亡情况。
1.4 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用独立样本t检验;Pearson线性相关分析PDCD5与PCNA表达的相关性。组间生存率比较采用Kaplan-Meier生存曲线进行评估,Log-rank检验进行比较。以P < 0.05为差异有统计学意义。
2 结果
2.1 两组血清PDCD5、PCNA表达水平比较
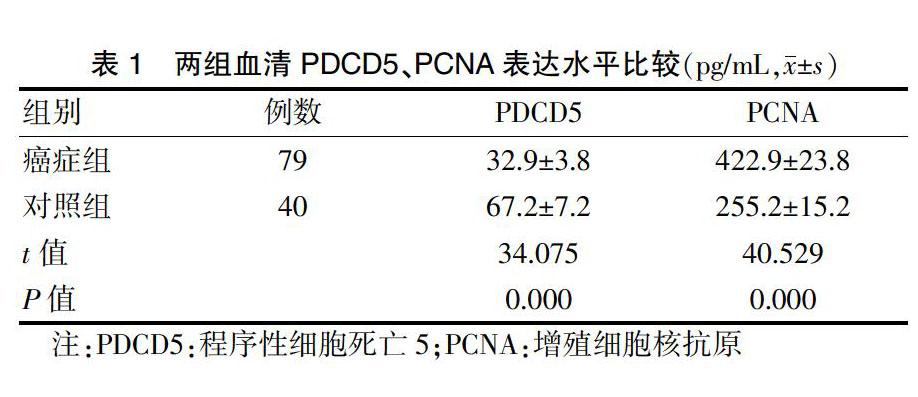
癌症组血清PDCD5表达水平低于对照组,PCNA表达水平高于对照组,差异有统计学意义(P < 0.05)。见表1。
2.2 血清PDCD5、PCNA表达与临床病理特征的关系
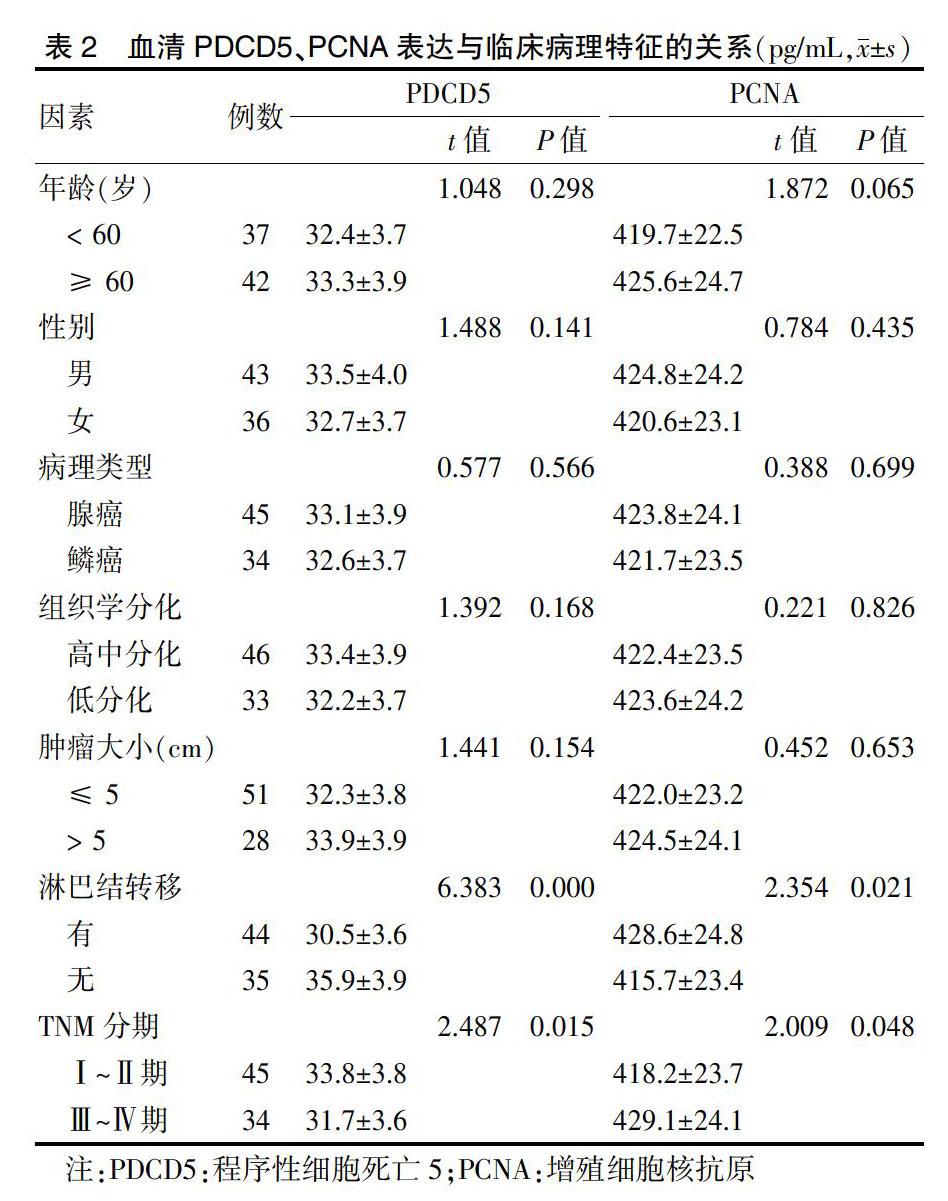
血清PDCD5、PCNA表达水平与TNM分期、淋巴结转移有关(P < 0.05)。见表2。
2.3血清PDCD5、PCNA表达的相关性分析
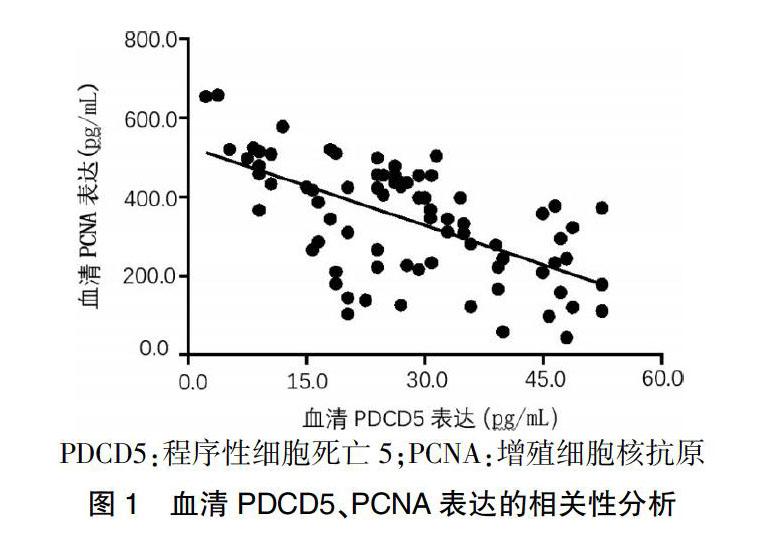
血清PDCD5表达水平与PCNA表达水平呈显着负相关(r = -0.621,P = 0.000)。见图1。
2.4 血清PDCD5、PCNA表达水平与短期预后关系
至随访结束,中位随访时间7个月,死亡35例。以血清PDCD5的均数32.9 pg/mL为界,分为高PDCD5表达41例和低PDCD5表达38例,低PDCD5表达患者1年总生存期(OS)低于高PDCD5表达患者(χ2=4.697,P = 0.044);以PCNA均数422.9为界,分为高PCNA表达40例和低PCNA表达39例,高PCNA表达患者1年OS低于低PCNA表达患者(χ2=6.311,P = 0.012)。见图2。
3 讨论
肺癌是最常见的恶性肿瘤,每年死亡的患者例数达150万[10]。NSCLC是最常见的肺癌类型,目前其治疗方式主要包括手术及化疗,随着对NSCLC分子机制研究的深入,发现NSCLC中存在多种基因如表皮生长因子受体基因的突变或重排,促进了肿瘤的发生发展[11],因而分子靶向药物及免疫检查点抑制剂的临床应用取得了良好的治疗效果,但部分患者存在治疗不敏感或耐药的现象[12]。因此有必要深入研究NSCLC疾病的发生发展机制,寻找有意义的诊断治疗及提示预后的血清肿瘤标志物。
程序性细胞死亡又称凋亡,是一种多阶段、多种基因调控的细胞自我死亡的过程。细胞凋亡异常与炎症、免疫及肿瘤等多种疾病的发生发展有关[13]。随着分子生物学技术的发展,发现肿瘤中存在多种凋亡调控的基因如Bcl-2家族基因、FAS家族基因等表达失常的现象。PDCD5基因是近年来新发现的凋亡相关基因,在胃癌、结直肠癌等多种肿瘤中均存在异常表达,PDCD5的低表达促进细胞增殖,其诱导细胞周期停滞在G2/M期,细胞凋亡能力减弱,进而促进肿瘤的增殖、凋亡等生物学行为[14]。本研究结果显示,癌症组血清PDCD5表达水平低于对照组,提示NSCLC患者血清PDCD5表达下调,其机制可能是与调控PDCD5的上游转录因子表达异常有关。有研究[15]显示,肿瘤中正向调控PDCD5的上游转录因子PITX1表达降低,导致PDCD5表达水平下降。本研究结果显示,NSCLC患者血清PDCD5表达与TNM分期、淋巴结转移有关。高临床分期、伴淋巴结转移患者血清中PDCD5表达水平较低,其原因可能是PDCD5是p53、Bcl-2、BAX等抑癌基因的重要上游调节因子,肿瘤发生时,PDCD5表达降低,导致p53、Bcl-2、BAX等抑癌基因表达水平下降,促进肿瘤细胞的增殖,细胞周期进程和凋亡,导致肿瘤分期升高[16]。进一步分析发现,低PDCD5表达患者1年OS明显低于高表达患者,提示检测血清PDCD5水平有助于反映NSCLC患者的短期预后情况,血清PDCD5有可能成为判断NSCLC患者短期预后的肿瘤标志物。
PCNA是重要的真核生物复制辅助因子,在DNA复制、修复、细胞周期和细胞凋亡中起着至关重要的作用。在DNA损伤修复和DNA复制过程中,PCNA与核酸内切酶XPG结合,促进新的DNA片段的重新合成[17]。近年来发现,多种肿瘤中PCNA表达水平升高,促进肿瘤细胞的的恶性进展[18]。本研究结果显示,NSCLC患者血清PCNA表达水平明显高于对照组,提示NSCLC患者血清PCNA表达水平升高,其机制可能与PCNA的转录后表达调控异常有关。有研究[19]报道,肺癌发生时肿瘤中微小RNA(miRNA)-363-3p表达下调,导致其结合到PCNA信使RNA的3′非编码区减少,抑制PCNA表达能力,使PCNA水平升高。本研究结果显示,NSCLC患者血清PCNA表达与TNM分期、淋巴结转移有关。高临床分期、伴淋巴结转移患者血清中PCNA表达水平较高,其机制可能是PCNA表达升高后,其与p21结合以促进细胞周期的进程,并与生长抑制剂1(ING1)相互作用以抑制细胞凋亡的发生[20]。进一步研究发现,高PCNA表达患者1年OS明显低于高低达组,提示血清PCNA水平能反映患者的短期预后,PCNA有可能作为判断患者预后的肿瘤标志物。
此外,本研究结果显示,NSCLC患者血清PDCD5表达与PCNA表达呈显着负相关,目前两者之间相互作用关系尚不明确,可能与两者受共同miRNA调控有关,有研究[15,21]报道,miR-19表达上调后促进PCNA表达的同时,直接或间接抑制PDCD5的表达。
综上所述,NSCLC患者血清PDCD5表达降低,而PCNA表达升高,两者与NSCLC肿瘤分期、淋巴结转移有关,有望成为新的NSCLC诊断、治疗及提示预后的肿瘤标志物,但两者的临床意义有待进一步研究。
[参考文献]
[1] Mao Y,Yang D,He J,et al. Epidemiology of Lung Cancer [J]. Surg Oncol Clin N Am,2016,25(3):439-445.
[2] 黄亚,张西志.非小细胞肺癌综合治疗中的放疗联合免疫治疗[J].实用临床医药杂志,2019,23(14):7-11.
[3] 孔德琦,刘苓霜,姜怡,等.中医药干预Ⅲa期非小细胞肺癌根治术后无病生存期及预后相关因素分析[J].国际中医中药杂志,2019,41(1):8-13.
[4] Li G,Ma D,Chen Y. Cellular functions of programmed cell death 5 [J]. Biochim Biophys Acta,2016,1863(4):572-580.
[5] Gao L,Ye X,Ma RQ,et al. Low programmed cell death 5 expression is a prognostic factor in ovarian cancer [J]. Chin Med J(Engl),2015,128(8):1084-1090.
[6] Prestel A,Wichmann N,Martins JM,et al. The PCNA interaction motifs revisited:thinking outside the PIP-box [J]. Cell Mol Life Sci,2019,76(24):4923-4943.
[7] Cai F,Li J,Pan X,et al. Increased Expression of PCNA-AS1 in Colorectal Cancer and its Clinical Association [J]. Clin Lab,2017,63(11):1809-1814.
[8] 王飞.PDCD5和PCNA在肺癌患者血清中的表达[J].浙江实用医学,2018,23(1):8-9,18.
[9] Jang N,Choi JE,Kang SH,et al. Validation of the pathological prognostic staging system proposed in the revised eighth edition of the AJCC staging manual in different molecular subtypes of breast cancer [J]. Virchows Arch,2019,474(2):193-200.
[10] Torre LA,Bray F,Siegel RL,et al. Global cancer statistics,2012 [J]. CA Cancer J Clin,2015,65(2):87-108.
[11] 方平,王沣,江富来,等.非小细胞肺癌表皮生长因子受体突变的检测与分子靶向治疗[J].中华肺部疾病杂志:电子版,2017,10(5):543-548.
[12] 徐燕,田春香,刘武,等.化疗序贯靶向药物治疗表皮生长因子受体-酪氨酸激酶抑制剂获得性耐药老年晚期非小细胞肺癌患者临床研究[J].肿瘤研究与临床,2018, 30(9):617-620.
[13] Singh R,Letai A,Sarosiek K. Regulation of apoptosis in health and disease:the balancing act of BCL-2 family proteins [J]. Nat Rev Mol Cell Biol,2019,20(3):175-193.
[14] Kwak S,Lee SH,Han EJ,et al. Serine/threonine kinase 31 promotes PDCD5-mediated apoptosis in p53-dependent human colon cancer cells [J]. J Cell Physiol,2019,234(3):2649-2658.
[15] Qiao F,Gong P,Song Y,et al. Downregulated PITX1 Modulated by MiR-19a-3p Promotes Cell Malignancy and Predicts a Poor Prognosis of Gastric Cancer by Affecting Transcriptionally Activated PDCD5 [J]. Cell Physiol Biochem,2018,46(6):2215-2231.
[16] Li P,Fei H,Wang L,et al. PDCD5 regulates cell proliferation,cell cycle progression and apoptosis [J]. Oncol Lett,2018,15(1):1177-1183.
[17] De March M,De Biasio A. The dark side of the ring:role of the DNA sliding surface of PCNA [J]. Crit Rev Biochem Mol Biol,2017,52(6):663-673.
[18] Mestrinho LA,Faísca P,Peleteiro MC,et al. PCNA and grade in 13 canine oral squamous cell carcinomas association with prognosis [J]. Vet Comp Oncol,2017,15(1):18-24.
[19] Wang Y,Chen T,Huang H,et al. miR-363-3p inhibits tumor growth by targeting PCNA in lung adenocarcinoma [J]. Oncotarget,2017,8(12):20133-20144.
[20] Gary R,Ludwig DL,Cornelius HL,et al. The DNA repair endonuclease XPG binds to proliferating cell nuclear antigen (PCNA) and shares sequence elements with the PCNA-binding regions of FEN-1 and cyclin-dependent kinase inhibitor p21 [J]. J Biol Chem,1997,272(39):24522-24529.
[21] Li X,Xie W,Xie C,et al. Curcumin modulates miR-19/PTEN/AKT/p53 axis to suppress bisphenol A-induced MCF-7 breast cancer cell proliferation [J]. Phytother Res,2014,28(10):1553-1560.
(收稿日期:2020-02-04 本文编辑:刘明玉)



