李 巍 王 娇 苏 莉 苗劲蔚 吴玉梅
首都医科大学附属北京妇产医院 北京妇幼保健院妇瘤科,北京 100071
卵巢癌(ovarian cancer,OC)是妇产科常见的恶性肿瘤之一,其中70%为晚期病例,5 年生存率约为40%[1],死亡率高居前列。目前虽然妇科肿瘤手术满意率有所提升,但上述情况仍未改变[2]。其中的一个重要原因为OC 是异质性肿瘤,患者对化疗药物的敏感性存在较大差异,术后最重要的化疗目前为经验性治疗,效果有限。传统的肿瘤药物敏感性试验主要基于肿瘤细胞系模型,但细胞系有缺乏异质性、无法保留肿瘤微环境、反复体外传代容易发生基因变异等缺点,临床应用效果差。人源肿瘤异种移植(patient-derived tumor xenograft,PDX)模型是将患者的新鲜肿瘤组织接种到免疫缺陷小鼠体内,可以更好地保留肿瘤组织的异质性[3],模拟患者体内状态,有助于实现药物筛选等研究[4-6]。本研究拟构建OC 的PDX 模型,经整体观察、组织病理学、分子生物学研究,评估PDX 模型构建的有效性,为OC 研究提供可靠的临床前模型[7]。
1 材料与方法
1.1 肿瘤标本
收集2017 年7 月至2018 年7 月在首都医科大学附属北京妇产医院进行手术治疗的10 例OC 患者肿瘤组织,进行PDX 建模研究。纳入标准:①病理确诊为OC;②对本研究知情同意。排除标准:①复发OC;②合并其他恶性肿瘤;③免疫系统疾病;④既往行放化疗。本研究获得医院伦理委员会审批立项(20160913)。
1.2 实验动物
实验动物为雌性非肥胖糖尿病/重症联合免疫缺陷(non-obese diabetes/severe combined immunodeficiency,NOD/SCID)小鼠,购自北京华阜康生物科技有限公司,动物使用许可证SYXK(京)2015-0030,实验动物质量合格证号NO.11401300083533,鼠龄6~8 周,体重20~24 g,共150 只。饲养于北京志康博SPF 级实验动物中心,环境温度和相对湿度分别维持在22~26℃和40%~60%,饲料及饮用水均经无菌处理。
1.3 肿瘤组织处理及PDX 模型建立
无菌条件下取患者新鲜肿瘤组织(P0 代),置于Hank’s 平衡盐溶液中冷藏运送;部分新鲜肿瘤组织置于4%中性甲醛溶液中固定,用于石蜡包埋、染色等实验。
于SPF 实验动物中心超净台上,用Hank’s 平衡盐溶液反复清洗新鲜肿瘤组织,剔除坏死和脂肪组织。再将肿瘤组织分割成2 mm3的若干部分。75%酒精消毒小鼠背部皮肤,将移植部位用0.5%利多卡因进行局部浸润麻醉,利用25 号套管针将肿瘤组织1~2 块送至小鼠皮下,按压局部2 min。一份肿瘤组织样本接种3 只NOD/SCID 小鼠腋背部皮下,共接种30 只。其后观察小鼠的健康状态及移植瘤生长情况,移植瘤稳定后逐步增长,若连续观察4 个月未成瘤,记为建模失败。
1.4 肿瘤传代
用游标卡尺检测移植瘤的生长情况,≥2 次/周,测量肿瘤的长度和宽度。当移植瘤体积为500~1000 mm3时为建模成功(记为P1 代),颈椎脱位方法处死小鼠,无菌条件下取出移植瘤,按前述方法移植至下一代NOD/SCID 小鼠(记为P2 代),依此类推,部分直至传至P4 代。同时各代取部分新鲜肿瘤组织置于4%中性甲醛溶液中固定,用于石蜡包埋、染色等实验。
1.5 苏木精-伊红(hematoxylin-eosin,HE)染色、免疫组织化学(immunohistochemistry,IHC)分析
患者肿瘤组织及移植瘤组织以4%中性甲醛固定48 h,常规脱水,石蜡包埋切片,厚度4~6 μm,行HE 和IHC 染色。IHC 染色,检查指标包括P53(MAB-0674)、Ki67(MAB-0672)、P16(MAB-0673)、WT1(MAB-0678)、Pax8(MAB-0837)、雌激素受体(estrogen receptor,ER)(MAB-0062)、孕激素受体(progesterone receptor,PR)(MAB-0675)、波形蛋白(MAB-0735),均购自迈新生物科技有限公司。
2 结果
2.1 接种后NOD/SCID 小鼠状态观察
接种肿瘤组织后NOD/SCID 小鼠活动、精神状态、外界反应、饮食、大小便情况等大致正常,总体研究过程中,小鼠无明显不良反应。肿瘤组织接种后小鼠体重下降不明显,7~10 d 后体重缓慢增加。传代前曾观察到3 只小鼠体重降低,可能跟其自身的营养状况稍差、肿瘤负荷较大等相关。建模成功后模型外观见图1。

图1 非肥胖糖尿病/重症联合免疫缺陷小鼠卵巢癌人源异种移植模型外观(P1~4 代)
2.2 移植瘤及其PDX 模型建立情况
移植瘤接种小鼠后,2~4 周后瘤体逐步长大,8~12 周基本成瘤。4 例患者的标本PDX 模型建模成功,成功率为40%。P1~4 代共150 只NOD/SCID 小鼠中成功构建卵巢癌模型110 只,其中共接种P1 代NOD/SCID 小鼠30 只,8 只建模成功,成功率为26.6%(8/30);共接种P2 代NOD/SCID 小鼠24 只,20 只建模成功,成功率为83.3%(20/24);共接种P3 代NOD/SCID 小鼠60 只,53 只建模成功,成功率为88.3%(53/60)。共接种P4 代NOD/SCID 小鼠36 只,29 只建模成功,成功率为80.1%(29/36)。
2.3 NOD/SCID 小鼠PDX 模型移植瘤病理分析
移植瘤瘤体外观大致呈球形,质地稍硬,包膜多完整,表面可见血管纹理,剖开后切面呈乳白色,囊实性,部分瘤体内含黏液,部分瘤体内可见液化区。见图2。HE 染色后,镜下可见腺腔样结构,腺体大小不一,形态不规则,间质较少,上皮细胞异型性明显,核仁明显,病理性核分裂象多见,与来源人OC 结构及瘤细胞异型特征基本一致。随着传代次数增加,瘤细胞分化程度变低,腺样结构逐渐消失,上皮细胞分化差,核异型性明显。见图3。

图2 非肥胖糖尿病/重症联合免疫缺陷小鼠卵巢癌人源异种移植模型移植瘤形态
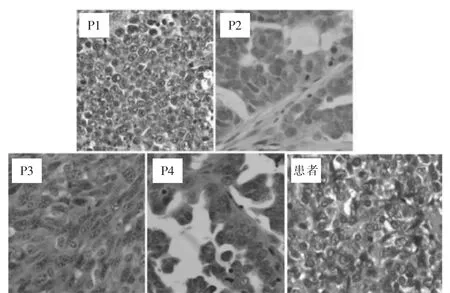
图3 各代非肥胖糖尿病/重症联合免疫缺陷小鼠卵巢癌人源异种移植模型移植瘤及来源患者肿瘤组织切片(苏木精-伊红染色,200×)
2.4 NOD/SCID 小鼠PDX 模型移植瘤IHC 分析
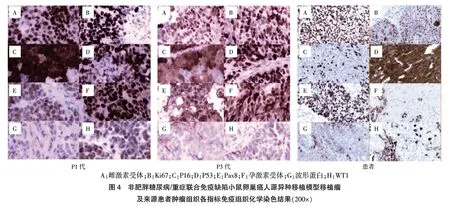
光镜下,各代移植瘤的形态和组织结构均与P1代肿瘤组织高度相似,IHC 染色下ER、PR、P53、P16、Ki67、WT1、Pax8 均呈阳性表达,而波形蛋白呈现阴性表达,与来源患者肿瘤组织高度一致。见图4。
3 讨论
目前国内外研究机构已在头颈部肿瘤[8]、食管癌[9]、乳腺癌[10]、胃肠道肿瘤[11]等领域构建多个PDX 模型,建模成功率为13%~90%[12],但在妇科恶性肿瘤领域,尤其是OC 方面,PDX 模型相关的研究报道较少[13-17]。
以往研究显示[18],妇科肿瘤PDX 模型建模成功率较低,为提高PDX 模型成功率,本研究选用了NOD/SCID 小鼠进行建模,该小鼠是NOD 小鼠与SCID 小鼠杂交建立的免疫缺陷小鼠,其T、B 细胞及自然杀伤细胞活性缺失,可以接纳人血液系统恶性肿瘤和实体瘤,有利于PDX 模型的建立。但NOD/SCID 小鼠胸腺淋巴瘤发病率高[19],胸腺淋巴瘤可能与人类潜在的EB病毒感染有关,因此,本研究利用NOD/SCID 小鼠进行PDX 模型建模时,有必要对肿瘤的生物学一致性进行鉴定。
本研究采集10 例OC 患者的新鲜肿瘤组织,皮下接种于NOD/SCID 小鼠,最终4 例患者成功建模,建模成功率为40%。一般模型建立时间为2~3 个月,若4 个月仍未观察到肿瘤生长,则表示建模失败[20]。既往研究报道,肿瘤植入部位、小鼠种系、肿瘤病理类型及恶性程度等会影响PDX 模型的成瘤率[21]。本研究中建模的有利条件为卵巢肿瘤组织充足可供严格筛选;NOD/SCID 小鼠免疫耐受性好;手术医师直接取材,可确保肿瘤组织无菌接种;取材、转运至接种时间短(<1 h)。虽然如此,本研究的Po 代建模成功率仅为40%,提示OC 的PDX 建模成功率不高,与既往研究类似,尚需进一步提升[22]。
本研究也提示OC 的PDX 模型形态及病理特点与患者临床病理特点基本一致。为验证移植瘤生长过程中组织学形态及病理特点的一致性情况,本研究对肿瘤组织P1~4 代移植瘤进行IHC 分析,指标包含P53、Ki67、P16、WT1、Pax8、ER、PR、波形蛋白。Ki67 代表肿瘤增殖情况,肿瘤恶性程度越高,Ki67 值越高,本研究IHC 分析结果显示P1~4 代移植瘤Ki67 均较高。P53 是重要的抑癌基因,参与调控细胞周期,在大多数恶性肿瘤中可被检测到,P16 也是重要的抑癌基因,其突变及缺失与OC 的发生发展密切相关[23]。与以往研究类似[24-25],本研究发现与Po 代肿瘤组织相似,各代移植瘤均表现出P53 及P16 基因的突变。同时,Pax8 是配对盒基因8 抗体,在OC 组织中有特异性表达,为卵巢原发肿瘤的典型特征,各代移植瘤均有阳性表达,提示移植瘤模型保留了OC 组织的分子遗传学特点。
综上,本研究成功建立了OC 的PDX 模型,其建立方法可行,接种的肿瘤的生物学性状得以稳定保留,为进行临床试验及OC 相关研究奠定了基础。



