郑 磊,蒋 喆,刘婧逸,李晓卫,韩素芬*
(1.邢台市人民医院乳腺外科,2.邢台市人民医院影像科,河北邢台 054001)
乳腺癌是临床妇科中常见的恶性肿瘤,目前还未完全明确其病因与发病机制,多认为与环境、生殖、乳腺癌相关基因、家族史等因素有着直接或间接的关系;三阴性乳腺癌是一种特殊的乳腺癌类型,其发病初期缺乏特异性临床表现,大多患者就诊时肿瘤已发展至中晚期,从而丧失最佳手术治疗时机。TEC方案(紫杉醇+环磷酰胺+表柔比星)是临床针对该疾病常用的规范化化疗方案,其中表柔比星作为临床一线的蒽环类抗癌药物,可对核酸的转录与复制进行有效抑制,进而抑制肿瘤细胞的生长与远处转移,延长患者的生存周期[1]。既往的常规剂量治疗方式虽可在一定程度上缓解患者临床症状,但其无法保证理想的治疗效果,且常规剂量的供给无法完全控制病情发展;而增加剂量可更好地对患者全身进行系统性细胞毒性治疗,但其引起的不良反应较多[2]。本研究旨在对比分析不同剂量表柔比星对三阴性乳腺癌患者近期疗效与血清癌胚抗原(CEA)、糖类抗原125(CA125)及糖类抗原153(CA153)水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 按照随机数字表法将2019年7月至2020年10月邢台市人民医院收治的三阴性乳腺癌患者86例分为对照组与研究组,各43例。对照组患者年龄30~58岁,平均(47.59±2.62)岁;恶性肿瘤TNM分期[3]:ⅡA期15例,ⅡB期18例,ⅢA期10例。研究组患者年龄31~59岁,平均(47.61±2.70)岁;TNM分期:ⅡA期13例,ⅡB期19例,ⅢA期11例。两组患者一般资料经比较,差异无统计学意义(P>0.05),组间具有可比性。纳入标准:符合《乳腺癌诊疗与进展》[4]中三阴性乳腺癌的诊断标准且经穿刺活检检查确诊者;孕激素受体、雌激素受体、人表皮生长因子受体等检测结果均为阴性者;生存质量卡氏评分(KPS)[5]≥70分者;骨髓造血功能、心功能、凝血功能均无异常者等。排除标准:肝、肾功能较差,患有感染性疾病、贫血或其他恶性肿瘤者;正在进行全身性或局部化疗者;合并骨髓功能抑制障碍者等。本研究经邢台市人民医院医学伦理委员会审核批准,所有患者及其家属均签署知情同意书。
1.2 治疗方法 两组患者均实施TEC方案(紫杉醇+环磷酰胺+表柔比星)治疗,具体如下:在治疗第1天,两组患者静脉滴注175 mg/m2的紫杉醇注射液(远大医药黄石飞云制药有限公司,国药准字H20103640,规格:10 mL∶60 mg)+0.6 g/m2的注射用环磷酰胺(瀚晖制药有限公司,国药准字H20093392,规格:0.2 g/支),对照组患者在治疗第1天加用70 mg/m2常规剂量的注射用盐酸表柔比星[辉瑞制药(无锡)有限公司,国药准字H20000496,规格:10 mg/支];研究组患者在治疗第1天和第2天均加用60 mg/m2的注射用盐酸表柔比星。两个组患者均以21 d为1个疗程,均连续治疗3个疗程,并于治疗后随访1个月。
1.3 观察指标 ①近期疗效。根据实体瘤治疗疗效评价标准[6]判断两组患者治疗后的近期疗效,完全缓解(CR):目标病灶全部消失,且未出现新病灶,维持1个月;部分缓解(PR):基线病灶长径总和缩小 > 30%,并维持1个月;疾病稳定(SD):肿瘤最大直径缩小但未达到PR,或肿瘤最大直径增大未达到疾病恶化(PD);PD:肿瘤最大直径增大≥ 20%或出现新病灶;并计算客观缓解率(ORR),客观缓解率=(CR+PR)例数/总例数×100%。②肿瘤标志物。采集两组患者治疗前后空腹静脉外周血3 mL,以3 000 r/min的转速离心15 min取上层血清,采用电化学发光法检测血清CEA水平,采用化学发光法检测血清CA125、CA153水平。④不良反应。观察两组患者治疗期间不良反应发生情况,包括消化道反应、贫血、白细胞减少、血小板减少、心肌酶改变、心点图改变等,并根据两组患者各项不良反应的严重程度分为0~Ⅳ级,0度、Ⅰ度、Ⅱ度、Ⅲ度、Ⅳ度分别表示没有不良反应、轻度、中度能耐受、中度不能耐受、重度不良反应[7]。
1.4 统计学分析 应用SPSS 24.0统计软件分析数据,计量与计数资料分别以(±s)、[例(%)]表示,分别采用t、χ2检验比较。以P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效 治疗后,研究组患者的ORR显着高于对照组,差异有统计学意义(P<0.05),见表1。
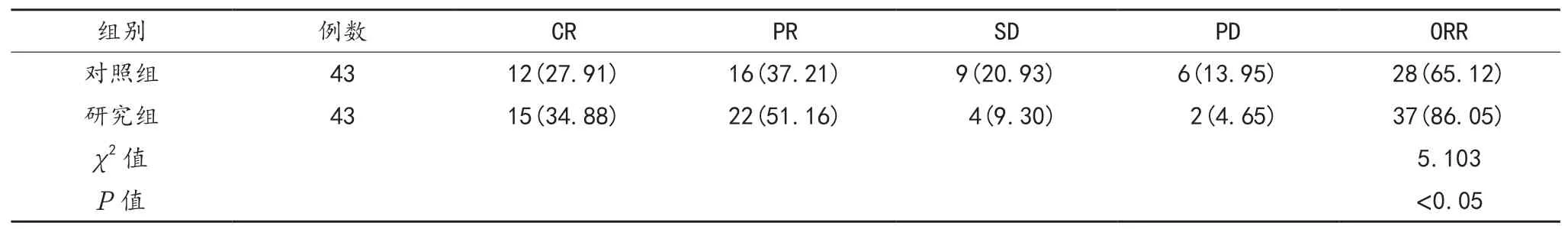
表1 两组患者近期疗效比较[ 例(%)]
2.2 肿瘤标志物 与治疗前比,治疗后两组患者血清CEA、CA125、CA153水平均显着降低,且研究组显着低于对照组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者肿瘤标志物水平比较(±s)
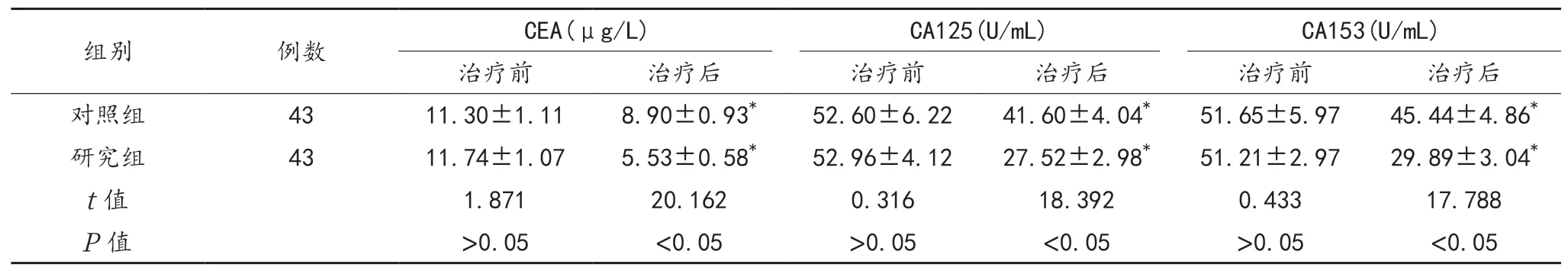
表2 两组患者肿瘤标志物水平比较(±s)
注:与治疗前比,*P<0.05。CEA:癌胚抗原;CA125:糖类抗原125;CA153:糖类抗原153。
?
2.3 不良反应 两组患者的各项不良反应发生情况与严重化程度经比较,差异均无统计学意义(均P>0.05),见表3。
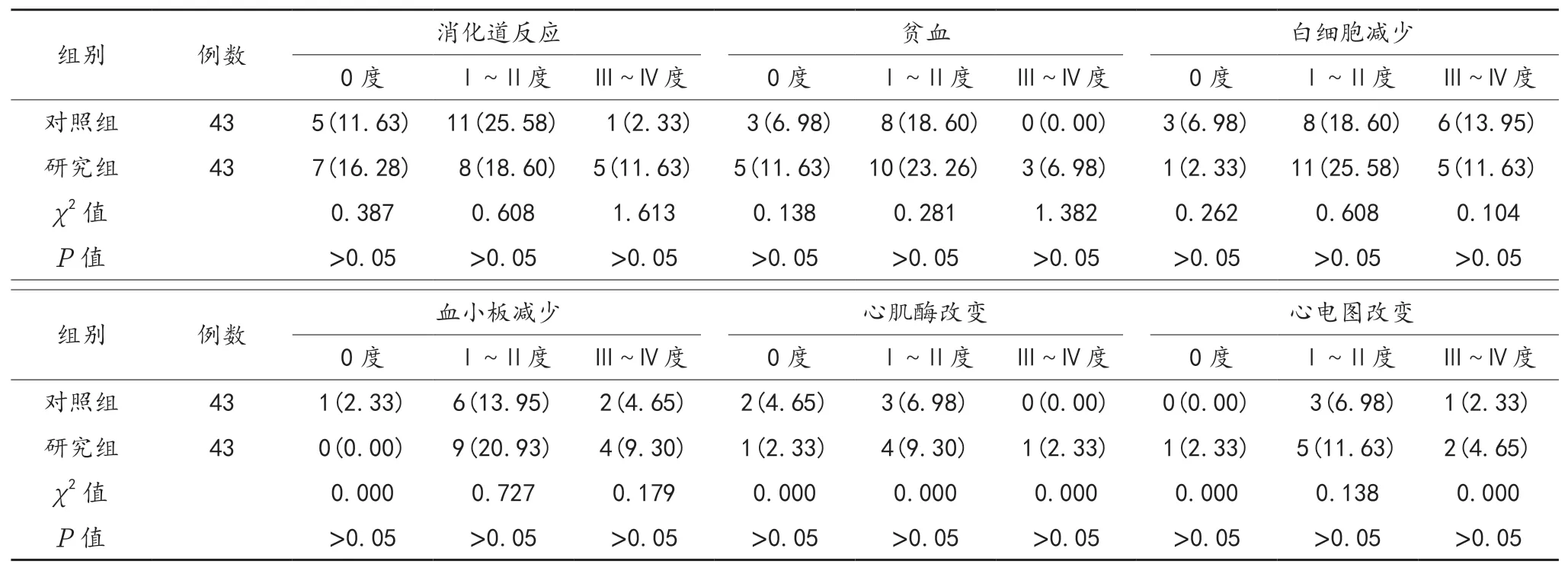
表3 两组患者不良反应比较[ 例(%)]
3 讨论
三阴性乳腺癌的肿瘤侵袭性较强,易发生远处转移与局部复发,且其对化疗的敏感性较差,其无论是临床病理特征,还是生物学行为,三阴性乳腺癌均较为特殊,属于独立的一种临床病理类型,患者预后极差。现阶段,临床尚未提出三阴性乳腺癌的规范性治疗方法,且该疾病属于高度异质性肿瘤,需进行全身性治疗来缓解患者的临床症状,表柔比星从药物性质上分析属蒽环类第三代半合成化合物,其提高机体的抗肿瘤活性作用较强[8]。
抗癌药物的临床给药剂量同最后取得的治疗效果具有直接性关系,接受高剂量表柔比星化疗治疗的患者,其在改善总生存期、生存率等方面更为显着,尤其是三阴乳腺癌或肿瘤等级较高、预后较差的患者,高剂量化疗的效果更为理想[9]。在三阴性乳腺癌的发生发展过程中,血清CEA、CA125、CA153等肿瘤标志物含量随着疾病的恶化而呈高表达水平,其对肿瘤的早期诊断、检测及预后效果的评估等有着重要的临床价值。本研究结果显示,治疗后,研究组患者的ORR显着高于对照组,血清CEA、CA125、CA153水平均显着低于对照组,提示应用高剂量表柔比星可有效提升三阴性乳腺癌患者的近期治疗效果,并降低肿瘤标志物水平,控制疾病进展。分析其原因为,三阴性乳腺癌患者在进行新辅助化疗的过程中,表柔比星作为蒽环类药物能对肿瘤细胞RNA和DNA的合成产生抑制作用,同时有效抑制肿瘤细胞的活性,促使其凋亡,达到治疗疾病的目的;而高剂量的表柔比星可更有效地对肿瘤细胞的分裂进行抑制,从而有效缩小肿瘤体积,治疗中,通过间歇重复给药增加剂量,更有利于增强药物对肿瘤细胞的杀伤力[10],因此研究组患者肿瘤标志物水平降低幅度较对照组更为明显。
蒽环类药物化疗产生的不良反应是目前临床面临的难题之一,该药物具有严重的胃肠道毒性与心脏毒性等,在一定程度上降低了患者的生活质量和治疗依从性,表柔比星作为第三代蒽环类半合成化合物,在结构上的细微变化有效降低了药物毒性,特别是消化道毒性、心脏毒性等,促进抗肿瘤活性提升,为增加剂量治疗创造条件[11-12]。高剂量表柔比星相比于常规剂量,能够有效提高三阴性乳腺癌患者的近期治疗效果,且治疗期间未导致中性粒细胞减少等严重不良反应情况的发生,不需要进行骨髓支持性治疗[13]。本研究结果显示,两组患者的各项不良反应发生情况与严重化程度经比较,差异均无统计学意义,提示应用高剂量表柔比星治疗三阴性乳腺癌,不会明显增加患者相关严重性不良反应,且患者耐受性良好。
综上,在TEC方案中,高剂量表柔比星可有效提升三阴性乳腺癌患者的近期治疗效果,降低肿瘤标志物水平,且未见严重性不良反应,值得作为术前新辅助化疗方案进行推广与应用。



