杨 靖,谢 群
(襄阳市中心医院整形美容科 湖北 襄阳 441000)
瘢痕疙瘩是皮肤伤口愈合的病理反应,其特征是成纤维细胞的异常增殖和胶原的过度沉积,临床表现为创面边缘外的持续性肿瘤样增生和邻近组织侵犯。瘢痕疙瘩的复发率高,许多治疗方法包括切除和病灶内注射皮质类固醇疗效不令人满意。因此,亟需寻找有效治疗瘢痕疙瘩的药物。原花青素是从植物中提取出的生物类黄酮,具有强抗炎和抗氧化作用,最早作为抗肝纤维化的药物进行研究,但对瘢痕疙瘩的作用研究尚未报道。在纤维化的发病过程中,静息状态下的造血干细胞在外界因素的刺激下被激活转化为成纤维细胞,并合成和分泌大量的细胞外基质成分(Extracellular matrix components,ECM),导致纤维化。临床研究表明,纤维化通常伴有血清炎性细胞因子水平升高。此外,越来越多的研究表明,脂多糖激活的Toll样受体4(Toll-like receptor 4,TLR4)信号通路在纤维化中起重要作用。TLR4可通过髓样分化因子88(MyD88)蛋白激活核转录因子κB(Nuclear factor kappa B,NF-κB)信号通路,诱导炎症反应。而炎症反应可导致细胞增殖增加,使细胞凋亡紊乱,进一步促进纤维化的发展。因此,本研究检测原花青素对瘢痕疙瘩成纤维细胞(Keloid fibroblasts,KFs)增殖和迁移的影响,并探讨TLR4/MyD88通路在整个过程中的作用,为原花青素治疗瘢痕疙瘩提供理论依据。
1 资料和方法
1.1 主要试剂与仪器:原花青素(中国医学科学院药物研究所);KFs细胞(中国科学院上海细胞库);胎牛血清和DMEM培养液(美国Hyclone公司);四噻唑蓝(MTT)(美国Amresco公司);(Annexin)V-FITC细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司);白介素-23(Interleukin-23,IL-23)、白介素-17A(Interleukin-17A,IL-17A)和白介素-6(Interleukin-6,IL-6)(南京建成生物工程研究所);Trizol(美国Invitrogen公司);mRNA反转录试剂盒和荧光定量PCR试剂盒[宝生物工程(大连)有限公司];RIPA裂解液(北京索莱宝生物技术公司);TLR4、MyD88、NF-κB和β-actin抗体(美国Santa Cruz公司);辣根过氧化物酶标记的IgG(北京中杉金桥生物技术有限公司);ECL化学发光液(美国GE公司);CO细胞培养箱和NanoDrop2000c型蛋白核酸检测仪(美国Thermo公司);HBS-1096B酶标仪(南京德铁实验设备有限公司);Real-time PCR扩增仪(美国ABI公司);流式细胞仪和垂直电泳仪(美国BIO-RAD公司)。
1.2 细胞的培养和原花青素的半数抑制浓度的确定:在37℃、5%CO的条件下用含10%胎牛血清的DMEM培养液培养KFs细胞,当KFs细胞贴壁达到70%左右时进行实验。将KFs细胞接种于96孔板中(5×10个/孔),待细胞贴壁后用不同浓度的原花青素(0、5、10、20、40、80、160mg/L)干预KFs细胞干预20h后加入MTT(20微摩尔/孔),37℃继续培养4h,离心弃上清液,每孔加入200μl二甲基亚砜,振荡10min,用酶标仪测定吸光度值(OD值),计算细胞增殖率[细胞增殖率=(实验组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)],确定原花青素的半数抑制浓度。
1.3 细胞分组:实验将96孔(5×10个/孔)已培养好的KFs细胞随机分为对照组、原花青素低剂量组、原花青素中剂量组和原花青素高剂量组,每组24孔(5×10个/孔)。对照组细胞不进行处理;原花青素低、中、高剂量组分别用终浓度为25、50、100mg/L的原花青素干预KFs细胞,24h后进行相关检测。
1.4 流式细胞术检测细胞凋亡率:将KFs细胞接种于6孔板中(1×10个/孔),待细胞贴壁后按1.3干预KFs细胞24h后收获细胞,分别加入5μl膜联蛋白(Annexin)V-FITC与碘化丙啶,充分混匀后室温避光孵育20min,应用流式细胞仪检测细胞凋亡率。
1.5 细胞划痕法检测细胞迁移能力:将KFs细胞接种于6孔板中(1×10个/孔),待细胞贴壁后,使用100µL移液管的尖端刮擦每个培养板中的细胞层,以划出伤口;将细胞用磷酸盐缓冲液(Phosphate buffer solution,PBS)冲洗划痕,参照1.3中所述干预KFs细胞24h后从每个划痕伤口中随机选择5个视野,用显微镜下拍照,用图像分析仪测量划痕宽度。
1.6 酶联免疫吸附法(Enzyme-linked immuno sorbent assay,ELISA)检测细胞中IL-23、IL-17A和IL-6水平:将KFs细胞接种于6孔板中(1×10个/孔),待细胞贴壁后参照1.3中所述干预KFs细胞24h后收获细胞,加入2ml磷酸盐缓冲液,用细胞超声破碎仪处理30s,离心取上清,按试剂盒说明书检测细胞中IL-23、IL-17A和IL-6水平。
1.7 实时荧光PCR(Real-time fluorescence -PCR,RTPCR)检测细胞中TLR4、MyD88和NF-κB mRNA表达:将KFs细胞接种于6孔板中(1×10个/孔),待细胞贴壁后按1.3干预KFs细胞24h后收获细胞,加入TRIzol进行总RNA提取,根据mRNA反转录试剂盒说明书,将总RNA转化为cDNA,根据荧光定量PCR试剂盒说明,用制备20ul反应体系,反应条件:93℃预变性40s;93℃变性10s,62℃退火1min,72℃延伸45s,共循环50次,最后一个循环后72℃延长7min,采用2法计算TLR4、MyD88和NF-κB mRNA的相对表达量(以β-actin作为内对照)。
1.8 Western Blot法检测KFs细胞中TLR4、MyD88和NF-κB蛋白表达:将KFs细胞接种于6孔板中(1×10个/孔),待细胞贴壁后按1.3干预KFs细胞24h后收获细胞,用PBS洗涤两次,加入RIPA 裂解液(100μl),裂解2h(4℃)离心取上清,得到总蛋白,采用BIO-RAD湿转系统SDS-PAGE 胶进行电泳(20微克/孔),切胶、转膜、封膜后将膜与TLR4(1∶200)、MyD88(1∶400)、和NF-κB(1∶500)进行孵育,过夜(4℃),用辣根过氧化物酶标记的IgG(1∶5 000)在室温下孵育(30min),滴加ECL化学发光液进行显色,采集图像进行分析(以β-actin作为内对照)。
2 结果
2.1 原花青素对KFs细胞增殖的影响:随着原花青素浓度增加,KFs细胞增殖率降低,与0μmol/L比较,差异有统计学意义(<0.05)。当原花青素浓度为40mg/L时,KFs细胞增殖率为41.53%,当原花青素浓度为80mg/L时,KFs细胞增殖率为30.68%,故选50mg/L作为半数抑制浓度(见图1)。
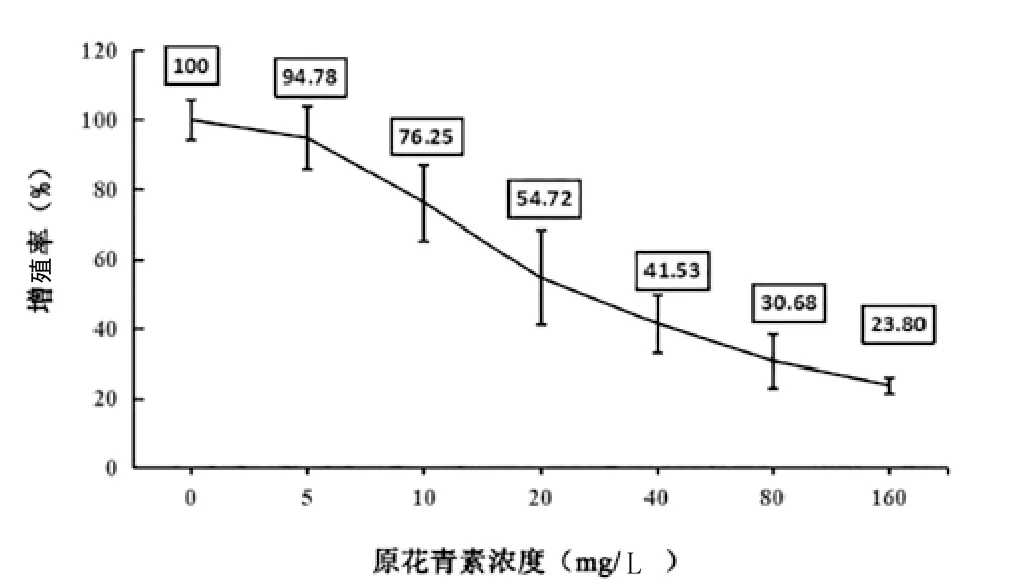
图1 原花青素对KFs细胞增殖的影响
2.2 原花青素对KFs细胞凋亡和迁移的影响:与对照组比较,其余各组细胞迁移距离降低,细胞凋亡率依次增加,且随着原花青素剂量增加,各原花青素剂量组细胞凋亡率和迁移距离呈剂量反应关系,差异具有统计学意义(<0.05)(见表1,见图2~3)。
表1 原花青素对KFs细胞凋亡和迁移的影响 ()
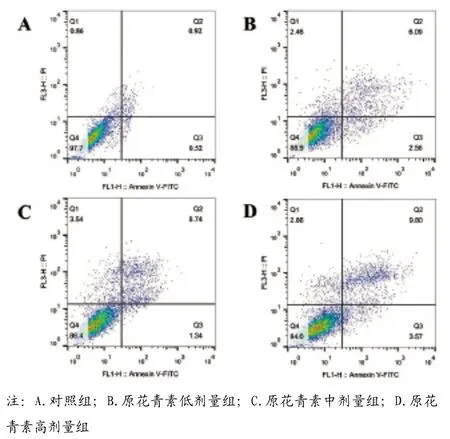
图2 原花青素对KFs细胞凋亡的影响

图3 原花青素对KFs细胞迁移的影响
2.2 原花青素对KFs细胞中IL-23、IL-17A和IL-6水平的影响:与对照组比较,其余各组细胞中IL-23、IL-17A和IL-6水平降低,且随着原花青素剂量增加,各原花青素剂量组细胞中IL-23、IL-17A和IL-6水平呈剂量反应关系,差异具有统计学意义(<0.05)(见表2)。
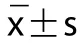
表2 原花青素对KFs细胞中IL-23、IL-17A和IL-6水平的影响()
2.3 原花青素对KFs细胞中TLR4、MyD88和NF-κB mRNA水平的影响:与对照组比较,其余各组细胞中TLR4、MyD88和NF-κB mRNA水平降低,且随着原花青素剂量增加,各原花青素剂量组细胞中TLR4、MyD88和NF-κB mRNA水平呈剂量反应关系,差异具有统计学意义(<0.05)(见表3)。
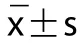
表3 原花青素对KFs细胞中TLR4、MyD88和NF-κB mRNA水平的影响()
2.4 原花青素对KFs细胞中TLR4、MyD88和NF-κB 蛋白水平的影响:与阴性对照组比较,其余各组细胞中TLR4、MyD88和NF-κB蛋白水平降低,且随着原花青素剂量增加,各原花青素剂量组细胞中TLR4、MyD88和NF-κB蛋白水平呈剂量反应关系,差异具有统计学意义(<0.05)(见表4,图4)。
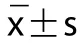
表4 原花青素对KFs细胞中TLR4、MyD88和NF-κB蛋白水平影响()
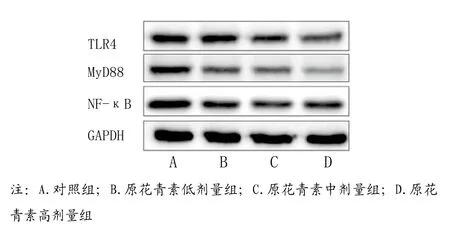
图4 原花青素对KFs细胞中TLR4、MyD88和NF-κB蛋白水平影响
3 讨论
创伤组织修复涉及多种病理机制,包括炎症、组织形成和组织重塑。尽管瘢痕疙瘩是一种良性疾病,但它会侵袭邻近的正常组织,甚至破坏其正常功能,被认为是良性增生性皮肤肿瘤。KFs细胞在细胞增殖、迁移和侵袭中表现异常,并逃避细胞凋亡,在ECM中不成比例地积聚,是临床治疗瘢痕疙瘩的主要难题。炎症微环境是肿瘤相关炎症的一个标志。慢性炎症诱导DNA损伤和突变,导致肿瘤的形成和进展。IL-23是IL-12家族成员,是一种异源二聚体促炎细胞因子,主要由炎性髓细胞产生。IL-23在IL-6和转化生长因子-β(Transforming growth factor-β,TGF-β)存在的情况下,刺激T细胞分化为Th17细胞,能够产生另一种促炎细胞因子IL-17A。IL-17A招募中性粒细胞,促进树突状细胞成熟,并刺激巨噬细胞产生IL-1β和肿瘤坏死因子-α(TNF-α),然后诱导和介导炎症反应。越来越多的研究表明IL-23/IL-17A轴参与肿瘤的生长和转移。此外,IL-23/IL-17A轴可减少CD8+细胞在肿瘤中的浸润,增强调节性T细胞的免疫抑制活性。研究表明,瘢痕疙瘩是慢性炎症长期作用的结果。原花青素具有抗炎、抗氧化和抑制血管生成等药理作用,具有广泛的应用前景,但其药效学基础尚不清楚。本研究结果显示,原花青素显着抑制KFs细胞中IL-23、IL-17A和IL-6水平,同时抑制KFs细胞增殖和迁移,诱导细胞凋亡。
TLR4作为一个重要的信号转导受体,在多种类型的人类癌症中过度表达,如乳腺癌、卵巢癌和前列腺癌。TLR4通过识别病原体相关分子模式(Pathogen associated pattern molecules,PAMPs),如LPS,从而诱导炎症细胞因子的分泌并激活先天免疫系统,抑制TLR4/MyD88通路激活可减弱TLR4与LPS的结合,从而下调下游信使分子和相关炎症基因的表达。同时,TLR4/myd88通路的激活促进了肿瘤的发生和转移。本研究结果显示,原花青素干预能剂量依赖性地抑制了KFs细胞中TLR4和MyD88的表达,表明原花青素的抗炎作用与TLR4/MyD88通路有关。
慢性炎症与纤维化密切相关。在纤维化患者中发现LPS水平升高,LPS激活TLR4通路被证明参与了纤维化的发展。转化生长因子β激活1(Transforming growth factor β-activated kinase 1,TAK1)蛋白是TLR4通路中的关键蛋白,可激活NF-κB信号通路。转录因子NF-κB通路一直被认为是一种典型的促炎信号通路,其主要作用在于上调促炎基因的表达。NF-κB p65和p50亚基组成一个异源二聚体,由LPS等刺激激活通常被定义为典型的NF-κB通路。NF-κB p65/p50异二聚体通常被NF-κB抑制剂(IκBα)隔离在细胞浆中,在LPS刺激下,IκBα被磷酸化和降解,释放p65/p50异源二聚体转运到细胞核并结合NF-κB共识位点,激活炎症反应。TLR4/MyD88通路介导NF-κB的激活以及随后的促炎性细胞因子(包括IL-1β、IL-6和TNF-α)的产生。这些细胞因子刺激髓样树突细胞分泌IL-23,从而促进Th17细胞的增殖和分化。IL-23由p19和p40单元组成,而p19的诱导呈TLR依赖性。本研究结果显示,TLR4/MyD88通路调节KFs细胞中NF-κB表达水平,从而调控IL-23和IL-17A的表达水平。
综上所述,原花青素可能通抑制TLR4/MyD88通路的激活,降低KFs细胞中炎症因子水平,抑制KFs细胞增殖和迁移,同时促进KFs细胞凋亡,为原花青素治疗瘢痕疙瘩提供了一种新的策略。但仍需进行体内实验,评价其临床应用治疗瘢痕疙瘩的有效性和安全性。



