张红飞,张洁雯,孔丽娟,王 乐,朱 宁,郭思超,邱 川,闫雪静,陈梅红
中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系医学分子生物学国家重点实验室,北京100005
TXNDC5最早被认为是硫氧还蛋白 (thioredoxin,Trx)家族的一个新成员[1],绝大多数分布于内质网腔中,也有少部分定位于细胞膜表面,由于其包含蛋白质二硫键异构酶 (protein disulfide isomerases,PDI)家族成员所特有的Trx结构域,因此也被认为是PDI家族成员[2]。TXNDC5具有多种生物学功能,目前认为它可能参与细胞的生长、运动、凋亡、细胞周期调节等多个过程。最新研究发现,TXNDC5在体内可能起压力生存因子、胰岛素调节因子、硝化反应生存因子等的作用[2-6]。TXNDC5在胃癌、肺癌、肝癌等多种人类肿瘤组织中表达上调并且明显促进肿瘤细胞的生长、增殖及迁徙[7-9]。许多研究表明,缺血清能够减少肿瘤细胞的基本活动,促使细胞增殖的同步化,并且缺血清已经成为研究细胞应激反应、凋亡等分子机制的一种常用方法[10-13]。本研究观察了TXNDC5在缺血清对人宫颈癌HeLa细胞系增殖抑制中的作用。
材料和方法
材料HeLa细胞购自中国医学科学院基础医学研究所细胞中心,DMEM(high glucose)培养基、无酚红DMEM培养基购自美国Hyclone(Thermo Scientific)公司,胎牛血清购自德国Biochrom公司,0.5%活性炭吸附胎牛血清购自美国Nalgene公司;SuperScriptTMⅢ Reverse Transcriptase、TRIzolTM、Lipofectamine 2000 Reagent购自美国Invitrogen公司,GoTaq®Probe qPCR Master Mix、CellTiter 96®AQueousOne Solution Cell Proliferation Assay Kit购自美国Promega公司,Pierce®RIPA Buffer、 HaltTMProtease Inhibitor Cocktail、 HaltTMPhosphatase Inhibitor Cocktail购自美国Thermo Scientific公司,Actinomycin D和Cycloheximide购自美国Sigma公司;pCM-H1U6表达载体实验室自建[14];siTX-1、2、3 pCM-H1U6-siTXNDC5表达质粒为实验室自建,其中的siTXNDC5序列购自美国Dharmacon公司 (siTX-1:5’-GCAGAGACCTTGACTCGTA-3’;siTX-2:5’-GGAAT AACCTTCATCAAGA-3’;siTX-3:5’-GGTGATGAAAGC AGCGTTA-3’);Anti-TXNDC5 Goat polyclonal antibody、Anti-β-actin Mouse monoclonal antibody购自英国 Abcam公司,ImmobilonTMWestern Chemiluminescent HRPSubstate购自美国Millipore公司,BioRad iQ5荧光定量PCR仪、半干转膜仪购自美国BIO-RAD公司。
细胞培养和缺血清诱导人宫颈癌HeLa细胞培养于含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2的细胞培养箱中培养,隔2 d换液1次。当将正常培养的HeLa细胞换用含0.5%活性炭吸附胎牛血清的无酚红DMEM培养基进行培养时,即为进行缺血清诱导培养。
细胞转染转染前1 d按细胞数1×105个/孔铺于24孔板各孔中,次日转染时,细胞汇合度达到80%~90%即可转染。采用Lipofectamine 2000转染试剂,分别将各表达质粒转染入HeLa细胞中,具体步骤按说明书操作。在转染后12 h吸弃含10%胎牛血清的DMEM培养基,改为加入500 μl含0.5%活性炭吸附胎牛血清的无酚红DMEM培养基,于37℃、5%CO2的细胞培养箱中继续培养,分别培养0~4 d进行缺血清处理。
放线菌素D处理细胞在HeLa细胞进行正常血清和缺血清诱导培养2 d后,按细胞数5×105个/孔铺板于6孔板各孔中,加入适量的放线菌素D使其终浓度为5 μg/ml。充分混匀后,于37℃、5%CO2的细胞培养箱中继续培养,分别培养0、10、15 h 3个时间点后收集细胞检测。
放线菌酮处理细胞HeLa细胞以2×105个/孔铺板于6孔板各孔中,待细胞贴壁后,加入放线菌酮使其终浓度为1 μg/ml。充分混匀后,于37℃、5%CO2的细胞培养箱中培养1h,然后在放线菌酮存在条件下对细胞进行缺血清诱导培养,分别于缺血清培养0、1、2d 3个时间点收集细胞,采用Western blot法检测TXNDC5蛋白水平。
RNA提取和qRT-PCR离心收集细胞后,用1×PBS重悬细胞清洗3次,弃上清加入1 ml TRIzolTM,按照厂家说明书严格提取高质量总RNA。然后,根据SuperScriptTMⅢ Reverse Transcriptase反转录步骤将所提取的总RNA反转录成cDNA。采用Taq-man探针法,按照GoTaq®Probe qPCR Master Mix说明书配制各反应组分制备成qRT-PCR检测体系,于BioRad iQ5荧光定量PCR仪中检测。以β-actin为内参照基因,采用相对定量方法分析实验数据。
MTS法检测细胞增殖按照说明书操作,具体为:转染24 h后,各组细胞经细胞计数后分别分到96孔板内,每孔1500个细胞重悬于100μl的10% 血清DMEM培养基中。选取转染后经缺血清处理0、1、2、3、4 d这几个时间点的细胞,每组在每个时间点各计数3个复孔分别检测。检测时每孔逐滴加入20 μl的CellTiter96®AQueous One Solution Reagent试剂,其内含1个新型四唑化合物MTS,充分混合均匀后置于37℃、5%CO2的细胞培养箱中孵育3 h,最后用酶联免疫检测仪在492 nm波长处测吸光度A值。每组的3个复孔A值,以含10%血清的DMEM培养基为空白对照调零后取均值。
Western blot检测收集各组细胞并根据细胞的量加入相应量的细胞裂解液和蛋白酶抑制剂、磷酸酶抑制剂,重悬混匀后于冰上振荡15 min,再4℃、15 000×g离心20 min后取上清,Nanodrop测定蛋白浓度。以30 μg/孔总蛋白上样,10%SDS-PAGE凝胶电泳分离,采用半干转膜法将蛋白转移至PVDF膜上,然后5%BSA于摇床上室温封闭2 h。按适宜比例用5%BSA稀释配制一抗,4℃孵育过夜,TBST漂洗10 min/次共3次,再用HRP标记的二抗于摇床上室温孵育2 h,TBST漂洗10 min/次共3次,最后于暗室内用ECL发光试剂盒曝光X光片、显影并定影。
流式细胞术检测细胞周期转染后48 h收集各组细胞,PBS洗3遍,用-20℃预冷的70%乙醇重悬细胞,4℃固定过夜。1000×g离心5 min,弃上清,4℃预冷的1×PBS洗1次。加入RNase,使其终浓度为100 μg/ml,37℃细胞培养箱中孵育30 min。加入250 μl的1×PBS稀释过的 PI染色,使其终浓度为50 μg/ml,37℃孵育20 min。加1×PBS使其总体积为500 μl。细胞经过滤网过滤后于流式细胞仪上机检测。
流式细胞术检测细胞凋亡采用Annexin V FITC/PI双染法,收集转染12 h后撤血清处理的1 d各组细胞,1×PBS洗2遍后用100 μl的1×Binding Buffer悬浮细胞,分别加入5 μl Annexin V-FITC和5 μl PI(同时做以FITC单染及PI单染的阴性对照,未染组做空白对照),轻轻混匀后置于室温下避光孵育15 min。加入400 μl 1×Binding Buffer,经过滤网过滤后于流式细胞仪上机检测。
统计学处理采用SPSS 13.0统计软件,数据以平均值±标准差表示,组间资料比较采用方差分析LSD检验,P<0.05为差异有统计学意义。
结 果
缺血清上调TXNDC5蛋白水平正常培养的HeLa细胞经缺血清诱导培养1~3 d后,HeLa细胞增殖受到抑制;而当缺血清3 d后再加入血清进行正常培养4 h后,细胞逐步恢复正常增殖 (图1A)。qRT-PCR结果显示,在缺血清后1 d时,TXNDC5 mRNA水平明显下降 (P<0.05)(图1B)。缺血清后TXNDC5的蛋白水平升高 (图1C)。
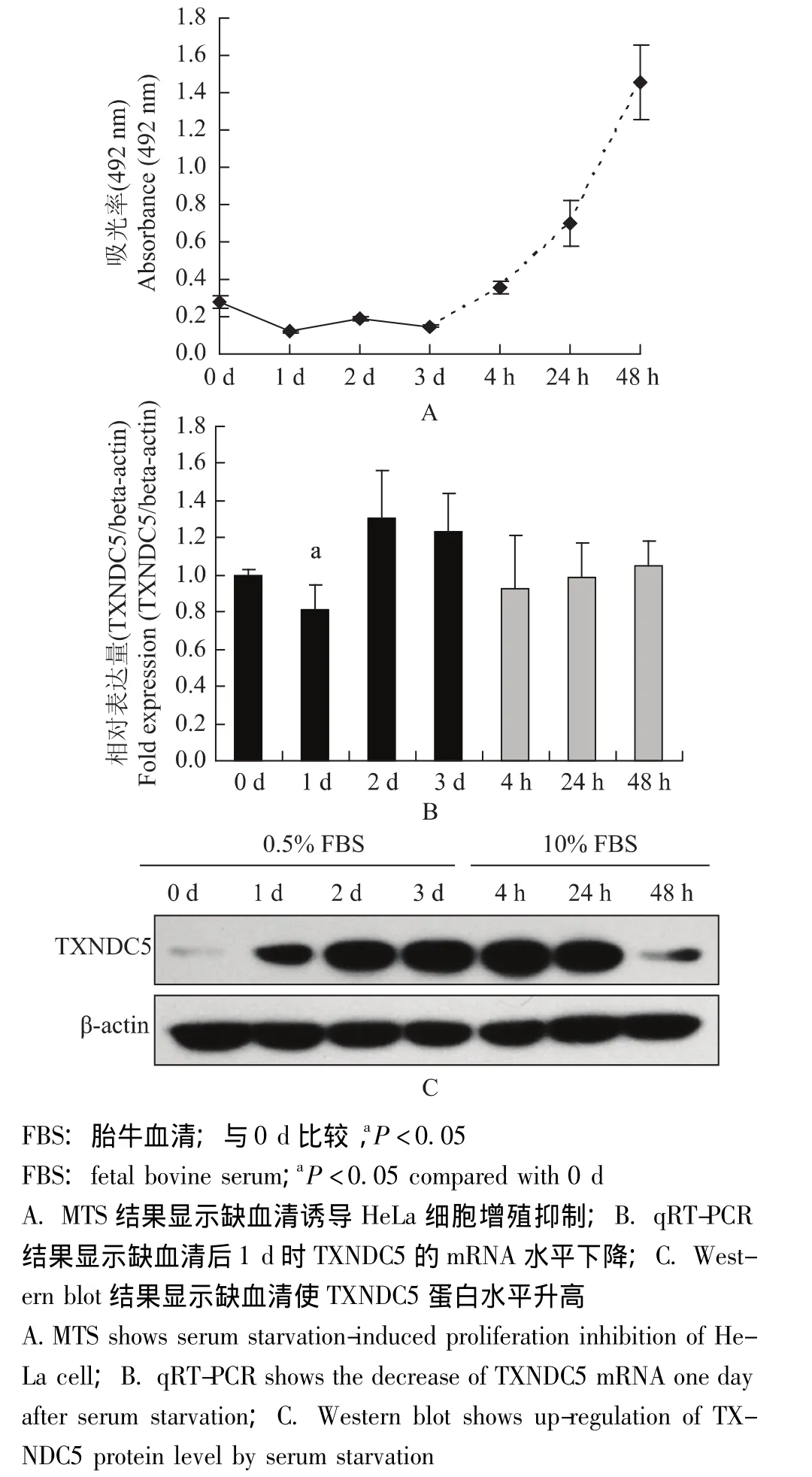
图1 缺血清对HeLa细胞增殖和TXNDC5的mRNA和蛋白水平的影响Fig 1 Effect of serum starvation on HeLa cell proliferation and the mRNA and protein level of TXNDC5
缺血清不影响TXNDC5 mRNA的半衰期HeLa细胞经正常和缺血清诱导培养2 d后,加入放线菌素D处理0、10、15 h收细胞总RNA,qRT-PCR结果显示,与正常培养组相比,缺血清组细胞中TXNDC5 mRNA的稳定性没有变化 (图2)。
在放线菌酮存在时缺血清不能诱导TXNDC5蛋白水平的升高在放线菌酮存在条件下进行缺血清诱导培养,分别于缺血清培养0、1、2 d收集细胞,提取蛋白进行Western blot检测,结果显示在放线菌酮存在时进行缺血清培养,TXNDC5的蛋白水平无变化(图3)。
在血清充足条件下TXNDC5的水平对HeLa细胞的增殖无明显影响正常培养的HeLa细胞瞬时转染pcDNA3.1-TXNDC5质粒24 h后,TXNDC5的蛋白水平显着升高 (图4A),但TXNDC5过表达对HeLa细胞的增殖没有影响 (图4B)。当细胞瞬时转染siTXNDC5-1、siTXNDC5-2和 siTXNDC5-3表达质粒72 h后,TXNDC5的蛋白水平明显降低 (图4C)。与转染空载体对照组相比,转染siTXNDC5-1和siTXNDC5-3组细胞在第3天时细胞数减少,转染siTXNDC5-1和siTXNDC5-2组细胞在第4天时细胞数减少 (图4D),3个siTXNDC5中仅siTXNDC5-1可使细胞增殖速度略有减慢,siTXNDC5-2和siTXNDC5-3仅在1个时间点的细胞数有所减少,其对细胞增殖速度的影响不大。
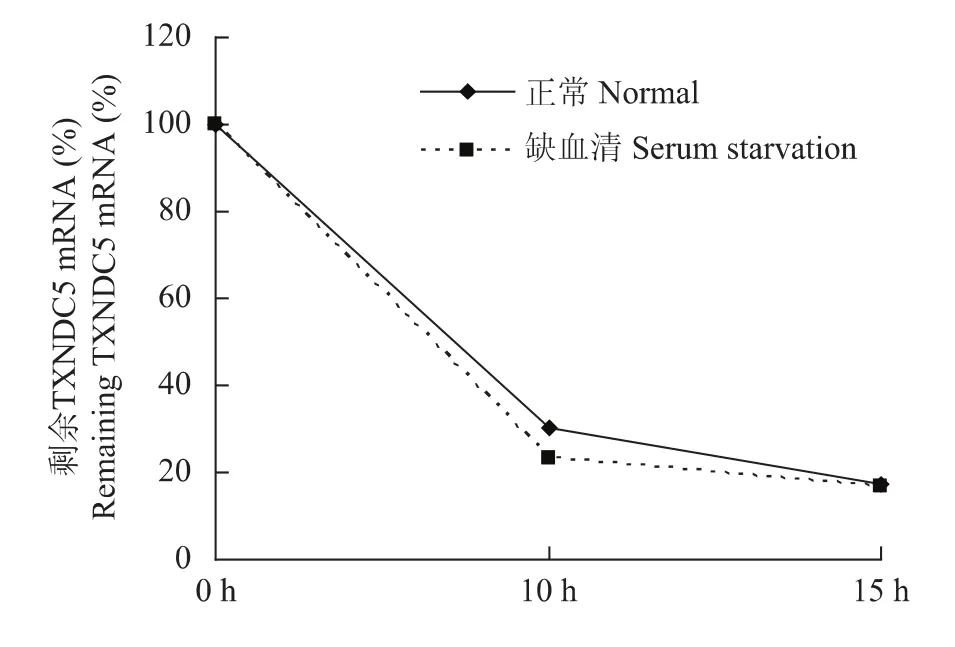
图2 缺血清对TXNDC5 mRNA稳定性的影响Fig 2 Effect of serum starvation on the stability of TXNDC5 mRNA

图3 放线菌酮存在时缺血清对TXNDC5蛋白水平的影响Fig 3 Effect of serum starvation on the expression level of TXNDC5

图4 TXNDC5的表达水平对HeLa细胞增殖的影响Fig 4 Effect of TXNDC5 expression level on HeLa cell proliferation
抑制TXNDC5的表达减弱缺血清诱导的HeLa细胞增殖抑制正常培养的HeLa细胞瞬时转染pCMH1U6-siTXNDC5质粒12 h后,再缺血清培养0~3 d,Western blot检测结果显示,缺血清条件下TXNDC5的表达逐步被抑制 (图5A);与对照组相比,随着TXNDC5表达的抑制,缺血清诱导的细胞增殖抑制也相应减弱 (图5B);转染pCM-H1U6-siTXNDC5质粒12 h后再缺血清诱导1 d后,流式细胞术检测结果表明抑制TXNDC5的表达使S期细胞比例略有增加 (图5C),而对细胞凋亡无明显影响 (图5D)。

图5 抑制TXNDC5的表达对缺血清诱导的HeLa细胞增殖抑制的影响Fig 5 Effect of TXNDC5 knockdown on serum starvation-induced HeLa cell proliferation inhibition
讨 论
本研究结果显示,在HeLa细胞中,缺血清诱导TXNDC5的蛋白水平显着升高,而TXNDC5的mRNA水平却没有明显升高,甚至在缺血清的第1天还略有降低。缺血清并不影响TXNDC5 mRNA的稳定性,表明TXNDC5蛋白水平的升高并非是由于mRNA的转录或稳定性增强所致。在蛋白翻译抑制剂放线菌酮存在的条件下,缺血清则不能诱导TXNDC5蛋白水平的升高,显示缺血清可能主要通过增强TXNDC5的翻译而上调其蛋白水平。细胞在缺血清时会产生应激反应,使许多基因的表达被抑制,在缺血清的第1天TXNDC5的mRNA略有降低,可能就是这种应激反应的表现。而一些在应激中发挥作用的基因,例如凋亡相关基因则在应激时仍能保持高的翻译效率[15]。缺血清的第1天TXNDC5的mRNA略有降低,而此时TXNDC5的蛋白水平却明显升高,提示在缺血清的应激反应中,TXNDC5是细胞活动所必需的基因,可能参与介导细胞的应激反应。
此外本研究还发现,TXNDC5过表达对缺血清抑制HeLa细胞增殖的作用无影响,推测原因可能是因为缺血清已使细胞中的TXNDC5蛋白水平大幅升高,此时外源性表达的TXNDC5的作用在大量内源性TXNDC5的掩盖下很难表现出来。抑制TXNDC5的表达则使缺血清抑制HeLa细胞增殖的作用减弱,表现为当TXNDC5的表达被抑制后,缺血清时处于S期的细胞比例增加。而在血清充足条件下,过表达TXNDC5对HeLa细胞的增殖速度无影响,抑制TXNDC5也只是轻微减小HeLa细胞的增殖速度。Chang等[16]报道抑制TXNDC5的表达使HeLa细胞增殖速度减慢,减慢的幅度虽然不大但比本研究的结果要显着。推测原因可能是,Chang等[16]使用的是化学合成的TXNDC5 siRNA,且只有1条siRNA,而本研究采用载体表达的3种不同的TXNDC5 siRNA,这两种方法中阴性对照组和实验组设置的不同。但Chang等[16]的结果与本研究结果都显示,在血清充足条件下,抑制TXNDC5的表达即使能减慢HeLa细胞的增殖速度,其作用也是比较微弱的,而这与本研究中在缺血清条件下,抑制TNXDC5的表达能加快HeLa细胞增殖速度的结果是相反的,显示TXNDC5在血清充足和缺乏条件下发挥了不同的作用。
研究显示,TXNDC5在绝大部分肿瘤中表达上调,且与肿瘤细胞增殖侵袭迁移和凋亡密切相关[7-8],可能具有癌基因的作用。也有文献报道,缺氧能诱导TXNDC5表达升高从而有利于细胞在压力环境下的存活,说明TXNDC5在压力条件下发挥作用[2,17]。本研究结果发现,缺血清诱导人宫颈癌HeLa细胞中TXNDC5的表达升高,TXNDC5介导了缺血清诱导的HeLa细胞增殖抑制作用。可能在血清充足的条件下,肿瘤细胞内表达上调的TXNDC5促进细胞增殖和侵袭的恶性表型,而当血清缺乏时,肿瘤细胞内TXNDC5的蛋白水平进一步大幅升高,反而使细胞增殖速度降低。肿瘤在体内由于生长迅速,经常会遇到缺氧、缺血等压力环境,在血清充足时肿瘤细胞生长加快,而在压力环境中肿瘤细胞的增殖减慢,等待环境条件好转后恢复增殖,体现出肿瘤细胞具有较强的自我保护和存活能力。本研究结果显示,HeLa细胞在含5%血清的低血清培养基中,增殖速度明显减慢,但不发生凋亡,一旦血清供应恢复,HeLa细胞重新进入快速增殖状态。TXNDC5在血清充足条件下促进细胞增殖和在缺血清条件下介导细胞增殖抑制的作用提示,TXNDC5可能在肿瘤细胞自我保护和存活中起重要作用。
[1]Knoblach B,Keller BO,Groenendyk J,et al.ERp19 and ERp46,new members of the thioredoxin family of endoplasmic reticulum proteins[J].Mol Cell Proteomics,2003,2(10):1104-1119.
[2]Sullivan DC,Huminiecki L,Moore JW,et al.EndoPDI,a novel protein-disulfide isomerase-like protein that is preferentially expressed in endothelial cells acts as a stress survival factor[J].J Biol Chem,2003,278(47):47079-47088.
[3]Morand JP,Macri J,Adeli K.Proteomic profiling of hepatic endoplasmic reticulum-associated proteins in an animal model of insulin resistance and metabolic dyslipidemia [J].J Biol Chem,2005,280(18):17626-17633.
[4]Alberti A,Karamessinis P,Peroulis M,et al.ERp46 is reduced by high glucose and regulates insulin content in pancreatic beta-cells [J].Am J Physiol Endocrinol Metab,2009,297(3):E812-E821.
[5]Chen DL,Xiang JN,Yang LY.Role of ERp46 in beta-cell lipoapoptosis through endoplasmic reticulum stress pathway as well as the protective effect of exendin-4 [J].Biochem Biophys Res Commun,2012,426(3):324-329.
[6]Komatsubara AT,Asano T,Tsumoto H,et al.Proteomic a-nalysis of S-nitrosylation induced by 1-methyl-4-phenylpyridinium(MPP+)[J] .Proteome Sci,2012,10(1):74.
[7]Zhang L,Hou Y,Li N,et al.The influence of TXNDC5 gene on gastric cancer cell [J].J Cancer Res Clin Oncol,2010,136(10):1497-1505.
[8]Vincent EE,Elder DJ,Phillips L,et al.Overexpression of the TXNDC5 protein in non-small cell lung carcinoma [J].Anticancer Res,2011,31(5):1577-1582.
[9]Nissom PM,Lo SL,Lo JC,et al.Hcc-2,a novel mammalian ER thioredoxin that is differentially expressed in hepatocellular carcinoma [J].FEBS Lett,2006,580(9):2216-2226.
[10]Van Rechem C,Boulay G,Pinte S,et al.Differential regulation of HIC1 target genes by CtBP and NuRD,via an acetylation/SUMOylation switch,in quiescent versus proliferating cells[J].Mol Cell Biol,2010,30(16):4045-4059.
[11]Codeluppi S,Gregory EN,Kjell J,et al.Influence of rat substrain and growth conditions on the characteristics of primary cultures of adult rat spinal cord astrocytes [J].J Neurosci Methods,2011,197(1):118-127.
[12]Levin VA,Panchabhai SC,Shen L,et al.Different changes in protein and phosphoprotein levels result from serum starvation of high-grade glioma and adenocarcinoma cell lines[J].J Proteome Res,2010,9(1):179-191.
[13]Balsalobre A,Damiola F,Schibler U.A serum shock induces circadian gene expression in mammalian tissue culture cells [J].Cell,1998,93(6):929-937.
[14]Chen M,Zhang L,Zhang HY,et al.A universal plasmid library encoding all permutations of small interfering RNA [J].Proc Natl Acad Sci USA,2005,102(7):2356-2361.
[15]Spriggs KA,Bushell M,Mitchell SA,et al.Internal ribosome entry segment-mediated translation during apoptosis:the role of IRES-trans-acting factors [J].Cell Death Differ,2005,12(6):585-591.
[16]Chang X,Xu B,Wang L,et al.Investigating a pathogenic role for TXNDC5 in tumors [J].Int J Oncol,2013,43(6):1871-1884.
[17]Wang L,Zheng Y,Xu H,et al.Investigate pathogenic mechanism of TXNDC5 in rheumatoid arthritis[J].PLoS One,2013,8(1):e53301.



