张倩文 王爽 祝颖 刘泽媛 余波 王斌
(青岛大学基础医学院,山东 青岛 266071)
人巨细胞病毒(HCMV)是一种普遍存在的病原体,属于β疱疹病毒亚科,人群中的潜在感染率很高[1]。潜伏感染几乎不会对健康个体造成严重威胁,但是在免疫功能低下的人群中如器官或造血干细胞移植者中,感染了HIV或患有淋巴细胞白血病的患者中[2],先天性感染HCMV的新生儿中[3],则会导致病毒活化和各种HCMV相关疾病[4-7],增加家庭和社会的经济负担。目前抗HCMV的药物副作用较大,也没有相应的疫苗被批准上市[8-9]。研究发现HCMV可编码大量病毒包膜蛋白[10],其中gB和gH蛋白是两种主要的糖蛋白,是病毒侵入细胞的必需蛋白[11],也是抗病毒抗体应答的重要靶点,这两个蛋白的被关注度最高[12]。目前亚单位疫苗针对gB蛋白研究较多,较少有将gH蛋白作为目标蛋白的研究。HCMV PP65蛋白是病毒支架蛋白,是病毒被膜中含量最丰富的成分[13],在调节病毒激酶活性以及减弱宿主抗病毒反应中均发挥重要作用[14-15],也是T细胞应答的主要靶点,在HCMV疫苗中可作为T细胞诱导的亚单位[16-19]。本研究利用生物信息学方法对gH和PP65蛋白的B、T细胞优势抗原表位进行预测,为HCMV亚单位疫苗的研发提供有价值的理论依据。
1 材料与方法
1.1 gH和PP65蛋白的二级结构预测
首先从NCBI蛋白质数据库(https://www.ncbi.nlm.nih.gov/protein/)中获得gH和PP65蛋白的氨基酸序列。利用在线分析软件SOMPA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)[20]对gH和PP65蛋白的二级结构进行分析,计算α-螺旋、β-转角、β-折叠和无规卷曲所占比例,明确β-转角及无规卷曲所在位点。
1.2 gH和PP65蛋白B细胞抗原表位预测
利用软件ABCpred(http://crdd.osdd.net/raghava/abcpred/)、BCPREDS(http://ailab-projects1.ist.psu.edu:8080/bcpred/index.html)[21]以及BepiPred(http://www.cbs.dtu.dk/services/BepiPred/)[22]预测gH和PP65蛋白的B细胞抗原表位。对3个软件预测结果中得分最高的前10个表位(如预测结果小于10个表位,则选择所有表位)进行重叠,结合蛋白二级结构分析结果,得到gH以及PP65蛋白的B细胞抗原表位。
1.3 gH和PP65蛋白T细胞抗原表位预测
利用软件NetMHC 4.0 Server(http://www.cbs.dtu.dk/services/NetMHC/)[23-24]和IEDB(http://tools.iedb.org/mhci/)中的consensus方法[25]预测gH和PP65蛋白的CD8+T细胞抗原表位,等位基因选择A1、A2、A3、A11和A24(CPF88.1%)[26],对预测为strong binders和consensus score≤2的表位进行进一步分析。选择两个软件预测结果中的重叠表位作为蛋白的CD8+T细胞抗原表位。
再使用软件NetMHCⅡ 2.3 Server(http://www.cbs.dtu.dk/services/NetMHCⅡ/)[27]和NetMHCⅡpan 4.0 Server(http://www.cbs.dtu.dk/services/NetMHCⅡpan/)[28]预测gH和PP65蛋白的CD4+T细胞抗原表位,等位基因选择DRB1*0101、DRB1*0301、DRB1*0401、DRB1*0701、DRB1*0801、DRB1*1101、DRB1*1301和DRB1*1501[29],对预测为strong binders的表位进行进一步分析。选择两个软件预测结果中的重叠表位作为蛋白的CD4+T细胞抗原表位。
1.4 抗原性分析
将上述得到的B细胞、CD8+T细胞以及CD4+T细胞的抗原表位利用软件VaxiJen v.2.0 Server(http://www.ddg-pharmfac.net/vaxijen/VaxiJen/VaxiJen.html)进行抗原性分析,“TARGET ORGANISM”选择病毒,阈值设为0.4,排除抗原性差的表位,获得B、T细胞优势抗原表位。
2 结 果
2.1 gH和PP65蛋白的二级结构
gH蛋白氨基酸序列(ACL51144.1)全长共含有743个氨基酸;PP65蛋白氨基酸序列(ACL51152.1)全长含有561个氨基酸。gH蛋白二级结构的分析结果显示,α-螺旋约占33.24%,β-折叠约占22.61%,β-转角约占3.63%,无规卷曲约占40.51%,其中β-转角和无规卷曲所在位点为2~7、33~37、45~49、54~69、83~87、93~96、128~133、145~165、172~195、200~203、209~214、219~224、240~246、252~255、260~266、272~277、284~296、328~337、353~363、386~393、410~418、429~437、460~464、479~482、495~498、510~516、520~530、543~549、560~568、572~579、584~587、599~606、619~636、642~648、659~664、681~685、690~693、700~703、714~718(图1A)。PP65蛋白二级结构的分析结果显示,α-螺旋占19.07%,β-折叠占23.71%,β-转角占4.28%,无规卷曲占52.94%,其中β-转角和无规卷曲所在位点为3~9、15~20、28~39、44~46、51~54、61~74、83~88、95~109、116~125、129~143、170~179、189~196、232~239、247~252、257~271、276~279、283~288、297~300、306~312、316~325、340~343、359~368、386~407、413~418、421~441、446~473、484~489、495~497、503~512、515~519、529~551、554~561(图1B)。
2.2 gH和PP65蛋白的B细胞抗原表位预测结果
将ABCpred、BCPREDS和BepiPred在线软件预测结果重叠后共得到2个gH蛋白B细胞抗原表位,再结合二级结构中β-转角和无规卷曲所在位点进行分析,得到gH蛋白B细胞抗原表位,其氨基酸位点为179~186,所对应的氨基酸序列为KGSHTTSG;同样通过上述3个软件预测的PP65蛋白B细胞抗原表位共6个,再结合二级结构分析中

A:gH蛋白,B:PP65蛋白,图中h为α-螺旋,c为无规卷曲,e为β-折叠,t为β-转角图1 gH和PP65蛋白的二级结构分析结果
β-转角和无规卷曲所在位点进行分析,得到PP65蛋白B细胞抗原表位,其氨基酸位点分别为257~262、390~397、391~404、427~441和533~548,对应的氨基酸序列分别为TRNPQP、EGAAQGDD、GAAQGDDDVWTSGS、AGASTSAGRKRKSAS、PAAQPKRRRHRQDALP。
2.3 gH和PP65蛋白的T细胞抗原表位预测结果
2.3.1gH和PP65蛋白CD8+T细胞抗原表位预测结果 综合在线软件NetMHC 4.0 Server和IEDB中的consensus方法的预测结果,得到gH和PP65蛋白的CD8+T细胞抗原表位分别为34和10个,各等位基因及其对应的位点及氨基酸序列见表1~2。

表1 gH蛋白的CD8+T细胞抗原表位预测结果
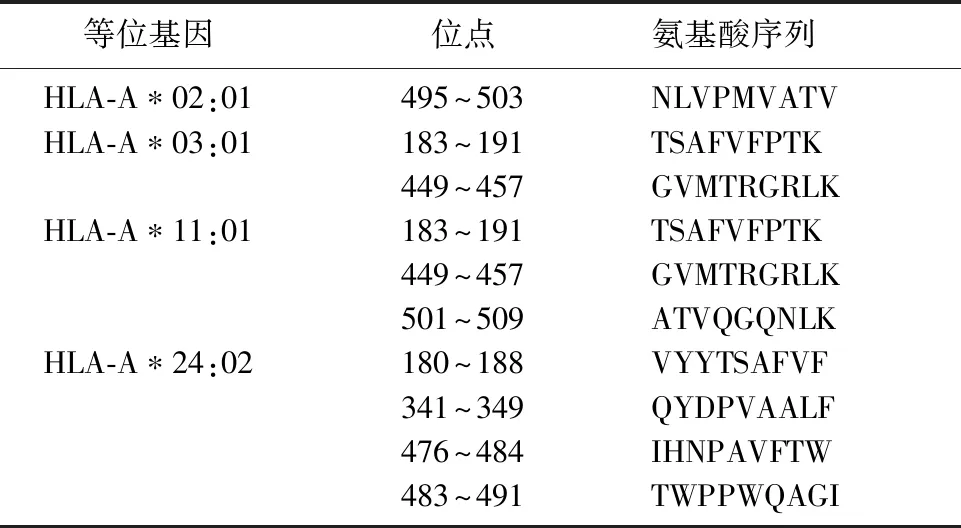
表2 PP65蛋白的CD8+T细胞抗原表位预测结果
2.3.2gH和PP65蛋白CD4+T细胞抗原表位预测结果 综合在线软件NetMHCⅡ2.3 Server和NetMHCⅡpan 4.0 Server分析蛋白的CD4+T细胞抗原表位结果,得到gH和PP65蛋白的CD4+T细胞抗原表位分别为32和8个,具体等位基因及其对应的位点和氨基酸序列见表3~4。

表3 gH蛋白的CD4+T细胞抗原表位预测结果
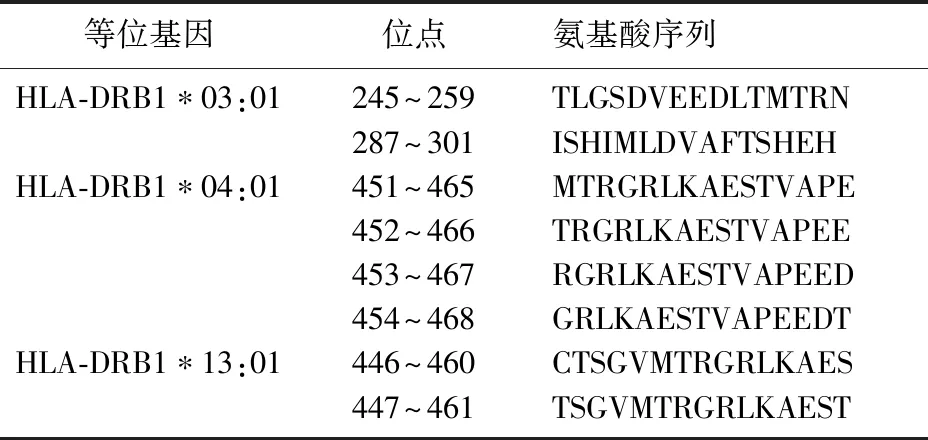
表4 PP65蛋白的CD4+T细胞抗原表位预测结果
2.4 gH和PP65蛋白各抗原表位的抗原性分析
利用软件VaxiJen v.2.0 Server对上述得到的B细胞、CD8+T细胞及CD4+T细胞抗原表位进行抗原性分析,排除抗原性较差的表位后,结果显示,gH蛋白有20个CD8+T细胞优势抗原表位,15个CD4+T细胞优势抗原表位,1个B细胞优势抗原表位,PP65蛋白有8个CD8+T细胞优势抗原表位,8个CD4+T细胞优势抗原表位,3个B细胞优势抗原表位,各优势抗原表位的等位基因及其对应的位点、氨基酸序列及抗原性得分见表5~7。

表5 gH和PP65蛋白的B细胞优势抗原表位

表6 gH和PP65蛋白的CD8+T细胞优势抗原表位
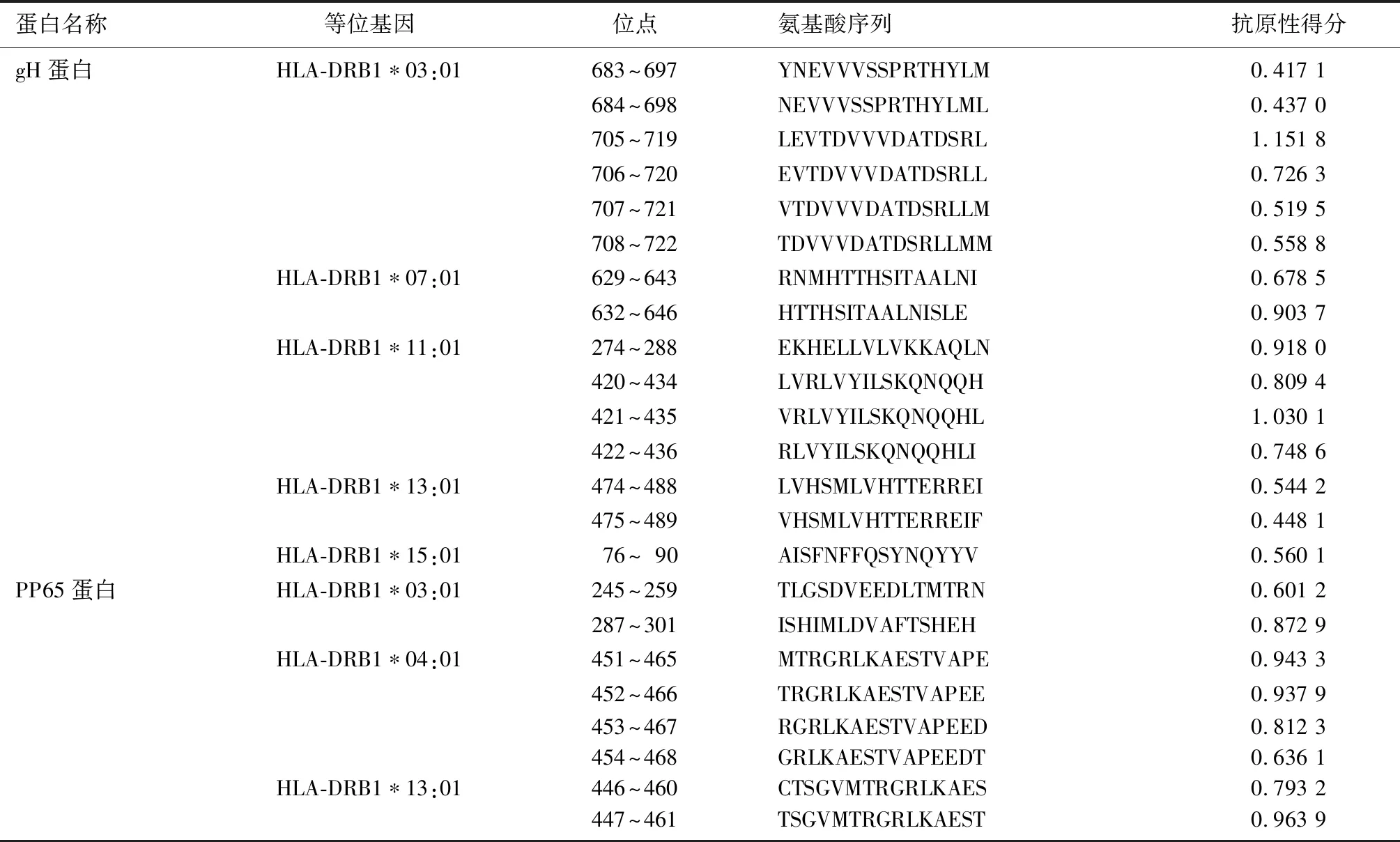
表7 gH和PP65蛋白的CD4+T细胞优势抗原表位
3 讨 论
随着生物信息学技术的快速发展,在诊断试剂制备和多肽疫苗合成的前期工作中,多利用分子生物学辅助软件进行蛋白抗原表位的预测,比用传统实验方法更省时高效。PP65蛋白中的495~503抗原表位与gB蛋白中的607~621抗原表位即是首先通过生物信息学预测得到的,然后再重组成蛋白,发现可诱导小鼠产生较强的体液免疫和细胞免疫反应[30],证明通过生物信息学方法预测抗原表位具有一定的可靠性。
二级结构是B细胞表位的基础。在蛋白质的二级结构中α-螺旋和β-折叠对蛋白质骨架起到稳定的作用,而β-转角和无规卷曲多位于蛋白质表面,结构松散,易发生扭曲,成为抗原表位的可能性较大。因此本研究在预测B细胞抗原表位时以无规卷曲和β-转角作为B细胞抗原表位的候选区域。
T细胞抗原表位主要是由组织相容性复合体(MHC)Ⅰ类分子和Ⅱ类分子提呈,并分别被CD8+T细胞和CD4+T细胞识别。因此,本研究在预测T细胞抗原表位时分别对CD8+和CD4+T细胞抗原表位进行了预测分析。
不同的抗原分子激活免疫应答时需要不同的基因位点进行提呈,但是人群HLA的遗传背景复杂,因此本研究选择了具有代表性的等位基因,即5个MHC-Ⅰ类分子等位基因A1、A2、A3、A11和A24以及8个MHC-Ⅱ类分子等位基因DRB1*0101、DRB1*0301、DRB1*0401、DRB1*0701、DRB1*0801、DRB1*1101、DRB1*1301以及DRB1*1501[26],预测了不同等位基因的抗原表位,克服了HLA的遗传限制,实现了较高的人群覆盖率。为避免单独一种分析软件预测抗原表位的局限性和提高结果的准确性,本研究采用了多个生物信息学的软件同时进行了分析预测,以各结果的重叠表位作为优势抗原表位。
研究发现,HCMV的gB和gH蛋白是抗病毒抗体应答的重要靶点,但Ⅰ期和Ⅱ期临床试验显示,gB蛋白亚单位疫苗与佐剂MF259(为水包角鲨烯乳剂配方,由角鲨烯、Tween280和Span285等组成)在体内产生的抗体应答短暂,仅能够维持几个月[31],因此本研究着重分析了gH蛋白的抗原表位。PP65是CD4+T细胞及CD8+T细胞的主要识别位点,在细胞免疫反应中发挥重要作用。本研究目的是通过生物信息学方法分析预测出产生抗体应答的重要靶点蛋白gH蛋白和产生细胞免疫反应的PP65蛋白的优势抗原表位,以期能够用于HCMV亚单位疫苗的研究,但这些表位是否可以产生体液和细胞免疫反应,还需要通过体外和体内的免疫激活实验进行验证。
综上所述,gH蛋白有20个CD8+T细胞优势抗原表位,15个CD4+T细胞优势抗原表位,1个B细胞优势抗原表位,PP65蛋白有8个CD8+T细胞优势抗原表位,8个CD4+T细胞优势抗原表位,3个B细胞优势抗原表位,且都具有良好的抗原性。



