袁璐萍 马炬明
·实验研究·
在动物模型脏器中动态追踪荧光染料标记的目标细胞
袁璐萍马炬明
目的 利用染料羧基荧光素二乙酸盐琥珀酰亚胺酯(CFDA-SE)标记细胞,通过测定荧光信号强度计算细胞数量,作为追踪移植细胞进入模型动物体内后分布情况的方法。方法 采用CFDA-SE标记不同类细胞,荧光显微镜计数染色率,台盼蓝计数存活率,酶标仪检测荧光信号,确定不同种类、同种细胞不同状态下及模拟动物体内细胞数与荧光信号之间的线性关系,制作标准曲线,确定利用该染料作细胞计数的可行性。将CFDA-SE标记细胞经脾脏注入小鼠体内,于3h、6h、12h、24h处死小鼠,检测肝脏信号,根据标准曲线定量计算肝脏内该细胞动力学特征。结果 CFDA SE标记细胞后,荧光信号与细胞数相关性较好,24h内随时间增加荧光信号有所增高,但与细胞数相关性不受影响。加入小鼠内脏组织匀浆后,荧光信号值有所降低,但与细胞数的相关性不受影响。结论 CFDA-SE可标记活细胞,操作简单,标记率高,注入体内后,通过严格制作标准曲线,检测脏器荧光信号,可定量确定细胞在体内脏器的的动态分布,方法简单可靠。
细胞示踪 羧基荧光素二乙酸盐琥珀酰亚胺酯 荧光信号
体内活细胞示踪方法是细胞生物学研究的重要手段,常用的标记方法有免疫组织化学、荧光染料、基因标记法、染色体标记、放射性同位素标记及磁性标记等[1]。上述方法通常可以将目标细胞在脏器组织中精确定性及定位,但是难以精确定量。羧基荧光素二乙酸盐琥珀酰亚胺酯(CFDA-SE)是一种可穿过细胞膜的荧光染料,具有与细胞结合特异性的琥珀酰亚胺酯基团与具有非酶促水解作用的羧基荧光素二醋酸盐基团结合在一起可使CFDA SE成为一种良好的细胞标记物[2]。CFDA SE具有染色方法简单易行,阳性率高,观察结果直观可靠,现已应用于标记血细胞并成功的用于移植细胞的定位及标记[3]。本实验旨在确定一种简单的定量动态追踪CFDA SE标记移植细胞在体内分布的实验方法,为下一步细胞治疗提供研究方法。
1 材料与方法
1.1试剂与仪器 荧光染料 CFDA-SE(上海碧云天生物技术有限公司),一次性塑料培养瓶,无菌15ml离心管等(美国CORNING 公司),低速离心机(RJTDL-50A型,常州诺基仪器有限公司),超净工作台(苏州净化设备有限公司)。荧光酶标仪(Thermo 公司 Varioskan Flash型,浙江省中医院)。Ficoll Paque Piumin(1.077g/ml)(GE 公司)。培养液、血清、胰酶、PBS等(浙江杭州吉诺生物医药技术有限公司)。A549,HepG2(中科院上海细胞库)。
1.2实验动物 健康SPF级ICR小鼠16只,6~8周,雄性,其中细胞移植12只,盐水对照组4只。购于浙江省医学科学院。实验过程中对动物的处置符合2006年科技部《关于善待实验动物的指导性意见》的规定。
1.3方法 (1)细胞培养:A549、HepG2细胞用含10% 胎牛血清的 DMEM 培养基在CORNING T75 培养瓶中贴壁培养,5%二CO237℃培养箱内培养。4瓶贴壁培养细胞至 90% 融合时,吸出培养液,8ml PBS 洗2遍,加入4ml胰酶/EDTA 消化液,显微镜下观察大部分细胞明显收缩或脱离培养表面,加入6ml 完全培养液终止消化反应,调整细胞浓度备用。(2)CFDA SE染色标记细胞:CFDA SE用二甲亚砜配成5 mmol/ L,分装后于-20℃冷冻保存,每次使用一管新解冻保存液。一定量细胞悬液加入1/10体积5mmol/L浓度的CFDA SE染色,37℃孵育15min,加入40%体积胎牛血清再孵育15min终止染色,PBS 离心洗涤2次。荧光显微镜计数染色率,台盼蓝染色检测细胞存活率,调整细胞浓度至5×107/ml备用。(3)酶标仪测定:细胞计数后,以生理盐水做梯度稀释,样品以100μl量置于96孔酶标板中,按酶标仪工作程序运行,96孔板以 488nm/518nm 波长检测荧光信号,确定细胞量与荧光信号关系,24h后重复测试3次。(4)细胞移植:实验小鼠左侧胸腹部位除毛,左肋缘下切口长约1cm切开皮肤及肌肉层,牵拉脾脏下极于切口外。用透明塑料管连接TB针头和250μl微量注射器,抽取100μl CFDA SE染色细胞悬液。TB针头穿刺脾脏下极深入约0.5cm,在2min内缓慢注入细胞悬液,注射完毕后针头再在脾脏中滞留1min,拔针后脾脏穿刺点用冻干纤维蛋白胶5μl滴注止血。CFDA SE标记的A549悬液100μl,含5×106个细胞;盐水对照组小鼠同法注入等量生理盐水。剩余染色细胞在动物注射后不同时间点绘制标准曲线。动物注射细胞3h、6h、12h、24h断颈处死,取肝脏,用4%福尔马林液做匀浆,肝脏制成匀浆10 ml。96孔荧光酶标板中每孔以50μl组织匀浆加50μl生理盐水混匀,测定荧光信号值。另取正常小鼠肝脏以10ml 4%福尔马林液制成匀浆,以一定数量的染色细胞做梯度稀释,每孔50 μl正常肝组织匀浆加50μl染色细胞混匀,测定信号值并制作标准曲线。样品测定信号值按标准曲线计算每孔染色细胞数,并根据每孔样品所用匀浆量占总匀浆量的比例,推算该时间点该脏器占所注射细胞的百分比。每一时间点重复测定3次,依据各时间点肝脏中染色细胞量与注射细胞总量的百分比绘制各组动物肝脏中染色细胞驻留百分比动态曲线。
2 结果
2.1染色细胞荧光强度检测 染色细胞经台盼蓝染色,普通显微镜观察细胞存活率>99%。在荧光酶标仪中以激发光 488nm发射光518nm 检测荧光信号,荧光信号与细胞数相关性较好,加入小鼠内脏组织匀浆后,荧光信号值有所降低,但与细胞数的相关性不受影响。不同细胞类型信号值和细胞数相关性不同,故每种细胞需单独作标准曲线,不可相互替代。(1)两种不同细胞细胞量与荧光信号值的关系:将两种染色细胞分别用生理盐水做梯度稀释,测定荧光信号值,制作信号与细胞数量相关性曲线见图1。(2)染色后福尔马林固定对荧光信号值的影响:以A549细胞在样品准备完毕后不同时间点测定信号值,制作信号值与细胞数量相关性曲线见图2。(3)同一细胞不同染色时间测定对荧光信号值的影响:见图3。(4)同一细胞不同染色背景下测定对荧光信号值的影响:见图4。
2.2动物内染色细胞数量的动态检测 根据以上在不同条件下CFDA-SE 染色细胞荧光信号的检测结果,可以通过设置严格的对照用来测定动物脏器内的染色细胞总量。(1)根据标准曲线样品信号值绘制的各时间点标准曲线见图5。(2)根据标准曲线可以确定样品荧光信号值与匀浆中染色细胞的数量关系如下:Y=aX+b每孔样品中染色细胞数量X=(Y-b)/a,整个肝脏中染色细胞数=X匀浆使用量比例。此处实验动物匀浆制作量10ml,测定使用 50μl肝组织匀浆+50μlPBS,则整个肝脏中染色细胞数量=200X。计算各组织不同时间点滞留细胞占注入细胞百分比。根据各时间点测定实验动物肝组织匀浆中信号计算得到染色细胞量的动态曲线见图6。
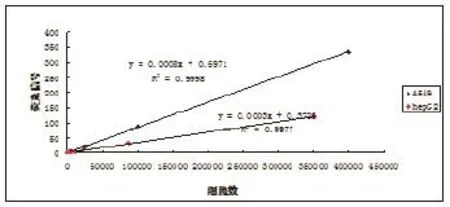
图1 不同细胞细胞量与荧光信号关系
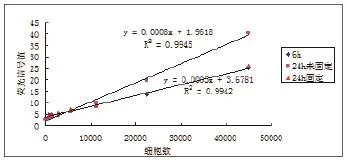
图2 A549染色后福尔马林固定对细胞数与荧光信号的关系
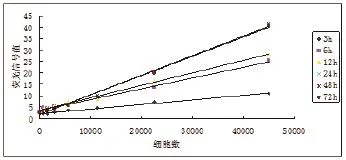
图3 同一细胞染色后不同时间细胞数与荧光信号的关系
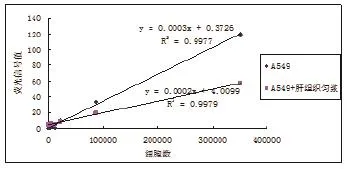
图4 染色A549不同背景下细胞量与荧光信号关系
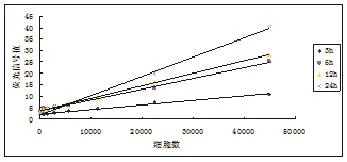
图5 不同时间点样品标准曲线
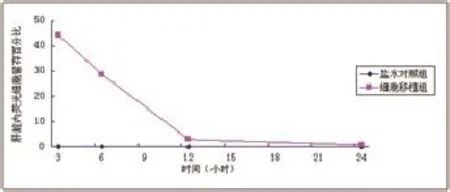
图6 A549注入小鼠体内后肝脏内动态分布
3 讨论
本实验结果显示,CFDA SE标记细胞仅需5~15min即可完成,但细胞24h内信号在不断升高,24~72h后信号未见增加。CFDA SE是一种活细胞荧光染料,可自发不可逆地通过赖氨酸侧链或其他可利用的胺,偶联到细胞蛋白质上,染料进入细胞后并非立刻达到完全的信号峰值。染色过程终止后,随着时间的推移,荧光信号仍会不断增强。经过最初的一段平衡时间(24 h),CFDA SE标记的静止细胞的荧光可在长达几个月的时期内保持稳定[4~8],但是将染色细胞以福尔马林固定后,信号值不再继续增强,提示细胞内转化染料的酶失活。对于不同细胞,能够进入单个细胞的染料总量和染料与蛋白结合的速度可能均不同[9,10],但活体上无法固定,因此要计数脏器内的染色细胞数量,只能采用每个时间点固定细胞加组织匀浆的办法均做标准曲线来精确定量。为保证标准曲线的准确性,须保证每次染色步骤一致,且不同细胞需单独作标准曲线。
一个脏器中荧光染色细胞的多少,可能主要取决于进来和出去细胞的数量和速度。对于某种特定细胞而言,这种积累还可能和细胞表面与组织器官表面特定的信号系统有关,即在一定情况下,某些细胞可以特异性积聚在某些脏器,如间充质干细胞可以大量积累在损伤的肝脏或心肌组织内。作者用间充质干细胞做类似工作,发现24h内肝组织内荧光信号分布情况与A549有明显不同,但结果仍在进一步验证中。
本实验成功追踪了经脾脏注入的CFDA SE标记细胞在小鼠肝脏动态分布,建立了一种简单的定量动态追踪移植细胞在体内分布的实验方法,为下一步细胞治疗提供研究方法。但这一方法在灵敏度上还有欠缺,无法用来做类似于药代动力学研究的结果,无法确定其进入人体后的分布方式、存活时间、转归等。本实验虽然可用于动物模型中相对精确地定量分析治疗细胞在某一特定脏器中的动态分布特征,但对于治疗细胞在全身分布的研究并不适用,而且这种创伤性的方法并不适合于在人体中用。因此,对上述问题的进一步探讨,仍需寻找更加敏感和安全的方法。
1 Schormann W,Hammersen FJ,Brulport M,et al.Tracking of human cells in mice, Histochem Cell Biol,2008,130(2):329~338.
2 Hoefel D, Grooby WL, Monis PT, et al. A comparative study of carboxyfluorescein diacetate and carboxyfluorescein diacetate succinimidylester as indicators of bacterial activity. J Microbiol Methods,2003, 52(3):379~388.
3 Inge Jedema, Nicole M, van der Werff, et al. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population.Blood,2003,103(7): 2677~2682.
4 Dumitriu IE, MohrW, KolowosW, et al.5 , 6-carboxyfluorescein diacetate succinimidyl ester-labeled apoptotic and necrotic as well as detergent-treated cells can be traced in composite cell samples. Anal Biochem,2001,299(2): 247~252.
5 Oostendorp RA, Audet J, Eaves CJ. High-resolution tracking of cell division suggests similar cell cycle kinetics of hematopoietics tem cells stimulated in vitro and in vivo J Blood,2000,95(3): 855~862.
6 De Boer RJ, Ganusov VV, Milutinovic D, et al. Estimating lymphocyte division and death rates from CFSE data. Bull Math Biol,2006,68(5):1011~1031.
7 Urbani S, Caporale R, Lombardini L, et al. Use of CFDA-SE for evaluating the in vitro proliferation pattern of human mesenchymal stem cells. Cytotherapy,2006,8(3):243~253.
8 Liu D, Yu J, Chen H, et al. Statistical determination of threshold for cellular division in the CFSE-labeling assay. J Immunol Methods,2006,312(1~2):126~136.
9 Asquith B, Debacq C, Florins A, et al. Quantifying lymphocyte kinetics in vivo using carboxyfluorescein diacetate succinimidyl ester (CFSE). Proc Biol Sci,2006,273(1590):1165~1171.
10 Petersen MS, Petersen CC, Agger R, et al. A simple method for unbiased quantitation of adoptively transferred cells in solid tissues. J Immunol Methods,2006,309(1~2):173~181.
Objective To develop a simple method for dynamic tracking and quantitative analysis of transplanted cells inside the body of animal experimental. Method Cells were labeled with Carboxyfluorescein diacetate,succinimidyl ester(CFDA-SE)and the fluorescent signal were measured using. The relationship between cell number and the signal intensity of different cell lines were investigated,and the cell amount within an organ can thus be calculated. The method was verifi ed in animal model. CFDA-SE labeled A549 and HepG2 cells were injected into the spleen of mouse model of acute liver injury induced with CCl4. The fl uorescent signal were measured at 3,6,12,24 hours after cell injection. The feature of transplanted cell distribution was determined by calculating the percentage of CFDA-SE stained cell retained within the liver. Result There was very good linear correlation between signal intensity and cell number. For a single cell,the fl uorescent signal would keep on increasing during the fi rst 24 hours,but the correlation between signal and cell numbers would not be affected. After the stained cells were mixed with tissue homogenate,the signal could be inhibited in some degree,but the correlation between signal intensity and cell numbers would still not be affected. Conclusion The cell number can be calculated using the fl uorescent signal of the CFDA-SE labeled cells within a special organ in animal model. It is a simple method with high accuracy for monitoring the dynamic distribution of transplanted cell in the organs of animal model.
Cell tracking CDFA-SE Fluorescent signal
浙江省年度重大科技专项计划项目(2011C130291-1)
310000 杭州萧山区第一人民医院(袁璐萍)
310013 杭州 中国人民解放军第117医院(马炬明)



