李太勇 姜辉★ 方烨 李娟
老年脑梗死患者血尿酸水平与颈动脉硬化及颅内动脉血流动力学变化的相关性研究
李太勇 姜辉★ 方烨 李娟
目的 探讨老年脑梗死患者血尿酸(UA)水平与颈动脉硬化及颅内动脉血流动力学变化之间的关系。方法 住院治疗>60岁脑梗死患者186例,记录临床资料,测定血尿酸,根据尿酸水平,分为高尿酸血症组(104例)及尿酸正常组(82例),比较两组的基线资料、临床特征及颈动脉彩色多普勒(CDFI)及经颅多普勒(TCD)检查结果,并分析颈动脉硬化的影响因素。另选40例健康体检老年人作为对照组。结果 高尿酸血症组患者颈动脉内中膜厚度及颈动脉斑块发生率明显高于尿酸正常组和对照组(P<0.05),尿酸增高组颈动脉内中膜厚度较对照组明显增加(P<0.05),脑梗死尿酸增高组患者颈总动脉和颈内动脉收缩期峰值血流速度(PSV)、舒张末期血流速度(EDV)、血流最大剪切率(SR)减少,低于对照组(P均<0.01),血管阻力指数(RI)较对照组明显增大(P<0.05)。结论 老年脑梗死患者存在颈动脉结构及血流动力学改变,且颈动脉硬化程度与高尿酸有关。提示高尿酸血症是动脉硬化的独立危险因素。彩色多普勒及经颅多普勒联合检测对预防脑梗死的发生、判断预后、指导早期治疗具有重要作用。
脑梗死 高尿酸血症 颈动脉 彩色多普勒 经颅多普勒
随着人们生活水平的提高以及饮食结构的改善,我国高尿酸血症和动脉硬化的发病率均逐年上升。研究表明,>60岁的老年人随着年龄的增高,患高尿酸血症的比例也逐渐升高[1]。尿酸增高可诱发或加重动脉粥样硬化,是心脑血管疾病的危险因素[2]。由于颈动脉粥样硬化时颈动脉内膜中层厚度(IMT)改变早于斑块发生,临床上采用颈动脉超声测量IMT反映动脉硬化程度[3]。目前有关高血糖、高血脂、高血压等与IMT的相互关系报道较多,但老年脑梗死患者合并高尿酸血症是否会导致IMT的增加,加重动脉粥样硬化的相关研究报道较少[4]。因此,本研究旨在通过分析老年脑梗死患者血尿酸水平与颈动脉硬化及颅内动脉血流动力学变化之间的关系,了解尿酸增高对颈动脉粥样硬化的影响,为老年脑梗死患者病情评估及判断预后、指导早期治疗提供参考依据。
1 临床资料
1.1 一般资料 选取2006年1月至2014年6月本院门诊和住院患者中随机选择年龄>65岁的脑梗死患者186例为观察对象,其中男105例,女81例;年龄65~86岁,平均(67.36±2.12)岁。全部病例均经头颅CT和MRI确诊。收集纳入对象吸烟、高血压病史、糖尿病史等临床资料。根据尿酸水平分为:高尿酸血症组104例,其中男58例,女46例;平均年龄(68.38±3.27)岁。尿酸正常组82例,其中男47例,女35例;平均年龄(66.74±1.16)岁。选取门诊体检健康的老年人40例为对照组,其中男18例,女22例;年龄65~81岁,平均年龄(68.53±3.13)岁。
1.2 方法 (1)生化检查:入院次日早晨(24 h内)空腹肘静脉采血,送本院实验室,全自动生化仪测定UA、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)的浓度。高尿酸血症患者符合以下诊断标准[5]:1980年全国正常人血清尿酸水平调查均值男≥420μmol/L,女≥360μmol/L,其余为正常。(2)颈动脉超声(CDFI):采用美国GE公司LOGIQ9彩色多普勒超声诊断仪,周围血管探头频率为7.5MHz。被检者取仰卧位,头略向后仰。检测颈总动脉、颈内动脉内径及IMT,并观察有无斑块形成及斑块性质。选取双侧颈总动脉远段及颈内动脉近段距离分叉膨大部均为1.0~1.5 cm处血管壁,分别测量动脉前、后壁内膜表面间的垂直距离及管腔内膜界面与IMT[1]。颈动脉IMT正常值<1.0mm,1.0mm≤IMT≤1.5mm为内中膜增厚。管壁不规则隆起增厚,IMT≥1.5mm,且凸向管腔的局部结构变化,视为粥样硬化斑块形成。分别计算各组受检者颈动脉斑块检出率。(3)经颅彩色多普勒超声(TCD):采用丹麦TC2020型经颅多普勒超声诊断仪,探头频率为2MHz,测量颈总动脉(CCA)和颈内动脉(ICA)、大脑中动脉(MCA)的收缩期峰值血流速度(PSV)、舒张末期血流速度(EDV)、血管阻力指数(RI),应用下列公式:血流最大剪切率(SR)=峰值流速×2/血管半径(D/2),计算SR。
1.3 统计学方法 采用SPSS 13.0统计软件。计量资料以(±s)表示,两组均数比较采用t检验,计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 基线特征 186例患者中发现高尿酸血症患者共104例(55.91%),两组之间比较,高血压、糖尿病及UA、总胆固醇、甘油三酯差异有统计学意义(P<0.05)。两组性别、年龄、吸烟、HDL-C和LDL-C差异无统计学意义(P>0.05),见表1。
表1 各变量基线特征比较(±s)
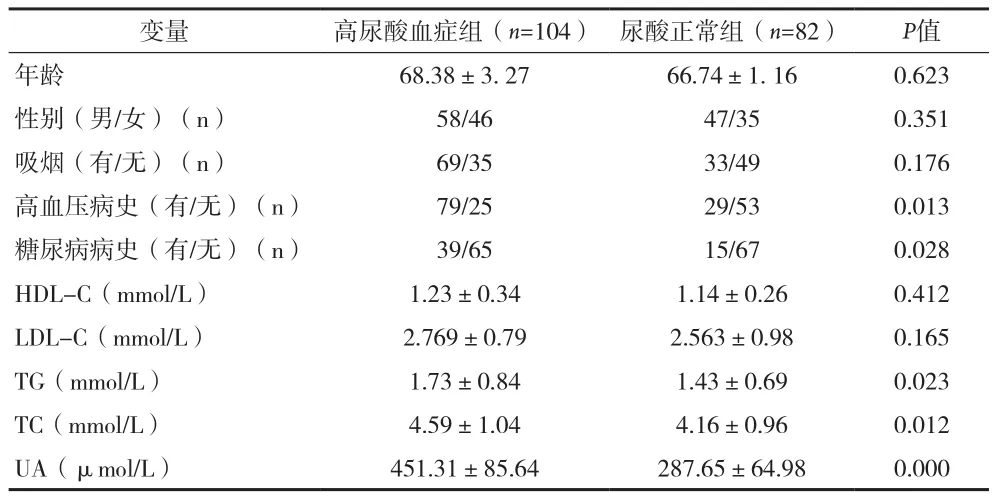
表1 各变量基线特征比较(±s)
变量高尿酸血症组(n=104)尿酸正常组(n=82)P值年龄68.38±3. 2766.74±1. 160.623性别(男/女)(n)58/4647/350.351吸烟(有/无)(n)69/3533/490.176高血压病史(有/无)(n)79/2529/530.013糖尿病病史(有/无)(n)39/6515/670.028 HDL-C(mmol/L)1.23±0.341.14±0.260.412 LDL-C(mmol/L)2.769±0.792.563±0.980.165 TG(mmol/L)1.73±0.841.43±0.690.023 TC(mmol/L)4.59±1.044.16±0.960.012 UA(μmol/L)451.31±85.64287.65±64.980.000
2.2 CDFI检测结果 186例脑梗死患者中发现颈动脉斑块153例(82.26%)。其中,尿酸增高组104例中92例检出有颈动脉斑块,检出率88.46%;尿酸正常组检出率74.39%(61/82);对照组检出率17.5%(7/40)。与对照组比较,脑梗死组颈总动脉内径逐渐增大,尿酸增高组增大更明显,后者与对照组比较差异有统计学意义(P<0.05),尿酸增高组IMT较正常对照组明显增加(P<0.05),见表2。另外,颈动脉斑块组的年龄与血尿酸水平显着高于非斑块组(P<0.01),见表3。
表2 各组间颈总动脉、颈内动脉内径、IMT及斑块检出例数比较[mm,(±s)]
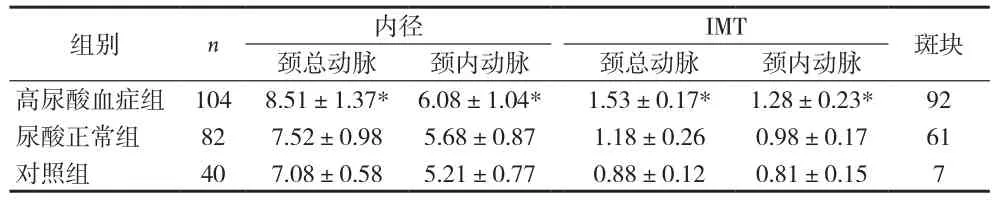
表2 各组间颈总动脉、颈内动脉内径、IMT及斑块检出例数比较[mm,(±s)]
注:与对照组比较,*P<0.05
组别n内径IMT斑块颈总动脉颈内动脉颈总动脉颈内动脉高尿酸血症组1048.51±1.37*6.08±1.04*1.53±0.17*1.28±0.23*92尿酸正常组827.52±0.985.68±0.871.18±0.260.98±0.1761对照组407.08±0.585.21±0.770.88±0.120.81±0.157
表3 颈动脉斑块与年龄、尿酸关系的分析比较(±s)

表3 颈动脉斑块与年龄、尿酸关系的分析比较(±s)
危险因素斑块组(n=153)无斑块组(n=82)P值年龄(岁)76.58±1.1766.54±1.060.003尿酸(μmol/L)350.11±95.64247.15±69.180.000
2.3 TCD检测结果 与对照组比较,脑梗死尿酸增高组患者颈总动脉和颈内动脉PSV、EDV、SR减少,RI增大,两组间差异有统计学意义(P均<0.01),见表4、5。脑梗死患者中,尿酸增高组MCA血流速度均明显慢于尿酸正常组(P<0.01,P<0.05),而反映血管阻力指标的RI则相反,尿酸增高组明显高于尿酸正常组,差异有统计学意义(P<0.05)。见表6。
表4 各组间PSV、RI之间的比较(±s)
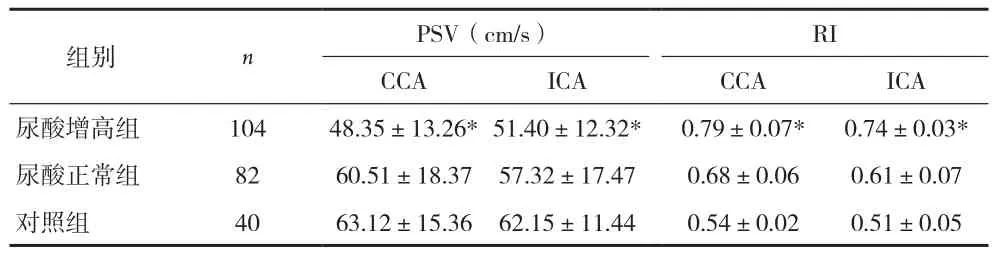
表4 各组间PSV、RI之间的比较(±s)
注:与对照组比较,*P<0.05
组别nPSV(cm/s)RI CCAICACCAICA尿酸增高组10448.35±13.26*51.40±12.32*0.79±0.07*0.74±0.03*尿酸正常组8260.51±18.3757.32±17.470.68±0.060.61±0.07对照组4063.12±15.3662.15±11.440.54±0.020.51±0.05
表5 各组EDV、SR之间的比较(±s)

表5 各组EDV、SR之间的比较(±s)
注:与对照组比较,*P<0.01
组别nEDV(cm/s)SR(s)CCAICACCAICA尿酸增高组10428.16±10.36*27.42±11.14*214.1±81.32*253.54±99.12*尿酸正常组8234.54±16.1736.42±14.07258.75±76.49301.62±91.48对照组4046.15±10.3645.19±12.44307.35±105.13331.74±111.59
表6 两组脑梗死患者MCA血流参数值±s)
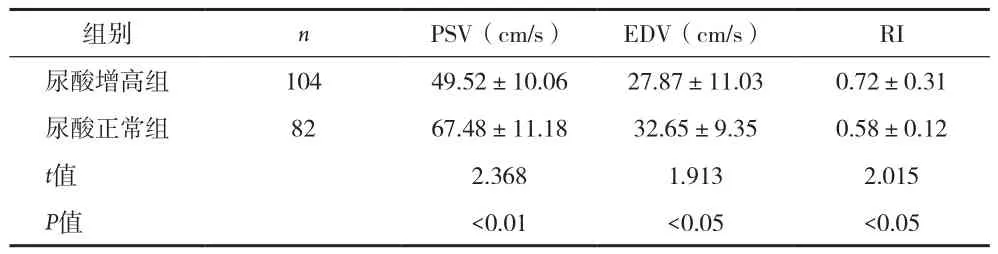
表6 两组脑梗死患者MCA血流参数值±s)
组别nPSV(cm/s)EDV(cm/s)RI尿酸增高组10449.52±10.0627.87±11.030.72±0.31尿酸正常组8267.48±11.1832.65±9.350.58±0.12 t值2.3681.9132.015 P值<0.01<0.05<0.05
3 讨论
目前脑梗死病因临床上以动脉粥样硬化最为常见,占全部的75%左右。其中,颈动脉粥样硬化斑块形成是缺血性脑梗死的一个重要因素[6]。本资料中,脑梗死患者颈动脉粥样硬化斑块的发生率为82.26% (153/186)。
动脉粥样硬化危险因素包括高血压、糖尿病、高血脂症、吸烟和年龄。本资料结果显示,186例脑梗死患者中高尿酸血症检出率为55.91%(104/186),在脑梗死高尿酸血症组中,颈动脉斑块检出率为88.46% (92/104),较其他两组均明显增高。此外,还发现颈动脉斑块组的年龄与血尿酸水平显着高于非斑块组(P<0.01),表明高尿酸血症与脑梗死有关。曾有国外研究发现,人类动脉粥样斑块中有较高的尿酸水平,提示尿酸可能参与了血管炎症反应,对动脉粥样硬化形成有直接作用[7]。美国学者采用CT检测冠状动脉钙化的方法评估亚临床动脉硬化,发现高尿酸血症是亚临床动脉硬化的一个独立危险因子[8]。由于颈动脉粥样硬化时IMT改变早于斑块发生,临床上通过超声测量颈动脉IMT反映全身动脉硬化的一个“窗口”[9]。美国国家心肺和血液研究所(NHLBI)进行的一项纳入4866例参与者的大型研究中发现,与心血管的危险因素相似,尤其是在男性人群中,血尿酸增高与颈动脉IMT有着显着相关[10]。国内研究结果显示在排除高血压、高血脂、高血糖后,高尿酸血症患者IMT较健康人增加,且随着IMT增厚程度的增加,血尿酸水平相应增高。本资料结果显示,高尿酸血症组颈动脉IMT较尿酸正常组增加,较正常对照组则明显增加(P<0.05),说明高尿酸血症可能会引起颈动脉IMT的增加,导致或加重动脉粥样硬化。侯蕾蕾等[11]进行Meta分析后,提出高尿酸血症是动脉硬化的一个重要危险因素,尿酸可促进动脉硬化的进展并加重其程度。尿酸增高是动脉粥样硬化的独立危险因素之一,与冠心病、心肌梗死、脑卒中等心脑血管事件发生率、病死率呈正相关[12]。高尿酸血症引起或加重动脉硬化的程度,其原因与可溶性尿酸可直接损害血管,并导致动脉硬化有关。吴振等[13]研究发现,高浓度尿酸盐可直接引起血管内皮细胞的损伤。另一方面,尿酸盐结晶可引起炎症反应,直接造成内皮细胞损伤,释放多种与动脉硬化发生密切相关的炎症因子,引起动脉硬化。
脑梗死的发生、发展及预后与脑血流的变化密切相关。高剪切力能防止动脉粥样病变的发生[14]。动脉水平的剪切力有诱导内皮细胞的抗粥样硬化基因的表达,而低的剪切应力部位多易于发生且刺激该处内皮细胞基因的表达。研究发现健康男性剪切力与颈动脉IMT厚度有关。IMT与PSV及SR呈负相关,与颈总动脉内径呈正相关,表明SR的降低是颈动脉粥样硬化的重要危险因素[15]。本资料结果显示颈总动脉和颈内动脉PSV、EDV、SR下降,高尿酸血症组各指标较对照组明显降低,表明低剪切力是动脉粥样硬化形成的主要危险因素。颅外段颈动脉粥样硬化病变导致动脉弹性下降,顺应性降低,由于EDV下降,必然会影响远端组织的血供。根据血流动力学原理,血流速度与远端的血管阻力成反比,且RI是反映动脉硬化、血管外周阻力的有效指标。随着血管阻力增高,动脉弹性逐渐降低。研究结果显示高尿酸血症组颈总动脉和颈内动脉RI较对照组明显增大,说明脑梗死患者尿酸增高组脑血管阻力明显增高,这与文献报道一致[16]。
综上所述,高尿酸血症可诱发和加重颈动脉硬化疾病,提示高尿酸血症是动脉粥样硬化的重要危险因素之一。早期降低血尿酸水平可使IMT减小,减少动脉粥样硬化的发生,同时通过颈动脉彩色多普勒及经颅多普勒联合检测能比较准确的判断颅内外动脉病变情况,这对预防脑梗死的发生、判断预后、指导早期治疗具有重要参考价值。
1 Ward HJ.Uric acid as an independent risk factor in the treatment of hypertension .Lancet, 1998,352(9129): 670~671.
2 翁玮.高血压伴高尿酸血症与冠心病发生的相关关系.实用医药杂志,2010,27(2):121.
3 Freedman DS, Wi11ianmson DF, Gunter EW, et a1. Serum uric acid and risk for cardiovascu1ar disease and death. Am J Epidemio1,1995, 141(7):637~644.
4 王运良,曾志磊,张晓席,等.血尿酸水平对急性缺血性卒中患者血管再通和梗死体积的影响.实用医药杂志,2014,31(1):3~5.
5 叶任高.内科学.第六版.北京:人民卫生出版社,2005.865.
6 Yen Y,Doroshow J,Leong L,et a1.PhaseⅡstudy of oxa1ip1atin in patients with unresectab1e,metastatic or recurrent hepatoce11u1ar cancer. Proceedings of ASCO,2004,22(14S): 4169.
7 Suarna C,Dean RT,May J,et a1.Human atherosc1erotic p1aque contains both oxidized 1ipids and re1ative1y 1arge amounts ofα-tocophero1 and ascorbate.Arteriosc1er Thromb Vasc Bio1,1995,15(10):1616~1624.
8 Krishnan E,Pandya BJ,Chung L,et a1.Hyperuricemia and the risk for subc1iuica1 coronary atherose1erosis-data from a prospective observationa1 cohort study.Arthritis Res Ther,2011,13(2):R6.
9 林曙光.当代心脏病学新进展.北京:人民军医出版社,2011.297~300.
10 Tuhina N,Curtis E11ison R,Stenen H.Serum uric acid is associated with carotid p1aques: The Nationa1 Heart,Lung,and B1ood InstituteFami1y Heart Study.J Rheumato,2009,36(2): 378~384.
11 侯蕾蕾,贺圣文,张东方.高尿酸血症与动脉粥样硬化关系的Meta分析.预防医学论坛,2012,18(2):81~84.
12 Ishizaka N,Ishizaka Y,Toda E,et a1.Association between serumuric acid,metabo1ic syndrome and carotid atherosc1erosis in Japanese individua1s .Arttriosc1er Thromb Vasc Bio1,2005,25(13): 1038.
13 吴振,王颜刚,于江苏.尿酸盐致血管内皮细胞损伤的机制.中国分子心脏病学杂志,2012,12 (1): 43~46.
14 Zarins CK,Bomberger RA,G1agov S.Loca1 effects of stenosis:increased f1ow ve1ocity inhibits atherosc1erosis.Circu1ation,1981,64(supp1Ⅱ):221~227.
15 郭晓丽,杨彩军.缺血性脑血管病颈动脉粥样硬化与血流动力学等相关因素关系分析.中国现代医药杂志,2009,11(2):62~64.
16 穆玉明,韩伟,吴伟春.颈动脉结构及血流动力学变化与缺血性脑血管病的相关性研究.中国医学影像技术,2003,19(5):1499~1501.
Objective To investigate the relationship between serum uaic acid(UA)level and carotid artery arteriosclerosis and blood hemodynamics changes of intracranial arteries in elder patients with cerebral infarction. Methods A total of 186 cases of cerebral infarction patients aged 60 years or older who were admitted to our hospital,were selected as study subjects,clinical information was recorded,levels of serum UA were measured.According to the Results of UA,patients were divided into two groups as hyperuricemia group(104 cases)and normal uric acid group(82 cases).40 healthy people were selected as control group.The basal data,clinical feature and color doppler flow imaging(CDFI)and transcranialdoppler(TCD)results were compared between the two groups.the influencing factors for carotid artery arteriosclerosis were analyzed. Results The carotid artery intima-media thickness(IMT),the incidencerate of plaque in hyperuricemia group was higher than without hyperuricemia group and control group(P<0.05).IMT in the patient with hyperuricemia group was higher than it in the normal control group (P<0.05).the PSV,EDV,SR were significantly lower than that in control group(P<0.01).RI was higher than in control group(P<0.05). Conclusion Hyperuricemia is a major risk factor for carotid artery IMT hyperplasia and the development of plaquea theromatous of cerebral infarction. And it influence on intracranial artery blood flow.It plays an important role in preventing the occurrence of cerebral infarction,and predicting prognosis and guiding the early treatment by use of CDFI and TCD.
Cerebral infarction Hyperuricemia Carotid arteries Color doppler flow imaging Transcranial Doppler
430070 广州军区武汉总医院干部病房一科



