王力捷 金成华⋆ 沈韦羽
胸腔镜下肺叶切除已经成为治疗肺癌、肺转移瘤及肺良性肿瘤的标准术式。而近年来随着越来越多的早期肺小结节被发现,胸腔镜下肺段切除术逐渐被应用于治疗难以行单纯楔形切除的早期外周型肺癌。尽管大量报道[1-2]表明,胸腔镜技术相对传统开胸术更安全有效、术后病死率低、呼吸功能恢复快,肺段切除术中肺血管解剖变异可能引起诸如意外大出血等严重问题,甚至中转开胸。外科医生通过术前影像成形技术加深对病灶及其周围肺组织解剖认识可能使胸腔镜手术变得更安全[2-3]。目前关于3D模拟打印技术对胸外科围手术期影响的报道不多[4],本文对拟行胸腔镜下肺段切除术的患者进行术前胸部高分辨率CT及肺动脉扫描,通过获得患侧肺血管、支气管-气管树扫描数据进行三维重建,3D打印出肺模型原型,术前制定相应手术方案并模拟手术,旨在研究3D打印技术在术前肺血管评估,减少术中、术后并发症的发生率等方面的应用价值。
1 临床资料
1.1 一般资料 本院自2015年12月至2017年6月期间顺利施行胸腔镜下肺段切除术共40例,其中男17例,女23例;年龄32~78岁,平均(56.9±10.6)岁。35例患者常规体检发现,5例因出现与肺肿块无关的咳嗽咳痰或胸痛就诊发现,病灶直径0.5~1.6cm,平均(0.8±0.2)cm。胸腔镜下肺段切除指征:外周型肺小结节(直径<2cm),术前胸部增强CT未发现淋巴结肿大转移,对高度怀疑肺癌的患者术前均行头颅MRI、腹部B超及骨ECT扫描等排除远处转移可能,无严重的心肺功能障碍。术前在征求患者的知情同意后常规予以胸部高分辨率增强CT和肺动脉扫描获取肺部病灶、血管支气管影像数据,重建3D肺模型。
1.2 术前3D肺模型建立方法 所有患者术前均接受胸部高分辨增强CT和肺动脉成像,采用GE公司256排CT行快速薄层扫描,利用RadiAnt DICOM viewer 软件查看和筛选原始CT数据,进行必要的图像调整处理后,导入至Arigin 3D V2.0.0(昕健医疗)软件中,采用阈值分割法结合区域生长法进行图像快速分割、3D重建。采用动静脉期CT序列图像数据重建肺内病灶、肺动静脉分支、气管支气管分支,各个结构的3D模型重建完成后实行计算机自动配准(见图1)。采用ProJet®860Pros打印机打印,所用材料为VisiJet优质复合打印材料,最后将得到彩色动脉、静脉、气管支气管原型及3D肺打印模型原型(见图2、3)。
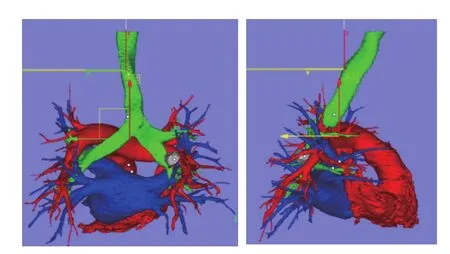
图1 肺动脉(红色)、肺静脉(蓝色)、气管支气管(绿色)、肿瘤(灰色)自动配准贴合
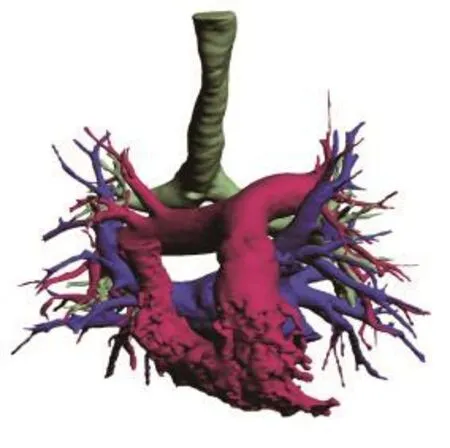
图2 最终彩色肺动脉、静脉及气管支气管模型原型

图3 3D肺打印模型原型
1.3 手术方法 患者取健侧卧位,全身静脉吸入复合麻醉,采用双腔气管内插管或单腔气管插管封堵行健侧单肺通气。切口选择三孔或两孔:观察孔位于腋中线第7或8肋间,前方操作孔位于腋前线与锁骨中线之间第4或5肋间,后方操作孔一般位于肩胛下线第6、7或8肋间,实际各操作孔及观察孔根据患者病变位置做适当调整。术中以强生腔内切割吻合器切除肺段,病灶常规术中送冷冻病理学检查,如为肺恶性肿瘤,行淋巴结采样,左侧一般选择性取第5、7、10、11、12、13组淋巴结,右侧选择性取第2、4、7、10、11、12、13组淋巴结。手术结束后病灶标本常规石蜡切片行病理学检查。
1.4 数据收集分析 为了了解3D肺模型在肺血管分支评估中的能力,术中由两名胸外科医生对肺血管走形、数量进行统计,术中实际肺血管分支未在3D肺模型中检测到被视为未检测到的血管,临床数据着重收集手术时间、术中出血量、病死率、术后引流时间及引流总量、术后出院时间、并发症(如心律失常、持续漏气、出血、肺部感染、声音嘶哑等)。
1.5 统计学方法 采用SPSS23统计软件。计量资料以()表示,采用t检验分析,计数资料以n或%表示。P<0.05为差异有统计学意义。
2 结果
本研究40例患者均顺利施行胸腔镜下肺段切除(肺恶性肿瘤予以淋巴结采样),无术中中转开胸、转为肺叶切除或死亡病例,其中左上肺固有段切除6例,尖后段切除2例,后段切除2例,舌段切除4例,背段切除6例;右上肺尖段切除2例,后段切除6例,前段切除3例,尖后段切除2例,背段切除3例,前基底段切除4例。手术时间40~180min,平均(104.1±29.4)min;术中出血 20~200ml,平均(66.9±38.4)ml。术后共出现2例并发症,其中出现持续漏气1例,经保守治疗痊愈,术后出血1例,再次胸腔镜下行开胸止血术后好转,未出现术后肺部感染、声音嘶哑、心率失常等并发症。术后引流时间2~7d,平均(3.7±1.4)d;引流总量 230~1300ml,平均(675.9±276.7)ml;术后出院时间4~8d,平均(5.4±1.3)d。术后常规病理诊断:微浸润性腺癌23例(均为pT1aN0M0 Ia期),原位腺癌9例,手术切缘的距离均>2cm,肺良性结节8例。术后无1个月及3个月死亡病例,随访3~12个月所有病例均未见肿瘤复发或转移。
根据术中发现,3D肺模型动脉分支与术中实际肺动脉分支符合率达到96.9%(94/97)(见表1),左上肺固有段、后段、舌段、背段,右上肺后段、尖后段、背段、前基底段动脉分支符合率均为100%。共3个动脉分支未被检测到:其中右上肺尖后段切除中1个,右上肺尖段切除中1个,右上肺前段切除中1个,所有未被检测到的动脉分支直径均<1mm。此外,3D肺模型上2个异常动脉分支与术中所见均相符,其中一支右下肺背段动脉发自右上肺后升支动脉,一支右上肺后升支动脉发自右中肺动脉(A5)。肺静脉符合率高达98.5%(64/65),详见表2。
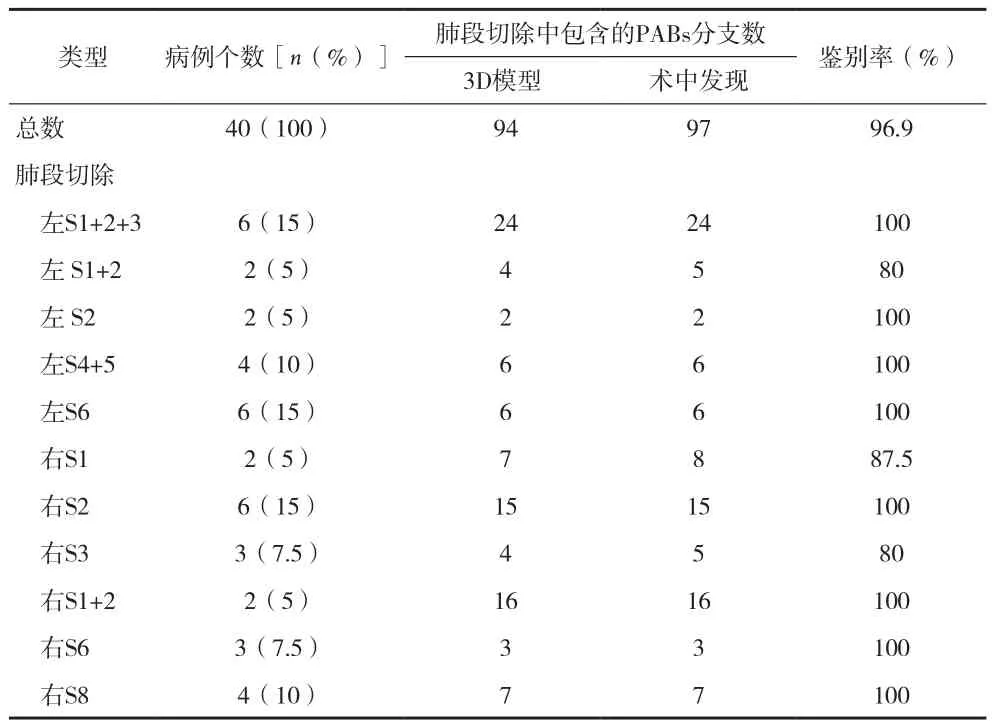
表1 肺段切除术中3D打印模型对肺动脉分支的鉴别率
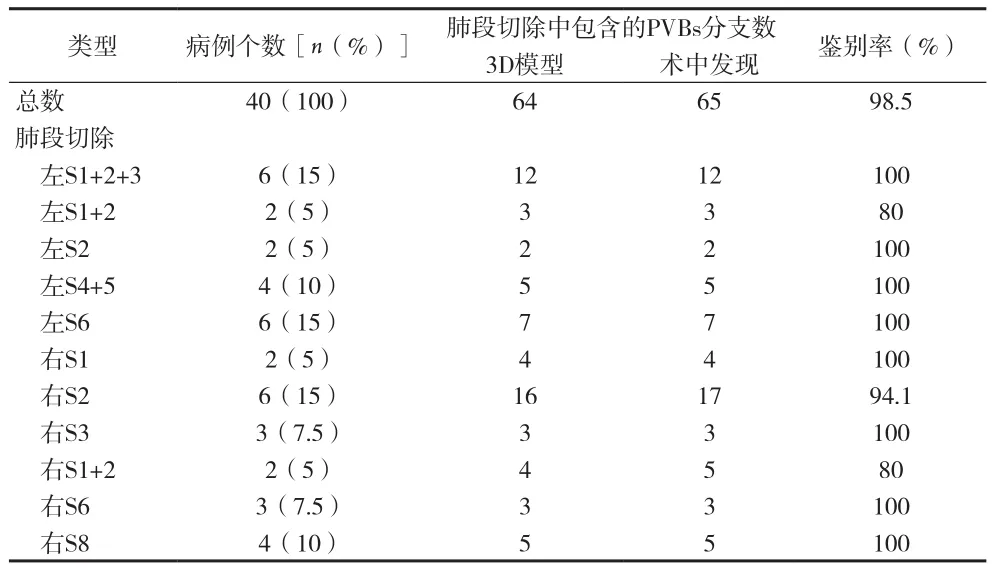
表2 肺段切除术中3D打印模型对肺静脉分支的鉴别率
3 讨论
3D打印技术是基于患者的临床影像学数据建立的解剖模型,并被应用于胸外科的解剖学研究、术前计划制定、手术模拟等方面[2-3],本研究通过术前对患者进行胸部高分辨CTA扫描获得影像数据从而指导建立3D肺模型,用于论证该技术对术中肺血管分支评估及短期预后影响的应用价值。
本研究中,通过术前3D肺模型的建立,96.9%的肺动脉分支和所有异常动脉分支均在术中被准确验证识别,肺静脉分支术中符合率也达到98.5%,相关文献报道[4]也指出,在施行胸腔镜肺叶切除术的患者中,术前经3D血管造影重建的病例术中血管符合率达到95%~98%,这与本研究的结果类似。本研究中未检测到的血管可能与打印精度不够高、复杂血管支气管干扰有关。3D打印技术在解剖性肺段切除术中通过准确定位肺血管、支气管分支、肺切缘达到精准切除靶病灶,与本单位之前的研究[5]比较,较大程度上减少了肺段切除术中误伤血管几率及术中出血量,缩短了手术时间,提高了手术的安全性,并为将来开展亚肺段切除等复杂手术提供保障。
根据作者的临床经验,基于影像学数据建立的3D肺模型原型相对三维重建影像更逼真,且可360°全方位自由旋转,术前可为胸外科医生提供多方位视角,纵览肺血管走形与气管支气管树的分布情况,局部病灶与邻近结构的关系。因此,该技术也可应用于术前模拟,这对最佳手术路径选择、避免大出血及对临近组织的损伤等方面均有益。通过3D打印技术,主刀医生通过3D肺模型能更好地与患者及家属进行沟通,取得其理解同意,减少医患纠纷的发生,并获得更详尽生动的病例记录[6]。与此同时,低年资医师和实习学生也能利用3D打印模型更好的理解术中的解剖关系,提高对血管等组织的空间认识,影响了他们的学习曲线[7]。
近年来随着胸腔镜技术的不断完善精进,术后并发症的发生率逐渐降低,本研究共发生2例并发症患者(5%),无死亡病例。其中术后持续漏气及大出血各1例,经讨论认为可能由于切割吻合器钉仓钉脚过长,吻合不够严密引起的漏气渗血。所有病例术后均未出现明显心律失常、喉返神经损伤、肺部感染等并发症。对比本单位既往研究[5],术前经3D打印模拟手术的患者发生手术相关并发症的风险明显降低(P<0.05)。尽管目前胸腔镜技术已经非常成熟,术中仍会遇到中转开胸的情况,本研究所有病例均未中转开胸,一方面取决于主刀医生的技术不断提高,另一方面术前3D打印技术对异常血管的提前认知,避免了因误伤血管而引起的中转开胸发生。
该研究的主要不足是病例数量不够多,潜在的偏倚可能影响数据的可靠性与说服力,尚不能充分论证3D打印技术在胸腔镜下肺段切除术中的影响,对此作者会持续探讨研究。另外3D打印技术本身也存在诸多限制与障碍,如缺乏柔韧性俱佳的医学打印材料,细节打印还不够精确,对于直径<1mm的亚段小血管分支辨别度欠佳,易造成术中血管误伤几率增加甚至中转开胸的发生,同时现阶段打印成本偏高及制作耗时偏多都制约了其在临床中的开展。但相信在不久的将来,3D打印技术将在胸外科临床实践中发挥不可忽略的作用。



