虞文嫣 卫 越 虞喜豪 崔永耀
慢性阻塞性肺疾病(COPD)是一种以气流受限和外周气道炎症为特征的常见呼吸系统疾病。由于其发生率及病死率较高、危害性大,已成为医药学界关注热点之一。近年来有研究表明,脂多糖(LPS 革兰阴性菌细胞壁成分)可直接引起呼吸道上皮的损伤及炎症反应,持续的炎症导致气道壁重构,黏液增生,胶原含量增加,最后引起气流受限,促进COPD 的发生和发展。转化生长因子-β1(TGF -β1)能够诱导包括分化、炎症、增生以及凋亡等多种细胞反应,在COPD、哮喘、肿瘤等多种病理过程中均发挥重要作用[1,2]。因此,TGF-β 在气道重塑中的作用值得关注。由于COPD 的病理生理过程至今尚未完全阐明,临床上缺乏可以有效对抗其肺部炎症的药物。乙酰胆碱作为胆碱能神经分泌的神经递质,在气道平滑肌收缩和腺体分泌等方面起着重要作用。近年来,发现抗胆碱药物具有潜在的抗炎抗重塑作用而备受重视[3~5]。本研究旨在以LPS 刺激小鼠气道造成COPD模型基础上,从细胞学角度、病理学角度观察TGF-β1在COPD 小鼠气道重塑中的作用及抗胆碱能药物对其的干预效应,进一步探讨COPD 形成及治疗机制作用。
材料与方法
1.实验对象及实验过程:KM 小鼠30 只,雄性健壮,体重25 ±5g(上海市交通大学实验动物中心),实验小鼠按数字表法随机分4 组:对照组(7 只):气道内滴注50μl 生理盐水,2次/周,共6 周;COPD 模型组(8 只)(参考Juanita H. J. Vernooy 法):气道内滴注5μg/50μl LPS(Sigma 公司),2 次/周,共6 周;噻托溴铵组(7 只):气道内滴注5μg/50μl LPS,2 次/周,3 周后,在气道内滴注LPS 前30min 用雾化仪在一密闭容器内雾化吸入50μg 噻托溴铵(Boehringer Ingelheim 公司)20min,共6 周;山莨菪碱组(8 只):气道内滴注5μg/50μl LPS,2 次/周,3 周后,在气道内滴注LPS 前30min 用雾化仪在密闭容器内雾化吸入28μg 山莨菪碱(上海第一生化药业有限公司)20min,共6 周。另正常饲养5 只KM 小鼠作为空白组。
2.标本处理:实验小鼠于最后一次给药后1 周处死,分别编号后取出双肺,取右下肺以10%甲醛固定后外送切片,取左肺下叶与右肺中叶分别称重,按0.0166ml/mg 肺组织重量加入PBS。用匀浆机以8000r/min 的转速转1min。取出1.3ml至EP 管中。用离心机在4℃、10000r/min 的转速下离心15min。取上清加入500μl 细胞裂解液,8000r/min 的转速转15s 后取上清备用。左肺下叶匀浆液用于ELISA,右肺中叶匀浆液用于Western blot 法检测。
3.测定肺组织中α-SMA 含量:采用Western blot 法测定肺组织中α-SMA 含量,取各组肺匀浆上清液20μl,加入细胞裂解液20μl 以及上样缓冲液10μl,混合后100℃水浴5min,10000r/min 离心5min 后制成样品;后采用SDS -Page 分离各样品中蛋白。在4℃环境中,200mA 恒流模式下将SDS-Page分离的蛋白转至NC 膜。转膜后用TBST 洗膜5min,5%milk-TBST 封闭1h。以1%milk -TBST 洗膜5min 后,加入α -SMA 抗体(Abcam)封闭慢摇12h。以TBST 洗膜5min,2 次,1%milk-TBS-T 洗膜5min,3 次后加入山羊抗鼠抗体(北京中杉公司)慢摇1h,1%milk-TBS-T 洗膜5min,2 次,TBS -T 洗膜5min,3 次后,至曝光室曝光。曝光结果采用软件ImageJ 分析。
4.测定肺组织中转化生长因子TGF -β1:采用ELISA 方法测定肺匀浆液中TGF -β1 含量。取小鼠TGF -β1 试剂盒(麦约尔生物),按试剂盒说明书配制各浓度标准液并取各组小鼠肺匀浆液50μl,加入样本稀释液410μl、20μl 1mmol/L HCl、20μl 1mmol/L NaOH 进行TGF -β1 激发实验。向96 孔酶标板内加入各浓度标准液以及各组样本100μl,贴膜后恒温37℃温育120min。洗板6 次。向每孔加入一抗工作液100μl,贴膜后恒温37℃温育60min。洗板6 次。向每孔加入酶标抗体工作液100μl,贴膜后恒温37℃温育30min。洗板6 次。向每孔加入底物工作液100μl,避光置37℃环境约15min 后,加入反应终止液100μl 终止反应。将96 孔酶标板置酶标仪测定A450值,通过标准曲线计算各样品中细胞因子的含量。
5.测定肺组织中TGF -β1 细胞内信号通路Smad -2 与pSmad-2 含量:采用Western blot 法测定肺匀浆上清液中Smad-2 与pSmad-2 含量:取各组肺匀浆上清液20μl,加入细胞裂解液20μl 以及上样缓冲液10μl,混合后100℃水浴5min,10000r/min 离心5min 后制成样品;后采用SDS - Page分离各样品中蛋白。在4℃环境中,200mA 恒流模式下将SDS-Page 分离的蛋白转至NC 膜。转膜后用TBST 洗膜5min,加入Smad-2 抗体与pSmad-2 抗体(Cell Signaling Technology)封闭慢摇12h。以TBST 洗膜5min,2 次,1%milk-TBS-T 洗膜5min,3 次后加入山羊抗鼠抗体慢摇1h,1%milk-TBS -T洗膜5min,2 次,TBS -T 洗膜5min,3 次后,至曝光室曝光。曝光结果采用软件Image J 分析。
6.病理切片:病理切片行常规Masson 染色及HE 染色。
7.统计学方法:应用GraphPad Prism 5.0 进行描述性分析,组间差异比较使用单因素方差分析Dunnett 检验,以P <0.05 为差异有统计学意义。
结 果
1.肺组织中转化生长因子TGF -β1 表达情况:ELISA 检测结果显示COPD 模型组中TGF -β1 明显高于对照组,而抗胆碱能药物(山莨菪碱、噻托溴铵)干预组中TGF -β1 较COPD 组有明显的降低,详见图1。
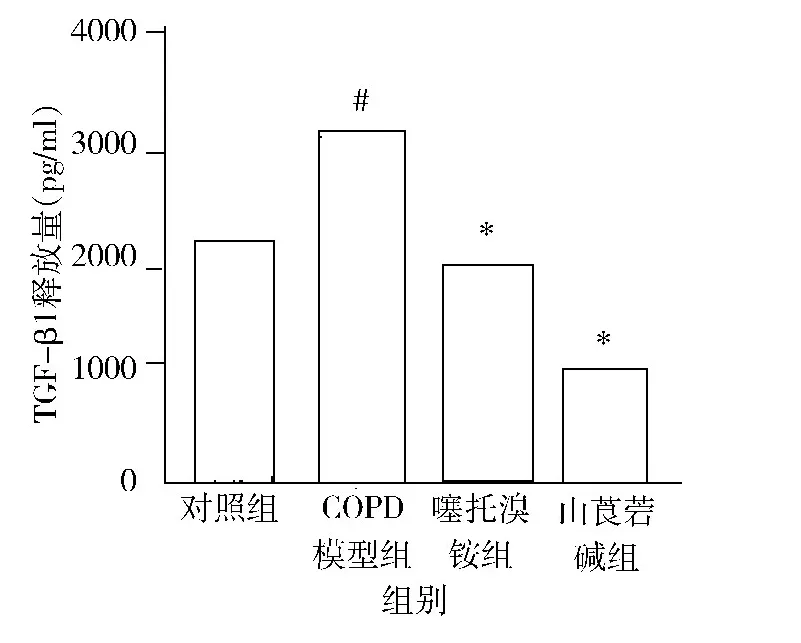
图1 ELISA 检测肺组织匀浆中TGF-β1 表达情况
2.肺组织中TGF-β1 细胞内信号通路Smad -2与pSmad -2 含量:Western blot 法检测Smad -2 与pSmad-2 含量,为排除不同组别肺组织匀浆中初始Smad-2 的差异性,将Western blot 法检测所得Smad-2 与pSmad -2 做比值处理,更直观体现Smad -2活化程度。实验结果显示COPD 模型组中pSmad -2/Smad-2 明显高于对照组。抗胆碱能药物(山莨菪碱、噻托溴铵)干预组中pSmad -2/Smad -2 较于COPD 组有明显的降低,详见图2、图3。
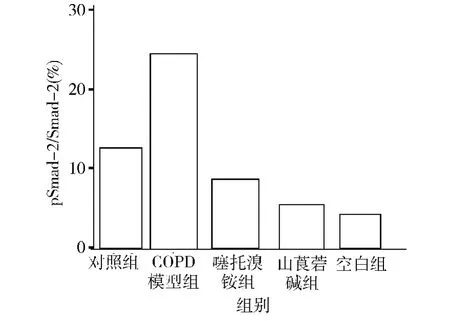
图2 Western blot 法检测pSmad-2/Smad-2
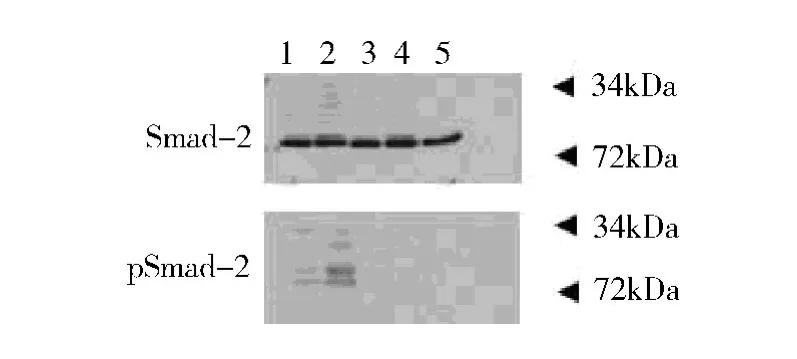
图3 Western blot 法pSmad-2 与Smad-2 曝光结果
3.肺组织中α-SMA(α-肌动蛋白)含量:Western blot 法检测结果显示COPD 模型组中α -SMA 显着高于对照组;抗胆碱能药物(山莨菪碱、噻托溴铵)组中α-SMA 相较于COPD 模型组出现显着下降,详见图4、图5。
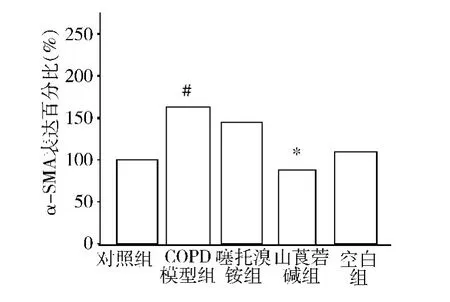
图4 Western blot 法检测肺组织中α-SMA 表达
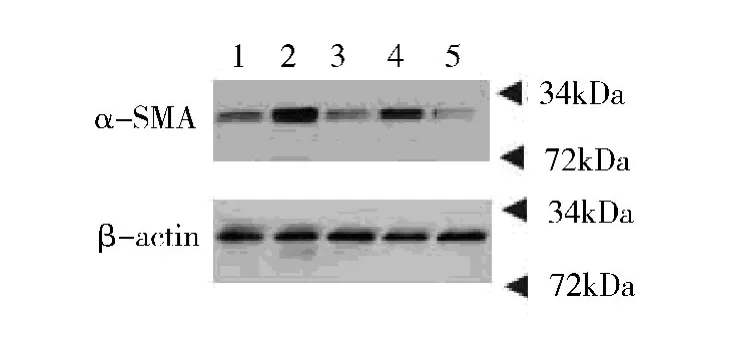
图5 Western blot 法α-SMA 曝光结果
4.病理切片Masson 染色结果:染色结果显示COPD 模型组相比于对照组出现明显的肺组织胶原的沉积及平滑肌组织增生情况(图6A、B)。山莨菪碱组相较于COPD 模型组,肺组织胶原沉积明显减少,平滑肌组织增生情况也得到了改善(图6B、C)。
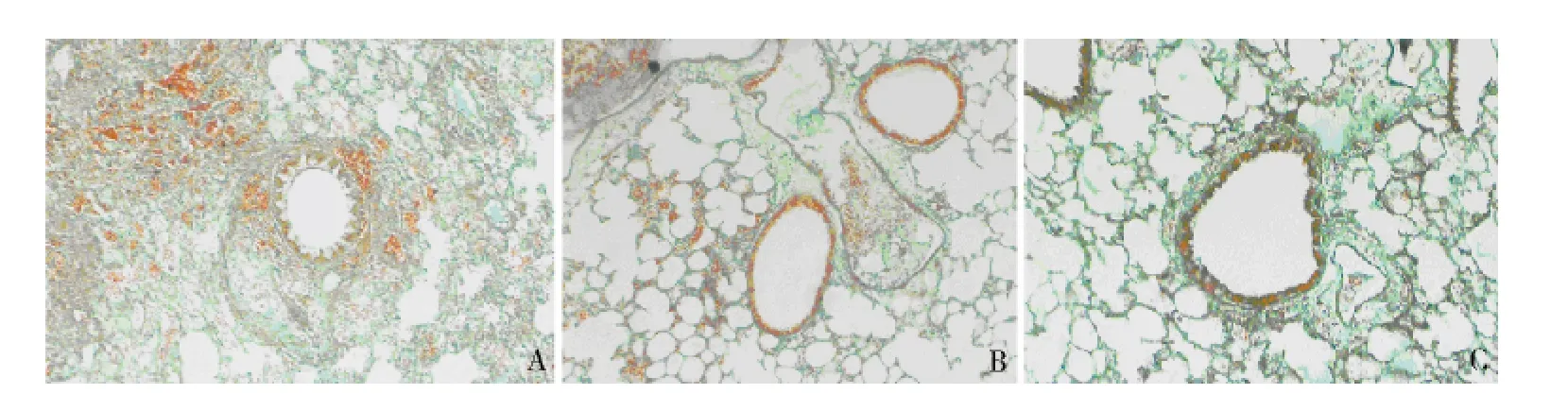
图6 Masson 染色结果(×100)
5.病理切片HE 染色结果:染色结果显示,COPD模型组相比于对照组出现明显的炎症反应(图7A、B),山莨菪碱组相较于COPD 模型组炎症反应减轻,气道周围及肺组织间隙红细胞渗出明显减少,肺泡内水肿明显减轻,炎症细胞浸润情况得到了明显改善,气管黏膜上皮完整(图7B、C)。
讨 论
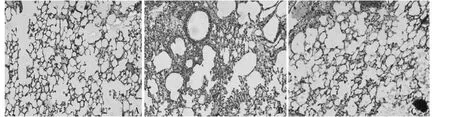
图7 HE 染色结果(×40)
本实验通过ELISA 方法检测出在COPD 模型组中TGF - β1 明显增高,通过Western blot 法检测出pSmad-2/Smad -2 明显高于对照组。TGF - β1 在体内来源广泛,在细胞分化的所有阶段很多细胞及组织都会产生TGF-β1。但在COPD 的发病过程之中,它主要来源于肺局部浸润的中性粒细胞、单核-吞噬细胞、淋巴细胞和气道壁的成纤维细胞。TGF - β1是一种多功能细胞调节因子,以自分泌、旁分泌和内分泌的方式通过细胞表面的受体信号转导途径调控细胞的增殖、分泌和凋亡[6]。介导TGF -β1 信号转导的是活化因子Smad 家族。Smad 蛋白是TGF -β1家族的特异性细胞内信号转导分子,可分为3 个亚家族R-Smad、co -Smad 和I -Smad。受体激活型(R-Smad)主要通过膜结合蛋白的相互作用以及SARA(Smad 受体激活锚定蛋白)锚定细胞膜,主要有Smad-2、Smad3。共同通路型(co-Smad)是所有TGF-β家族信号转位入细胞核所必须,主要是Smad4。TGF-β1 作为配体形成受体复合物,激活Smad 家族,使R-Smad 磷酸化。本实验通过检测pSmad -2/Smad-2 排除了不同组别肺组织中初始Smad -2 的差异性,直接反应Smad -2 被活化的程度。本实验结果说明了TGF -β1 参与了COPD 病情的进展,并通过TGF-β1/Smad 信号转导通路调控细胞增殖、分泌及凋亡,发挥TGF-β1 的生物学效应。
气道重塑是指气道在慢性炎症刺激下,所发生的气道壁的结构改变,涉及细胞外基质(extracellular matrix,ECM)沉积、气道平滑肌(airway smooth muscle,ASM)增厚、上皮下纤维化、肌成纤维细胞增生的改变。本实验通过Western blot 法检测出在COPD 模型组中α-SMA 显着高于对照组,病理学检测:通过Masson 染色可以明显看出COPD 模型组相比于对照组出现明显的肺组织胶原的沉积及平滑肌组织增生情况。有研究结果显示,TGF -β1 可诱导间质细胞中ECM 的表达,并刺激蛋白酶抑制剂的产生。从中可反映出TGF-β1 不但可促进各种细胞外基质成分如纤黏蛋白、胶原和蛋白多糖的合成,对新合成细胞基质的降解亦有明显的抑制作用,从而引起ECM 分解减少和沉积增加[7,8]。细胞外基质的合成是保护组织损伤的一个重要机制,但是过度的细胞外基质合成则对气道气体交换有着严重的影响,进而对气道结构产生直接影响,进一步加重气道的纤维化。故本实验中COPD 病理切片染色出现明显细胞外基质沉积证实了这点。
TGF-β1 是成纤维细胞的强效趋化因子,近年研究显示,TGF-β1、TGF -β2 通过刺激成纤维细胞到肌成纤维细胞(MF)的表型改变。大多数情况下MF 以表达α -SMA 为主,MF 在气道黏膜下增殖和积聚使气道壁增厚。MF 具有收缩性,使管腔更加狭窄,并且MF 产生的胶原纤维、弹性纤维和网状纤维等沉积于基膜,限制管腔扩张。因此,推测MF 在气道重塑中可能起重要作用。本实验检测COPD 组α-SMA 高度表达从某种程度上也体现了TGF -β 促进成纤维细胞的增殖并向MF 转变的事实。另有研究表明,TGF -β1 可能诱导平滑肌细胞增殖。气道平滑肌细胞在TGF-β1 的刺激下细胞表型可由收缩型向合成型转化,从而使平滑肌细胞不仅具有收缩功能使管腔变窄,同时由于细胞外基质及纤维产生增加而限制了管腔的扩张,共同参与了气道重塑。本实验在COPD 模型组中Masson 染色平滑肌增殖结果及α-SMA 高度表达直接体现了平滑肌细胞的高度增殖,同时由于染色显示胶原沉积从某种程度上也反映了合成型平滑肌细胞的合成功能。
本实验中,通过ELISA 及Western blot 法可检测出干预组抗胆碱能药物治疗后,TGF-β1、pSmad -2/Smad-2 相较于COPD 模型组出现了显着的下降;病理切片HE 染色结果可以看出,干预组病变均较COPD 模型组减轻,气道周围及肺组织间隙红细胞渗出明显减少,肺泡内水肿明显减轻,炎症细胞浸润情况得到了明显改善,气管黏膜上皮完整。由此结果,笔者认为抗胆碱能药物除具有传统意义上的支气管扩张的作用,还存在抗炎的生物学效应。有研究表明,神经源性和非神经源性的乙酰胆碱均可能在肺泡和支气管腔内发挥其促炎性作用。其通过作用于受体,释放炎症因子趋化炎症细胞,导致大量炎症细胞的浸润与活化,再通过活化的炎症细胞所释放的炎症介质引发瀑布式炎症反应,从而促进COPD 中的气道炎症发生发展[9]。抗胆碱能药物正是通过阻断乙酰胆碱的作用来发挥抗炎作用,随着炎症得到改善,可以看到炎症细胞浸润减轻,炎症因子TGF -β1 下降及由TGF-β1 所激活的pSmad -2/Smad -2 值的下降。另外本研究中通过Western blot 法检测出干预组抗胆碱能药物治疗后,α -SMA 出现显着下降;病理切片Masson 染色可以观察到相较于COPD 模型组,肺组织胶原沉积明显减少,平滑肌组织增生情况也得到了改善,由此可推测抗胆碱能药物对气道重塑有一定的干预作用。综合实验结果分析,笔者认为其干预气道重塑的可能机制如下:①通过降低具有促气道重塑的炎症因子如TGF -β1 的产生来实现的;②通过直接阻断成纤维细胞及肌成纤维细胞上的胆碱能受体,从而拮抗乙酰胆碱的细胞增殖效应,抑制肌成纤维细胞的增殖,进一步抑制气道重塑的进展。本实验中干预组α-SMA(肌成纤维细胞的表型)的显着降低从某种程度上也证实了这点。
综上所述,TGF -β1 等参与了COPD 病情的进展,并可能其通过TGF-β1/Smad 信号转导通路调控细胞增殖、分泌及凋亡,导致细胞外基质沉积增加、成纤维细胞增殖并发展为肌成纤维细胞、平滑肌细胞增殖并向合成型转变,从而在气道重塑中发挥重要作用。抗胆碱能药物通过阻断胆碱能受体,发挥抗炎效应[5]。同时其又可通过阻断位于成纤维细胞、肌成纤维细胞表面的M 受体拮抗Ach 细胞增殖效应,或者通过抑制具有促重塑的炎症因子释放从而直接或间接地干预气道重塑的进展[10,11]。此为今后COPD临床治疗药物选择及开发新的靶点药物提供实验依据。有关各类炎性因子及相关受体相互作用关系、临床实际检测等仍待进一步研究。
1 Brusasco V. Reducing cholinergic constriction:The major reversible mechanism in COPD[J].EurRespir Rev,2006,15:32 -36
2 Borovikova LV,Ivanova S,Zhang M,et al. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin.[J]. Nature,2000,405:458 -462
3 Barnes PJ.The role of anticholinergics in chronic obstructive pulmonary disease[J].Am J Med,2004,117(Suppl 12A),24S-32S
4 姚婉贞,王国扬.慢性阻塞性肺疾病的气道毒蕈碱M 受体变化与抗胆碱治疗的研究[J]中华结核和呼吸杂志,2005,28(7):484 -485
5 ProfitaM,Giorgi RD,Sala A,et al. Muscarinic receptors,leukotriene B4 production and neutrophilic inflammation in COPD patients[J],Allergy,2005,60:1361 -1369
6 宋一平,崔德健、茅培英,等.慢性阻塞性肺疾病大鼠模型气道重塑及生长因子的研究[J]. 中华结核和呼吸杂志,2001,24(5):5-9
7 Sandford AJ,Chronic obstructive pulmonary disease. 1:Susceptibility factors for COPD the genotype-environment interaction[J].Thorax,2002,57(8):736 -741
8 Yamauchi K.Airway remodeling in asthma and irreversible airflow limitation -ECM deposition in airway and possible therapy for remodeling[J]Allergol Int,2007,56(4):321 -329
9 Nicola AH,Amir S. Update on the pharmacologic therapy for chronic obstructive pulmonary disease[J]. Clin Chest Med,2007,28:589 -607



