王丽红 杨晓丽 李 静
新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)是一种严重的急性肠道炎症性疾病。据报道,其发生率为3%~15%[1]。其中高达50%的患儿需进行手术治疗,且术后发生严重并发症(如脑瘫和认知障碍)的可能性很大[2,3]。研究发现,该病病死率为18.5%~28.8%,而且在过去几十年里并没有明显变化[4]。此外,NEC 患儿住院时间更长,治疗费用更高[5]。因此,探索NEC的发病机制及治疗方法已成为临床研究的重点。
NEC有复杂的、多因素的病理生理学,潜在的作用机制尚不明确。Qiao等[6]研究显示,内质网应激(endoplasmic reticulum stress,ERS)可诱发肠道炎症,导致肠黏膜屏障破坏,进而诱发多种疾病。大量研究表明,ERS与克罗恩病和溃疡性结肠炎等炎症性肠病及结肠癌的发病机制有关[7,8]。Lau等[9]研究表明,ERS也可能与急性肠道损伤的发病机制有关。Zhu等[10]报道,与肠道炎症密切相关的内质网是NEC发病机制的关键参与者,抑制ERS可改善NEC大鼠肠道损伤。研究表明,自噬激活发生在NEC肠道组织中,抑制自噬可以对NEC起保护作用[11, 12]。王国琴等[13]研究显示,ERS和自噬两者之间存在着重要的联系。ERS介导的自噬机制非常复杂,但目前国内外对ERS诱导的自噬和NEC关系研究甚少。
本课题组在前期实验中已成功建立新生大鼠NEC模型[14]。在此基础上,本课题拟从体外细胞实验开展进一步研究:建立新生大鼠NEC模型,分离提取出肠上皮细胞,检测炎性细胞因子、ERS标志物和自噬相关蛋白等的表达,探究抑制ERS诱导的自噬是否对NEC有保护作用,阐明其对NEC作用机制的影响,旨在为NEC的治疗提供实验参考。
材料与方法
1.实验动物与主要试剂:健康新生清洁级Sprague-Dawley (SD)大鼠10只,雌雄不限,体质量5~10g,由山西省人民医院动物实验室(实验动物许可证号:SCXK晋2019-0001)提供,按无特定病原体(specific pathogen free, SPF)级要求饲养。脂多糖(lipopolysaccharide,LPS,血清型055:B55)购自北京Sloarbio公司;衣霉素(tunicamycin,Tm,ERS诱导剂)、4-苯基丁酸(4-phenylbutyric acid,4-PBA,ERS抑制剂)均购自上海Macklin公司;LC3 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒、p62 ELISA 试剂盒均购自上海酶联生物科技有限公司;反转录试剂盒、实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)试剂盒均购自日本TaKaRa 公司;BCA蛋白含量检测试剂盒、LC3及p62抗体、羊抗兔IgG-HRP均购自江苏凯基生物技术股份有限公司;引物由通用生物(安徽)股份有限公司合成。代乳品配制:雅培婴儿配方奶粉5g,脂肪乳50ml,蛋白粉8g,加灭菌水至100ml。
2.NEC动物模型的建立:所有动物实验方案均经山西省人民医院动物保护委员会批准[伦理学审批号:(2019)省医伦审字第105号]。通过人工喂养+缺氧+冷刺激+LPS灌胃多因素联合在新生SD大鼠中诱导NEC模型。每天于8:00、12:00、16:00、20:00时人工喂养新生大鼠4次配方奶(起始量为0.15ml,后逐渐增加);每天于8:00、20:00时进行缺氧应激(暴露于纯氮气60s),然后置于冰箱进行冷暴露(4℃,10min);后于每天16:00时经灌胃针注入LPS(10mg/kg稀释于配方奶中),连续2天。空腹12h后以颈椎脱臼法处死动物,收集肠组织(回盲部近端2cm)用于后续实验。
3.肠上皮细胞的提取、培养:如汪煜鹏[15]所述,先进行试剂配制:①细胞洗液:50ml磷酸盐缓冲液(phosphate buffered saline,PBS)+0.5ml青霉素(100U/ml)、链霉素(0.1mg/ml)双抗;②消化液:15ml DMEM/F12培养基+1.5mg中性蛋白酶Ⅱ(0.1mg/ml)+4.5mg胶原蛋白酶Ⅺ(0.3mg/ml);③分散液:1.00g山梨醇+2.5ml胎牛血清+普通DMEM/F12培养基定容至50ml;④完全培养基:5ml胎牛血清+0.5ml青链霉素双抗+0.4ml EGF(2.5μg/ml)稀释液+DMEM/F12培养基定容至50ml。
参照沈雁等[16]的方法,用细胞洗液将获取的肠组织反复冲洗3~5次后将其剪碎,吸取含碎肠组织的溶液到15ml的离心管中。加10ml的冰PBS溶液,轻柔地吹打,反复几次直至上清液变澄清,16099×g离心3min,弃上清。向沉淀中加入适量消化液在37℃下消化30min,每隔10min摇匀1次,静置1min后取上清入15ml离心管中,重复上述操作2次。向上清液中加10ml分散液,吹打混匀,16099×g离心3min,弃上清。沉淀用分散液重悬,重复5~6次,直到上清液澄清。加入5ml完全培养基重悬,接种于培养瓶中,放入细胞培养箱(37℃、5%CO2)进行细胞培养,每2~3天换液1次,当细胞密度达80%~90%后进行后续实验。
4.分组及干预方法:取对数生长期的细胞分为3组:对照组(用不含药物的完全培养基孵育)、抑制组(加5mmol/L的4-PBA处理细胞)、诱导组(加10μg/ml的Tm处理细胞),均处理24h[6]。
5.ELISA检测炎性细胞因子:将待测样本室温放置20min,于各反应孔中依次加入标准品和样本50μl,每孔加入酶标试剂100μl,空白孔除外。用封板膜封板后振荡、混匀后置37℃温育60min。每孔加洗涤液人工洗涤5次,后加入50μl显色剂A、B,轻轻震荡混匀,37℃避光显色15min,加终止液50μl终止反应。以空白孔调零,采用酶标仪记录450nm波长处各孔的吸光度(A)值,绘制标准曲线并计算出各组样本肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、肠脂酸结合蛋白(intestinal fatty acid binding protein,I-FABP)的质量浓度。
6.RT-qPCR检测ERS标志物:利用Trizol试剂从培养的肠上皮细胞中分离总mRNA。然后,通过反转录试剂盒将提取的RNA合成为互补DNA。取cDNA以β-actin为内参进行RT-qPCR检测,运用RT-qPCR仪参照试剂盒说明书设置程序:95℃变性10min,然后95℃变性15s,60℃退火20s,72℃延伸28个循环40s。完成循环步骤后,72℃再延伸5min。采用2-ΔΔCT法计算葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)、氧调节蛋白150(oxygen-regulated protein 150,ORP150)相对基因表达量。

表1 RT-qPCR引物序列
7.Western blot法检测自噬相关蛋白:处理后的细胞在含有1%苯甲基磺酰氟(phenylmethanesulfonyl flouride,PMSF)、10%蛋白酶抑制剂和1%磷酸化抑制剂的冷RIPA(radioimmunoprecipitation assay,RIPA裂解液)溶液中裂解30min,收集蛋白用于后续实验。通过聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白试剂盒测定样品的蛋白质浓度。总蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-Polyacrylamide gel electrophoresis,SDS-PAGE)电泳并转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上。经5%脱脂牛奶室温封闭2h后,把膜与相应的一抗4℃下孵育过夜。次日,膜经Tris缓冲盐吐温-20溶液(tris buffered saline tween-20,TBST)洗涤3次后,与相应的二抗室温下孵育2h,TBST洗膜3次。采用成像分析系统扫描获得的印迹,用Gel-Pro32软件进行灰度值分析。通过将条带强度归一化为GAPDH带强度来确定每个通道的LC3Ⅱ/Ⅰ、p62蛋白表达水平。
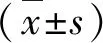
结 果
1.各组肠上皮细胞炎性细胞因子比较:ELISA检测结果显示,与对照组比较,抑制组TNF-α、I-FABP水平明显降低,而诱导组的表达水平显着增高,差异均有统计学意义(P<0.05),详见图1。

图1 各组细胞炎性细胞因子表达比较
2.各组肠上皮细胞ERS标志物mRNA比较:RT-qPCR检测结果显示,与对照组比较,抑制组GRP78、ORP150的mRNA相对表达量明显降低,而诱导组明显增高,差异均有统计学意义(P<0.05),详见图2。

图2 各组细胞ERS标志物mRNA相对表达量比较
3.各组肠上皮细胞内自噬相关蛋白比较:Western blot法检测结果显示,与对照组比较,抑制组p62蛋白水平明显升高,LC3Ⅱ/Ⅰ蛋白水平显着降低;而诱导组则相反,差异均有统计学意义(P<0.05),详见图3、图4。

图3 各组细胞自噬相关蛋白条带

图4 各组细胞自噬相关蛋白表达比较
讨 论
NEC的发病机制极其复杂,其发病与早产、配方奶喂养、肠道微生物菌群失调、炎症、缺氧缺血性损伤等有关,随之引发一系列病理生理变化,最终导致肠黏膜屏障功能障碍、通透性改变、发生不可逆性损伤[17]。参与NEC的炎性介质包括TNF-α、白细胞介素等,TNF-α参与活化多种炎性细胞,促进其释放大量的氧自由基和蛋白酶导致肠组织损伤[18];还可诱导线粒体发生功能障碍甚至使其凋亡,引发肠上皮细胞发生凋亡[19]。I-FABP在肠道缺血性疾病中的表达水平明显增高,可反映肠黏膜损伤程度和通透性变化[20]。此外,它还被认为是一种可预测NEC发展并与肠组织坏死程度相关的生物学标志物[21]。ERS和自噬在多种胃肠道疾病的发生、发展过程中起重要作用。内质网主要参与蛋白质的加工和修饰,指导其正确的折叠和组装。在各种不利刺激的作用下,内质网功能发生紊乱,大量错误折叠蛋白质堆积就会启动ERS[22]。重度或持续的ERS则会激活炎症小体,甚至引起细胞凋亡[23]。在ERS发生时,内质网驻留蛋白GRP78首先从内质网膜上解离,以帮助被破坏的蛋白质重新折叠或降解,其表达水平可反映ERS的严重程度,被认为是ERS的生物学标志物之一[24]。
ORP150作为一种机体应对应激时产生的重要ERS伴侣分子标志物,它的高表达与许多ERS相关疾病密切相关[25]。当ERS无法清除超负荷的折叠紊乱蛋白时,细胞自噬将被激活以清除这类蛋白维持细胞稳态。据报道,ERS是NEC新生大鼠自噬的一种潜在诱导剂[26]。自噬是一种广泛且高度保守的细胞降解过程。LC3是自噬的关键指标,由于可溶性LC3Ⅰ型转化为脂质结合型LC3Ⅱ型是自噬的典型特征,因此使用LC3Ⅱ/Ⅰ比率来评估自噬程度[27]。p62是一种能与LC3结合并被降解的应激蛋白,其含量与自噬水平呈负相关,也被认为是一种自噬程度的标志物[28]。研究表明,NEC组TNF-α水平高于健康新生儿组,而且随疾病严重程度呈上升趋势,说明其浓度与NEC临床分期密切相关[29]。ERS可调节肠上皮细胞的炎性反应,持续的ERS会诱导细胞凋亡,抑制ERS可能对NEC的肠道有保护作用[30,31]。抑制ERS能够减轻细胞凋亡程度和抑制NEC的发展[32]。在严重烧伤小鼠中,抑制ERS可减轻烧伤诱导的自噬激活,使肠道通透性减弱,减轻肠道损伤[33]。因此,以上研究表明,ERS-自噬通路与肠黏膜屏障功能受损疾病(如NEC)的发病机制紧密相关,抑制ERS诱导的自噬可以减轻NEC肠组织的炎性反应。
本实验发现,与对照组比较,抑制组的TNF-α、I-FABP、GRP78、ORP150mRNA表达水平明显降低,LC3Ⅱ/Ⅰ表达水平下调,p62表达水平上调,提示炎性细胞因子、ERS相关标志物表达降低,自噬水平显着下调,诱导组结果明显相反,证明抑制ERS通过阻止细胞内自噬激活显着降低NEC刺激的炎性细胞因子释放,减轻NEC肠上皮细胞的炎性反应,表明抑制ERS诱导的自噬可能是NEC肠组织损伤的保护机制。所以抑制ERS-自噬通路可作为NEC肠组织损伤的治疗靶点。
综上所述,抑制ERS可减轻NEC肠上皮细胞的炎性反应,其作用机制可能与阻断细胞的ERS-自噬通路有关。本研究从ERS和自噬方面揭示了NEC的发病机制,为探索NEC的治疗提供了新思路。
利益冲突声明:所有作者均声明不存在利益冲突。



