张伟光,邸凯
氧氟沙星明胶微球的制备工艺研究
张伟光,邸凯
目的研究制备氧氟沙星明胶微球的最佳工艺条件。方法以明胶为载体,液体石蜡为油相,Span80为乳化剂,戊二醛为交联剂,采用乳化交联法制备氧氟沙星明胶微球。采用紫外分光光度法测定微球中氧氟沙星的载药量和包封率。考察明胶质量分数、油水相体积比、明胶与氧氟沙星质量比、Span80体积分数对载药量、包封率的影响。以载药量、包封率的总和为评价指标,针对上述4个因素用L9(34)表正交试验设计法进行实验,获得最佳配方比例。结果氧氟沙星明胶微球分别在明胶质量分数20%、油水相体积比为3.5∶1、明胶与氧氟沙星质量比1∶1、Span80体积分数2.5%时,各自载药量、包封率的综合评价指标较高。正交设计证实上述条件下制备工艺最佳。结论本制备工艺稳定可行,氧氟沙星明胶微球的载药量和包封率可达到约80%。
氧氟沙星;聚明胶肽;微球体;工艺学,制药;药物载体;药物评价
氧氟沙星是氟喹诺酮类抗菌药,具有广谱、高效、与其他抗菌素无交叉耐药性等特点[1]。它对结核分枝杆菌和部分厌氧菌有效,主要用于敏感菌所致的呼吸系统、泌尿系统、胆道系统和皮肤软组织感染及盆腔感染等。明胶含有人体所需的多种氨基酸,是分子质量分布很宽的多肽分子混合物。明胶作为药物缓释材料,具有良好的生物降解性、生物相容性与组织相容性,降解后形成无毒产物而排出体外[2]。在临床应用中,氧氟沙星的不良反应以神经系统损害及变态反应(包括过敏性休克)为主[3]。有研究认为,微球可减少药物对机体的不良反应[4],并且可提高治疗效果[5]。本文以可生物降解的明胶为载体材料[6],制备氧氟沙星明胶微球,旨在通过实验筛选制备氧氟沙星明胶微球的最佳工艺。
1 材料与方法
1.1 仪器及材料Lambda 35型紫外可见吸收光谱仪(美国PE公司);RW20DZM.n数显机械式搅拌机(德国IKA公司);电热恒温水浴锅(郑州泽铭科技有限公司);800型台式离心机(上海浦东物理光学仪器厂);SK2200HP超声清洗器(上海科导超声仪器有限公司)。氧氟沙星对照品(中国药品生物制品检定所);氧氟沙星(湖北拓楚慷元医药有限公司);明胶(河北衡水东都胶业有限公司);液状石蜡(西安化学试剂厂);Span80(南通奥诺化工有限公司);戊二醛(天津市科密欧化学试剂开发中心)。
1.2 方法
1.2.1 氧氟沙星明胶微球的制备及含量测定根据乳化缩聚原理制备微球[7],采用乳化交联法[8],在装有氧氟沙星的烧杯中加入适量稀盐酸溶液,振摇并溶解,超声处理,形成氧氟沙星饱和溶液。用质量分数为20%的明胶配制成氧氟沙星明胶溶液,经乳化、交联固化、脱水、洗涤、干燥过筛后得粉末状明胶微球。用紫外分光光度法测定微球中氧氟沙星的含量[9]。
1.2.2 检测波长的确定取氧氟沙星对照品适量,以0.1 mol/L盐酸溶液配制成含氧氟沙星10 mg/L的溶液。在200~390 nm波长范围内进行紫外吸收图谱扫描,测得氧氟沙星的最大吸收波长为293.86 nm。因此,测定氧氟沙星含量时,紫外检测波长选在294 nm处。
1.2.3 氧氟沙星线性关系的考察精密称取氧氟沙星对照品25 mg,置于25 mL容量瓶中,用0.1 mol/L盐酸溶液稀释成含氧氟沙星分别为5、10、15、20、40、80 mg/L的标准溶液。在294 nm处测定其吸光度(A),以A对氧氟沙星浓度(C)进行线性回归,得回归方程:A=0.005 6+0.076 9C,r=0.999 7,氧氟沙星在5~80 mg/L内C与A呈良好线性关系。
1.2.4 精密度实验吸取浓度为40 mg/L氧氟沙星标准溶液,重复6次,在294 nm处测定其A,相对标准偏差(RSD)= 0.86%(n=6),表明该方法精密度良好。
1.2.5 回收率实验取氧氟沙星对照品25.21、26.51、25.47、26.36、25.28 mg,分别置于100 mL容量瓶中,加入0.1 mol/L盐酸溶液,加入40 mg/L的标准溶液25 mL,再加0.1 mol/L盐酸溶液稀释至100 mL。摇匀后进样,测定氧氟沙星的质量,获得平均回收率为98.96%,RSD=0.67%(n=5)。
1.2.6 微球载药量及包封率测定精密称取氧氟沙星明胶微球80 mg,置25 mL容量瓶中,加入适量稀盐酸溶液,温水浸泡25 min,加稀盐酸溶液稀释至25 mL,超声提取15 min,用800型台式离心机离心8 min,用0.45 μm微孔滤膜滤过,制成样品溶液,测定A,根据上述回归方程计算检测质量分数和微球中药物总质量。计算载药量和包封率:载药量(%)=微球中氧氟沙星的总质量(mg)/微球的质量(mg)× 100%;包封率(%)=微球中药物的总质量(mg)/投入药物质量(mg)×100%。
1.3 观察指标考察明胶质量分数、油水相体积比、明胶与氧氟沙星质量比、Span80体积分数对载药量及包封率的影响。以载药量、包封率的总和为评价指标,针对上述4个因素用L9(34)表正交试验设计法进行实验,获得配方比例,并以此进行正交试验以获得最佳载药量和包封率。
2 结果
2.1 明胶质量分数对载药量和包封率的影响随着明胶溶液质量分数增加,微球的平均粒径增大,载药量和包封率也随之增大;明胶质量分数20%时,载药量、包封率的综合评价指标较高。但是明胶质量分数22%时,氧氟沙星的包封率开始减少,显示明胶质量分数过大时,微球的流动性受影响,导致部分有粘连现象,见图1。
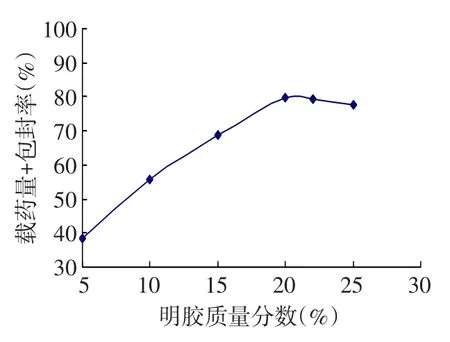
Fig.1Effect of the gelatin concentration on the drug loading capability and entrapment efficiency图1 明胶质量分数对载药量和包封率的影响
2.2 油水相体积比对载药量和包封率的影响固定明胶溶液质量分数20%不变,检测不同油水相体积比条件下制备的微球,来确定适宜的油水相体积比。结果显示当油水相体积比为3.5∶1时,氧氟沙星明胶微球的载药量和包封率较高,形成的油包水(W/O)微乳液更加稳定均匀,微球粒径适度,见图2。
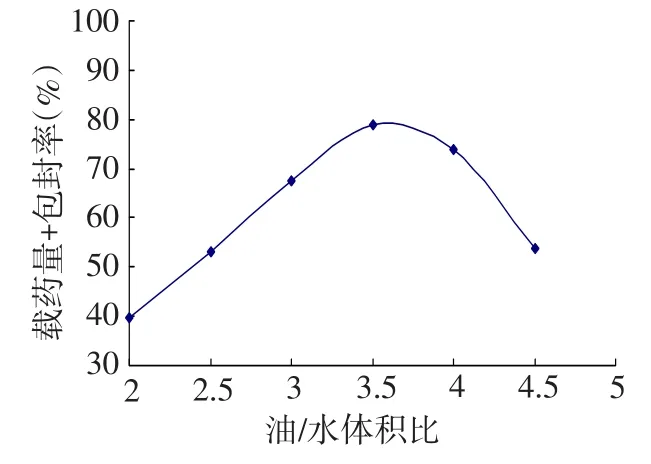
Fig.2Effect of water/oil volume ratio on drug loading capability and entrapment efficiency图2 油水相体积比对载药量和包封率的影响
2.3 明胶与氧氟沙星质量比对载药量和包封率的影响固定明胶溶液质量分数20%、油水相体积比3.5∶1不变,随着明胶与氧氟沙星质量比的增加,氧氟沙星明胶微球的载药量和包封率增大,当明胶与氧氟沙星质量比超过1∶1时,其开始下降,见图3。
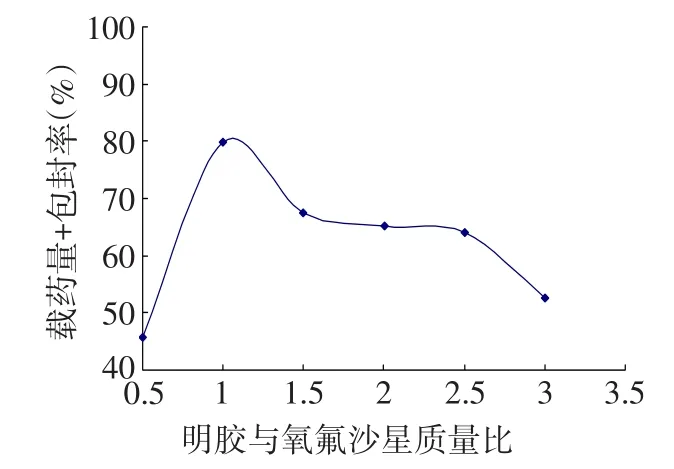
Fig.3Effect of gelatin/ofloxaxcin mass ratio on the drug loading capability and entrapment efficiency图3 明胶与氧氟沙星质量比对载药量和包封率的影响
2.4 Span80体积分数对载药量和包封率的影响固定明胶溶液质量分数为20%、油水相体积比3.5∶1、明胶与氧氟沙星质量比1∶1不变,随着乳化剂Span80体积分数的增加,氧氟沙星明胶微球的载药量和包封率增大,当体积分数超过2.5%时,微球的载药量和包封率开始下降,见图4。
2.5 正交设计确定氧氟杀星明胶微球的最佳制备工艺条件氧氟沙星明胶微球的配方比例,见表1。按此配方进行正交试验,最佳工艺条件的实验为A1B2C1D2,即明胶溶液质量分数为20%,油水相体积比为3.5∶1,明胶与氧氟沙星质量比为1∶1,乳化剂Span80体积分数为2.5%,对载药量和包封率的影响因素贡献依次为:A>D>B>C。按照最佳工艺条件重复3次制备氧氟沙星明胶微球,载药量和包封率分别为79.92%、79.96%、80.17%,制备工艺重现性较好,见表2。
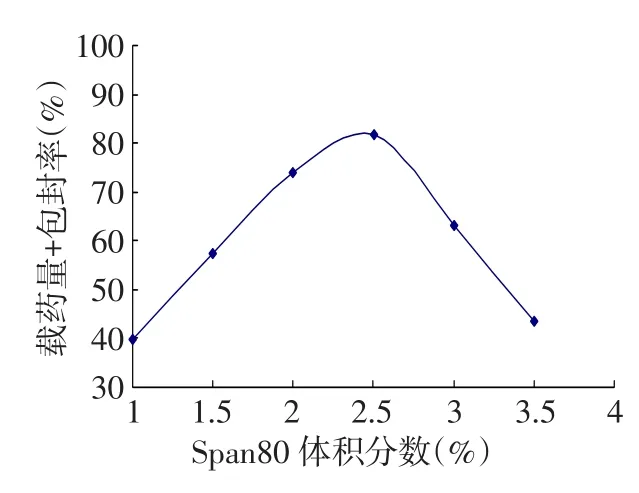
Fig.4Effect of the span 80 volume fraction on the drug loading capability and entrapment efficiency图4 Span80体积分数对载药量和包封率的影响
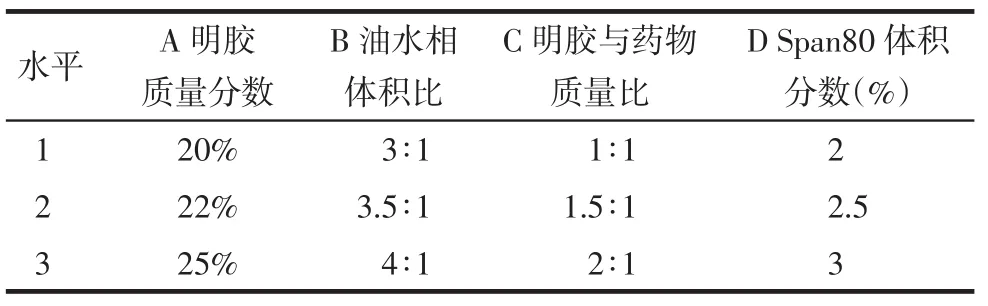
Tab.1Factors and levels of L9(34)orthogonal test表1 L9(34)正交实验的因素和水平
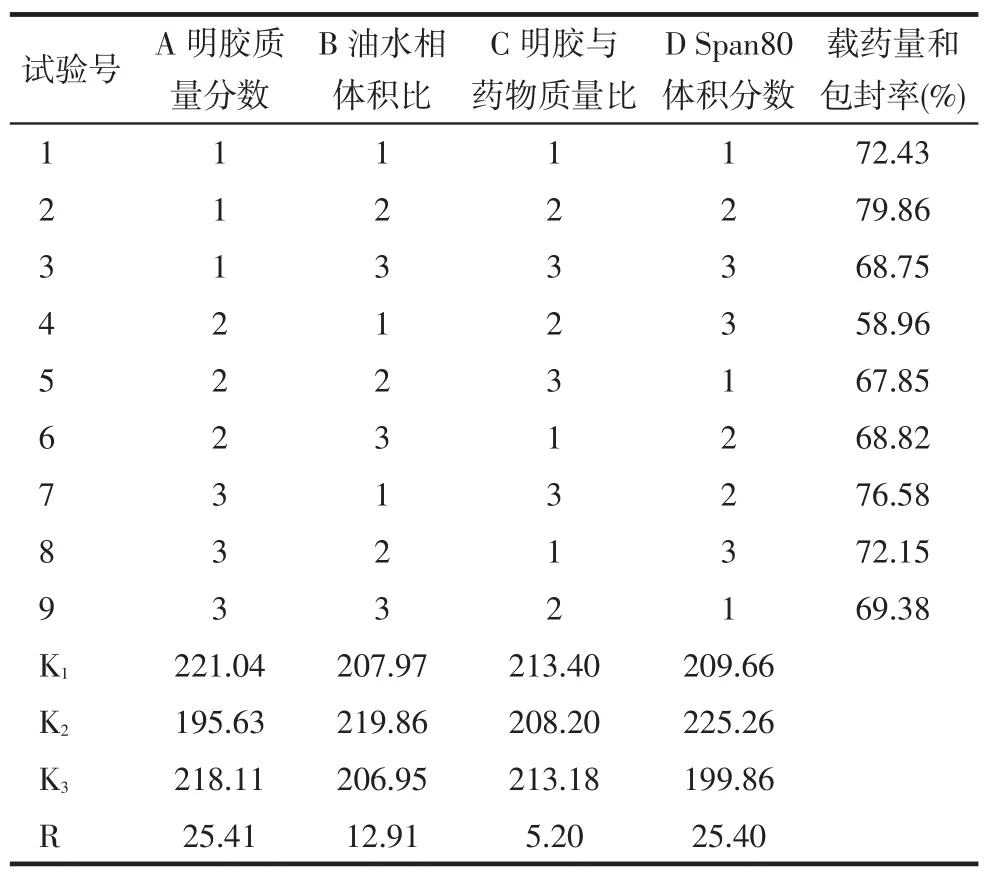
Tab.2Results and analysis of L9(34)orthogonal test表2 L9(34)正交试验结果和分析
3 讨论
以聚乳酸-羟基乙酸共聚物为缓释材料制备微球为近些年较新的研究成果,效果较好[10],但其成本较高,不适用大规模生产。明胶价格低廉,目前广泛应用于药物微球的研究[11]。明胶溶液的质量分数对微球的粒径影响很大,其浓度越大,制得的微球粒径也越大[12]。在微球制备过程中选择合适的乳化剂、
固化剂也很重要。Span80作为乳化剂有利于微球制备中W/O型乳液的快速形成,且具有较好的光滑圆整度。明胶微球常用的固化剂有甲醛和戊二醛,戊二醛只需在中性条件下即可固化完全,使其适用范围较大。
研究显示,微球制备过程中明胶溶液质量分数越大,载药量越大,但相应的包封率会下降[13]。本研究结果显示,当明胶浓度过大时,载药量和包封率均开始下降,考虑是由于微球之间交联过度,相邻微球之间的一些基团相互交叉,分子与分子相互纠缠,从而导致了微球粘连,使被包封药物容易渗出。本研究显示,随着油水相体积比的增加,载药量和包封率也增大,与相关文献报道相似[14],当油水相体积比超过3.5∶1时,微球容易出现团聚现象,考虑原因为微球表面积累大量的正负电荷,颗粒形状极不规则,造成表面电荷的聚集,使微球极不稳定,导致载药量和包封率开始下降。微球粘连时是少量微球连在一起,而微球团聚时会有大量微球聚集相连,团聚严重时基本上找不到单个微球,而分散在乳液中的明胶分子与乳化剂接触不均匀,形成的微球直径差别也较大,从而导致载药量和包封率开始下降。另外,本研究显示,当明胶与氧氟沙星质量比增加时,载药量和包封率先增大后降低,考虑原因为明胶与乳化剂相互碰撞的机会较均匀,生成微球的直径相差较小所致。另外,随着乳化剂Span80体积分数的增加,氧氟沙星明胶微球的载药量和包封率增大,当体积分数超过2.5%时,微球的载药量和包封率开始下降,原因可能为当乳化剂的体积分数增大到一定值时,对乳液界面的表面张力影响变小,不能分散成稳定的液滴,从而导致微球的载药量和包封率开始下降。
综上所述,本研究认为制备氧氟沙星明胶微球最佳制备工艺条件为:明胶质量分数20%,油水相体积比为3.5∶1,明胶与氧氟沙星质量比1∶1,Span80体积分数2.5%。在此条件下,氧氟沙星明胶微球的载药量和包封率可达到约80%。
[1]Pan ZP,Zhang RL.Determination of dydonine hydrochloride and fo⁃loxacin in compound oflosacin spray by dual-wavelength spactro⁃photometry[J].Strait Pharm J,2014,26(1):79-80.[潘张鹏,章如玲.双波长紫外分光光度法测定复方氧氟沙星喷雾剂中盐酸达克罗宁和氧氟沙星的含量[J].2014,26(1):79-80].doi:10.3969/j. issn.1006-3765.2014.01.030.
[2]Kawadkar J,Jain R,Kishore R,et al.Formulation and evaluation of flurbiprofen-loaded genipin cross-linked gelatin microspheres for intra-articular delivery[J].J Drug Target,2013,21(2):200-210.doi: 10.3109/1061186X.2012.745549.
[3]Goswami Smita L,Patel Nirav B,Hemant T,et al.Development and validation of rp-uplc method for estimation of ofloxaxcin in their dosage form[J].International J Pharm Pharm Sci,2012,4(Suppl): 275-278.
[4]Mangkorn Srisa-Ard,Yodthong Baimark.Controlling conformation⁃al transition of silk fibroin microspheres by water vapor for con⁃trolled release drug delivery[J].Particul Sci Technol,2013,31(4): 379-384.doi:10.1080/02726351.2013.766289.
[5]Ma FF,Wang T,Zhang QY,et al.Chemotherapy with fluorouracil microspheres for gastric carcinoma[J].Tianjin Med J,2008,36(2): 130-132.[马菲菲,王涛,张庆瑜,等.5-氟尿嘧啶聚乳酸载药微球用于胃癌治疗的研究[J].天津医药,2008,36(2):130-132].doi: 10.3969/j.issn.0253-9896.2008.02.016.
[6]Kaewruang P,Benjakul S,Prodpran T,et al.Impact of divalent salts and bovine gelatin on gel properties of phosphorylated gelatin from the skin of unicom leatherjacket[J].Lwt-Food Sci Technol,2014,55(2):477-482.doi:10.1016/j.foodchem.2013.09.111.
[7]Nitta N,Ohta S,Sonoda A,et al.Evaluation of the embolic effect and degradability of gelatin microspheres and gelpart particles[J]. Minim Invasiv Ther,2013,22(3):157-164.doi:10.3109/13645706. 2012.719909.
[8]Banerjee S,Singh S,Bhattacharya SS,et al.Trivalent ion crosslinked pH sensitive alginate-methyl cellulose blend hydrogel beads from aqueous template[J].Int J Biol Macromol,2013,57(6):297-307.doi:10.1016/j.ijbiomac.2013.03.039.
[9]Li XJ,Li XC.Content determination of ofloxacin in tablets by UV-spectrohotometry[J].Drug Evaluation,2005,2(4):290-291.[李小军,李绪翠.紫外分光光度法测定氧氟沙星片的含量[J].药品评价, 2005,2(4):290-291].doi:10.3969/j.issn.1672-2809.2005.04.014.
[10]LimSM,EomHN,Jiang HH,et al.Evaluation of PEGylated exendin-4 released from poly(Lactic-co-Glycolic Acid)microspheres for an⁃tidiabetic therapy[J].J Pharm Sci,2015,104(1):72-80.doi:10.1002/ jps.24238.
[11]Toyama T,Nitta N,Ohta S,et al.Clinical trial of cisplatin-conjugat⁃ed gelatin microspheres for patients with hepatocellular carcinoma[J].Jpn J Radiol,2012,30(1):62-68.doi:10.1007/s11604-011-0010-2.
[12]Verret V,Wassef M,Pelage JP,et al.M,Influence of degradation on inflammatory profile of polyphosphazene coated PMMA and tri⁃sacryl gelatin microspheres ina sheep uterine artery embolization model[J].Biomaterials,2011,32(2):339-351.doi:10.1016/j.bioma⁃terials.2010.09.001.
[13]Tiwari S,Chaturvedi AP,Tripathi YB,et al.Macrophage-specific tar⁃geting of isoniazid through mannosylated gelatin microspheres[J].Aaps pharmscitech,2011,12(3):900-908.doi:10.1208/s1224 9-011-9654-6.
[14]Solorio LD,Viereqqe EL,Dhami CD,et al.Engineered cartilage via selfassembled hMSC sheets with incorporated biodegradable gelatinmi⁃crospheres releasing transforming growth factor-β1[J].J Control Re⁃lease,2012,158(2):224-232.doi:10.1016/j.jconrel.2011.11.003.
(2014-11-07收稿 2014-12-15修回)
(本文编辑 陆荣展)
Study in preparation of ofloxaxcin gelatin microspheres
ZHANG Weiguang,DI Kai
College of Chemistry and Chemical Engineering,Qiqihar Unversity,Qiqihar 161006,China
ObjectiveTo study the optimum condition of preparing ofloxaxcin gelatin microspheres.MethodsOflox⁃axcin gelatin microspheres were manufactured using the emulsion chemical-cross linking method and gelatin was employed as carrier,liquid paraffin as oil phase,Span80 as emulsifier,.The loading capability and entrapment efficiency of the ofloxax⁃cin gelatin microspheres were determined by UV Spectrophotometry.The effect of gelatin concentration,oil/water volume ra⁃tio,gelatin/ofloxaxcin mass ratio and volume fraction of span80 on drug loading capability and entrapment efficiency were in⁃vestigated.The optimum proportions of each component was obtained by L9(34)orthogonal test,based on the above 4 factors, using sum of drug loading capability and entrapment efficiency as evaluation index.ResultsThe optimum condition for
Ofloxaxcin;polygeline;microspheres;technology,pharmaceutical;drug carriers;drug evaluation
R944
A
10.11958/j.issn.0253-9896.2015.10.015
黑龙江齐齐哈尔,齐齐哈尔大学化学与化学工程学院(邮编161006)
张伟光(1970),男,硕士,副教授,主要从事药物脂质体、精细化学品及大豆磷脂的应用研究
manufacturing high quality ofloxaxcin gelatin microspheres used 20%of gelatin concentration,water/oil volume ratio at 3.5∶1, gelatin/ofloxaxcin mass ratio at 1∶1,the span 80 volume fraction of 2.5%.ConclusionDrug loading capability and entrap⁃ment efficiency of the ofloxaxcin gelatin microspheres reached 80%using this manufacture technology therefore the prepara⁃tion was stable and feasible.



