景文莉,张向群
骨髓间充质干细胞移植对慢性胰腺炎大鼠模型胰腺纤维化的影响
景文莉1,张向群2
目的观察骨髓间充质干细胞(BMSCs)移植对慢性胰腺炎大鼠模型胰腺纤维化的影响,并探讨其作用机制。方法将30只健康雄性SD大鼠随机分为对照组、模型组和移植组,每组10只。模型组采用胆胰管逆行注射油酸法制备大鼠慢性胰腺炎模型,对照组以同样方式仅注射相同体积生理盐水,移植组在造模后1周和5周经尾静脉注射BMSCs。分别于造模后第1、4和8周称量3组大鼠体质量,于第8周后剖杀动物,取胰腺组织行HE染色和饱和苦味酸-天狼猩红染色观察胰腺组织病理学改变并评分,采用ELISA法检测胰腺组织转化生长因子(TGF)-β1、Ⅰ型胶原和Ⅲ型胶原含量。结果造模后第4周,模型组和移植组大鼠体质量均低于对照组(P<0.05),模型组与移植组间差异无统计学意义(P>0.05);至第8周,模型组和移植组大鼠体质量仍低于对照组,而移植组高于模型组(P<0.05)。模型组大鼠胰腺组织纤维化评分升高、TGF-β1、Ⅰ型胶原和Ⅲ型胶原含量均高于对照组和移植组(P<0.05);移植组胰腺组织纤维化评分高于对照组,TGF-β1、Ⅰ型胶原和Ⅲ型胶原含量与对照组差异无统计学意义。结论BMSCs移植能减少慢性胰腺炎大鼠胶原分泌,降低胰腺纤维化程度,其机制可能与抑制TGF-β1分泌有关。
胰腺炎,慢性;纤维化;转化生长因子β1;胶原Ⅰ型;胶原Ⅲ型;骨髓间充质干细胞
慢性胰腺炎的最主要病理特征是胰腺实质纤维化,这种纤维化是不可逆的,呈进行性发展,最终导致胰腺功能受损。转化生长因子(transforming growth factor,TGF)-β1在胰腺胶原生成、分泌和沉积在细胞外的过程中起关键作用,被认为是促进胰腺纤维化发生和发展的主要细胞因子[1]。胰腺纤维化的治疗一直是消化内科、消化外科医生努力攻克的难题,但目前仍无有效药物投入临床。董育玮等[2]采用精氨酸腹腔注射法制备实验性慢性胰腺炎大鼠模型,对制模后不同时点骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)的数目和增殖能力进行检测,发现BMSCs经历了先增加后减少的过程。BMSCs数目的减少和增殖能力的下降阻碍了胰腺损伤的修复,同时也提示具有多向分化潜能的BMSCs移植可能有助于损伤胰腺组织的修复。另有研究显示,BMSCs移植能修复大鼠慢性胰腺损伤,其机制可能与减少细胞因子释放,抑制炎症反应有关[3]。本研究采用胆胰管逆行注射油酸法制备大鼠慢性胰腺炎模型,探讨BMSCs移植对慢性胰腺炎大鼠胰腺纤维化的影响及其作用机制,以期为BMSCs治疗慢性胰腺炎提供参考。
1材料与方法
1.1材料(1)实验动物。SPF级雄性Sprague-Dawley (SD)大鼠10只,体质量120~140 g,平均(129.3±5.4)g,用于制备BMSCs;SPF级雄性SD大鼠30只,体质量200~220 g,平均(204.6±9.1)g,用于制备慢性胰腺炎模型,均由中国军事医学科学院动物中心(北京)提供。(2)主要试剂与仪器。油酸购自美国Sigma公司;饱和苦味酸-天狼猩红染色液购自罗基(北京)生物技术有限公司;TGF-β1、Ⅰ型胶原、Ⅲ型胶原ELISA检测试剂盒购自美国Uscnlife公司。MultiSkan FC酶标仪购自美国Thermo公司,超速离心机购自美国Beckmann公司,TG150型二氧化碳培养箱购自法国Jouan公司,XL100流式细胞仪购自美国COULTER公司。
1.2方法
1.2.1大鼠BMSCs的分离、培养和鉴定用断颈法急性处死大鼠并消毒,无菌条件下取股骨及胫骨。用BMSCs标准培养液冲洗骨髓腔,冲出细胞悬液离心,弃上清液,小心叠加到密度为1.077 g/mL的Ficoll-Paque淋巴细胞分离液上层,取单个核细胞层,以1×106个/cm2密度接种到75 cm2培养瓶中培养。隔日全量换液。待原代细胞生长至瓶底的80%~90%时,用0.25%胰蛋白酶液和0.02%EDTA液消化细胞,离心后重新加入标准培养液悬浮细胞,以1:1比例传代细胞。用倒置相差显微镜观察BMSCs的形态学变化,用流式细胞技术检测第2代细胞表面CD90、CD34、CD31的表达情况鉴定BMSCs[4-6]。取第2代BMSCs用于慢性胰腺炎大鼠静脉注射。
1.2.2大鼠慢性胰腺炎模型制备和处理采用随机数字表将30只体质量为200~220 g的大鼠分为对照组、模型组和移植组,每组10只。模型组参照Kataoka等[7]方法,采用胆胰管逆行注射油酸法制备大鼠慢性胰腺炎模型。大鼠禁食不禁水12 h,以10%水合氯醛腹腔注射麻醉,固定,备皮,铺消毒巾,腹正中切口进入腹腔。用无损伤小血管夹夹闭胰胆管近肝端暂时阻断胆汁流出,沿幽门找到十二指肠,将其提至切口外,在十二指肠开口的胰胆管处,取5号针头穿刺胰胆管开口对侧缘十二指肠壁后,用静脉留置针导管逆行插入胆胰管内1.0 cm,通过匀速微量注射器注入油酸60 μL,在5 min内注射完毕。以无损伤缝线缝合十二指肠壁穿刺点,关腹。对照组以同样方式仅注射相同体积生理盐水。移植组在造模后1周和5周经尾静脉注射含2×106个BMSCs的生理盐水细胞悬液。分别于造模后第1、4和8周测量大鼠体质量,于第8周后剖杀取胰腺,一半行HE染色和饱和苦味酸-天狼猩红染色观察胰腺组织病理学改变并评分,另一半置于-80℃保存用于检测TGF-β1、Ⅰ型胶原和Ⅲ型胶原含量。
1.2.3饱和苦味酸-天狼猩红染色大鼠胰腺组织用4%甲醛固定,石蜡包埋,4~6µm连续切片,苦味酸天狼猩红液浸染1 h,自来水洗,苏木素复染核、封片,显微镜下观察胰腺纤维化程度。每个切片随机读取10个视野,根据纤维化在整个视野所占的比例进行胰腺纤维化评分:0=0%,1=1%~25%,2=26%~50%,3=51%~100%[8]。
1.2.4 TGF-β1、Ⅰ型胶原和Ⅲ型胶原含量测定取冻存胰腺组织100 mg,加入裂解液1 mL,匀浆,按总蛋白提取试剂盒(武汉博士德生物工程有限公司)说明书提取组织总蛋白。采用ELISA法检测TGF-β1、Ⅰ型胶原和Ⅲ型胶原含量,实验操作严格按照试剂盒说明进行。
1.3统计学方法采用SPSS 17.0软件进行统计分析。计量数据以均数±标准差(x ±s)表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠一般情况模型组大鼠造模后第2天出现竖毛、倦卧少动、进食减少,第3周开始出现消瘦、稀便,部分大鼠腹部可触及肿块。移植组大鼠一般情况、症状和体征较模型组减轻,对照组未见异常。造模后第1周3组大鼠体质量无明显差异(P>0.05);造模后第4周,模型组和移植组大鼠体质量均低于对照组(P<0.05),模型组与移植组间差异无统计学意义(P>0.05);至第8周,模型组和移植组大鼠体质量仍低于对照组,而移植组高于模型组(P<0.05),见表1。
2.2胰腺病理学改变普通光学显微镜下Ⅰ型和Ⅲ型胶原纤维均呈红色。对照组胰腺小叶轮廓清晰,腺泡细胞形态正常,排列整齐;模型组可见Ⅰ型和Ⅲ型胶原纤维交织成网络,呈弥漫性增生,小叶结构被破坏,腺泡萎缩变形;移植组胰腺小叶纤维组织增生和腺泡结构破坏程度较模型组减轻,见图1。对照组、移植组、模型组胰腺纤维化评分(分别为0.312±0.106、1.264±0.331、2.741±0.496)依次升高,组间多重比较差异均有统计学意义(F=67.45,n=10,P<0.05)。
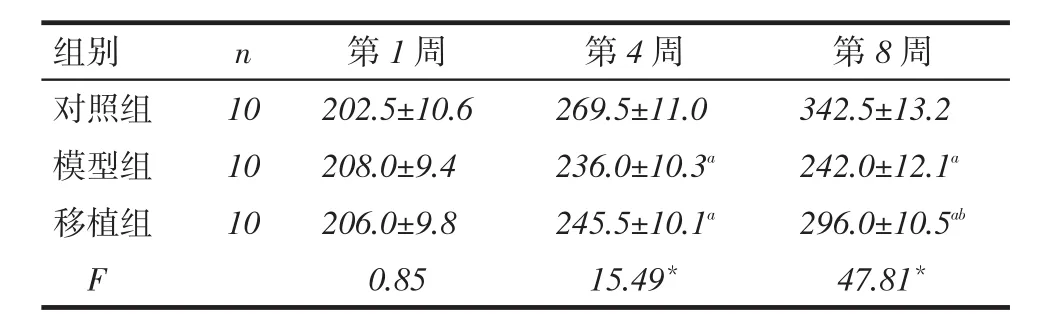
Tab. 1 Comparison of body weights between three groups of rats表1 3组大鼠体质量比较 (g,x ±s)
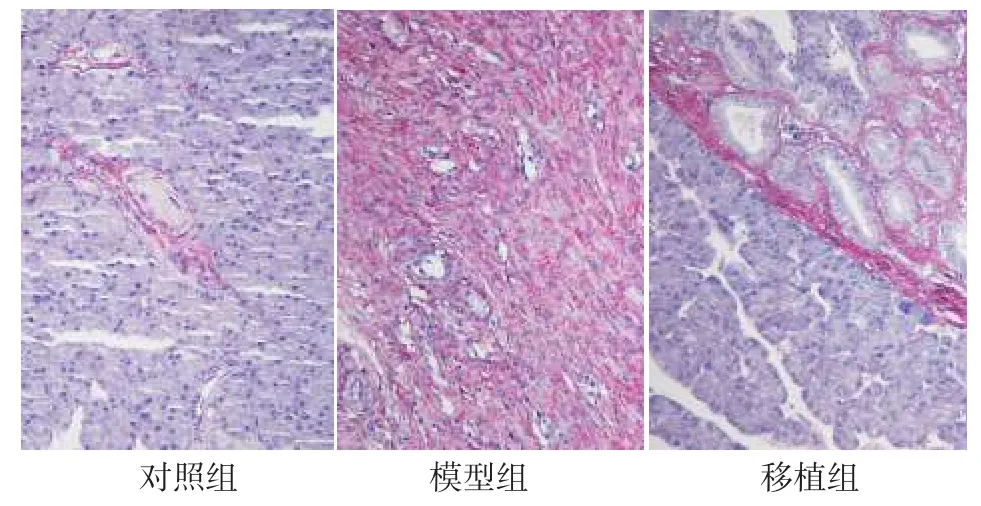
Fig.1 Comparison of pancreatic fibrosis between three groups of rats (Saturated picric acid-Sirius red staining,×200)图1 3组大鼠胰腺组织纤维化比较(饱和苦味酸-天狼猩红染色,×200)
2.3 TGF-β1、Ⅰ型胶原和Ⅲ型胶原含量模型组大鼠胰腺组织TGF-β1、Ⅰ型胶原和Ⅲ型胶原含量均高于对照组和移植组(均P<0.05);移植组与对照组差异均无统计学意义,见表2。
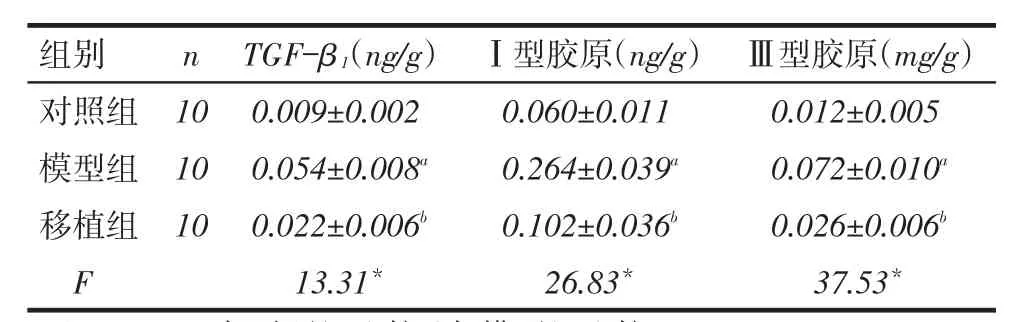
Tab. 2 Comparison of the contents of TGF-β1,typeⅠcollagen and typeⅢcollagen between three groups of rats表2 3组大鼠胰腺组织TGF-β1、Ⅰ型胶原、Ⅲ型胶原含量比较 (x ±s)
3 讨论
慢性胰腺炎是指由于各种原因引起胰腺组织和功能的持续性损害,其病理特征为胰腺纤维化。油酸是一种酸性不饱和脂肪酸,具去污剂特性,能作用于细胞膜使细胞迅速溶解。本研究采用胆胰管逆行注射油酸复制大鼠慢性胰腺炎模型,使油酸直接损伤胰腺腺泡,引起胰腺组织坏死与炎症,模拟胰腺损伤、修复与纤维化过程。既往研究证实这是一种适合研究慢性胰腺炎病理生理过程和药物干预的动物模型[3,7]。本研究中在胆胰管逆行注射油酸后8周可见腺泡细胞退化萎缩,小叶及导管周围广泛纤维化等典型胰腺慢性炎症表现。
目前慢性胰腺炎的治疗以减轻腹痛、解除梗阻、帮助消化等对症治疗为主,对阻止胰腺纤维化进展尚无有效方法。近年,有学者初步探讨了BMSCs对胰腺损伤修复的治疗作用。Jung等[9]在体外培养并用核染料标记大鼠BMSCs,然后回输到正常大鼠和急性胰腺炎的骨髓腔中,结果显示,在造模后2周,标记的BMSCs出现在正常胰腺组织和损伤胰腺组织中,而且在损伤胰腺组织中BMSCs的数量远远多于正常胰腺组织,提示BMSCs可参与胰腺的生理更新和病理再生,尤其是在胰腺损伤时,BMSCs能定植于胰腺并定向转化成胰腺细胞。本研究结果显示,在造模后第8周,移植组大鼠胰腺组织纤维化评分较模型组降低,提示移植的BMSCs有助于修复胰腺损伤,减轻纤维化。另外,模型组和移植组大鼠在造模后第4、8周体质量较对照组减轻,而移植组在造模后第8周体质量较模型组增加,提示BMSCs移植在减轻胰腺纤维化的同时还能改善大鼠胰腺外分泌功能,增加体质量。
细胞外基质沉积是导致慢性胰腺实质纤维化的重要原因。Ⅰ型、Ⅲ型胶原蛋白是构成细胞外基质的主要组分,胰腺组织Ⅰ型、Ⅲ型胶原含量增加有助于胰腺纤维化形成[10]。TGF-β1是目前已知的与胰腺纤维化形成关系最为密切的细胞因子,其可作用于多个环节,刺激胰腺星状细胞、成纤维细胞合成和分泌Ⅰ型胶原、Ⅲ型胶原,促进细胞外基质沉积[11]。本研究结果显示,在造模后第8周,BMSCs移植组大鼠胰腺组织TGF-β1、Ⅰ型和Ⅲ型胶原含量较模型组降低,与对照组差异无统计学意义,提示BMSCs移植可减轻慢性胰腺炎大鼠胰腺纤维化程度,且这一作用可能与其减少TGF-β1分泌有关。
[1]Vogelmann R,Ruf D,Wagner M,et al. Effects of fibrogenic mediators on the development of pancreatic fibrosis in a TGF-beta1 transgenic mouse model[J]. Am J Physiol Gastrointest Liver Physiol,2001,280(1):G164-172.
[2]Dong YW,Zhao H,Zhang RL,et al. Changes of reproductive activity of bone marrow mesenchymal stem cells in experimental chronic pancreatitis rats[J]. J Diagn Concepts Pract,2013,12(3):290-293.[董育玮,赵航,张汝玲,等.实验性慢性胰腺炎大鼠骨髓间充质干细胞的检测[J].诊断学理论与实践,2013,12(3):290-293].
[3]Liu HB,Yang J,Li DH,et al. Transplantation of bone marrow mesenchymal stem cells for repair of chronic pancreatic injury in rats [J]. Journal of Clinical Rehabilitative Tissue Engineering Research,2010,14(23):4257-4261.[刘洪斌,杨静,李东华,等.骨髓间充质干细胞移植修复大鼠慢性胰腺损伤[J].中国组织工程研究与临床康复,2010,14(23):4257-4261].
[4]Zhang XQ,Wang XP,Jing WL,et al. Experimental study on mesenchymal stem cells transplantating for treatment cerebral ischemia in rats through vena caudalis paths[J]. J Apoplexy and Nervous Diseases,2010,27(9):796-800.[张向群,王新平,景文莉.尾静脉移植骨髓间充质干细胞治疗脑缺血损伤大鼠的研究[J].中风与神经疾病杂志,2010,27(9):796-800].
[5]Yan F,Zhang YL,Yue W,et al. Application and assessment of quality of life questionnaires in Parkinson’s disease[J]. Chin J Contemp Neurol Neurosurg,2014,14(11):1000-1006.[闫峰,张越林,岳伟,等.体外构建纯化骨髓间充质干细胞与壳聚糖生物支架复合体的实验研究[J].中国现代神经疾病杂志,2014,14(11):1000-1006].
[6]Bai YH,Wang JP,Wang JS,et al. The influence of different infusion methods of bone marrow mesenchymal stem cells in adriamycin nephropathy rat model[J]. Tianjin Med J,2013,41(12):1180-1183.[白彝华,王家平,王剑松,等.不同输注途径移植骨髓间充质干细胞对阿霉素肾病大鼠疗效初探[J].天津医药,2013,41(12):1180-1183].
[7]Kataoka K,Sasaki T,Yorizumi H,et al. Pathophysiologic studies of experimental chronic pancreatitis in rats induced by injection of zein-oleic acid-linoleic acid solution into the pancreatic duct[J]. Pancreas,1998,16(3):289-299.
[8]Zhang SK,Cui NQ,Zhuo YZ,et al. Modified Xiaochaihu decoction prevents the progression of chronic pancreatitis in rats possibly by inhibiting transforming growth factor-β1/Sma and mad-related proteins signalingpathway[J]. Chin JIntegr,2013,19(12):935-939.
[9]Jung KH,Song SU,Yi T,et al. Human bone marrow-derived clonal mesenchymal stem cells inhibit inflammation and reduce acute pancreatitis in rats[J]. Gastroenterology,2011,140(3):998-1008.
[10]Apte MV,Yang L,Phillips PA,et al. Extracellular matrix composition significantly influences pancreatic stellate cell gene expression pattern:role of transgelin in PSC function[J]. Am J Physiol Gastrointest Liver Physiol,2013,305(6):G408-417.
[11]Qin T,Liu CJ,Zhang HW,et al. Effect of the IkBα mutant gene delivery to mesenchymal stem cells on rat chronic pancreatitis[J]. Genet Mol Res,2014,13(1):371-385.
(2015-07-07收稿2016-01-15修回)
(本文编辑陈丽洁)
The effects of bone marrow mesenchymal stem cell transplantation on pancreatic fibrosis in rats with chronic pancreatitis
JING Wenli1,ZHANG Xiangqun2
1 Tianjin Medical College,Tianjin 300222,China;2 General Hospital of Tianjin Medical University Corresponding Author E-mail:zhangxiangqun-1@163.com
Objective To investigate the effects and mechanisms of bone marrow mesenchymal stem cells(BMSCs)on pancreatic fibrosis in rats of chronic pancreatitis. Methods Thirty healthy male SD rats were randomly divided into three groups:control group,model group and transplanted group(n=10 for each group). Chronic pancratitis rat model was induced by retrograde injection of oleic acid into the biliopancreatic duct. The sham operation group was treated only with solvent. Transplanted group was given BMSCs through caudal vein injection at 1 week and 5 weeks after the model induction. All rats were weighed at 1 week,4 weeks and 8 weeks in three groups. After 8-week feeding,pancreatic tissues were harvested for HE and picric-sirius staining. The contents of transforming growth factor β1(TGF-β1),typeⅠcollagen and typeⅢcollagen were detcted by using ELISA. Results Compared with the control group,the weights of rats were decreased at 4 weeks and 8 weeks in model group and transplantated group(P<0.05). There were no significant differences in body weights between model group and transplantated group(P>0.05). The pancreatic fibrosis score and pathological injury were ameliorated signicantly in transplanted group. The contents of TGF-β1,typeⅠcollagen and typeⅢcollagen in pancreas were increased in model group than those of control group and transplanted group(P<0.05). Conclusion BMSCs transplantation can reduce the collagen secretion and reduce the degree of pancreatic fibrosis in rats with chronic pancreatitis,which may be related to the inhibition of the release of TGF-β1.
pancreatitis,chronic;fibrosis;transforming growth factor beta1;collagen typeⅠ;collagen typeⅢ;bone marrow mesenchymal stem cells
R576
A
10.11958/20150006
1天津医学高等专科学校(邮编300222);2天津医科大学总医院
景文莉(1975),女,副教授,硕士学位,主要从事微循环、干细胞移植等方面的研究通讯作者E-mail:zhangxiangqun-1@163.com



