李哲铭, 刘冬冬, 陈攀, 赵伊立, 孙发, 邢俊平, 唐开发*
(1.贵州医科大学附院 泌尿外科, 贵州 贵阳 550004; 2.贵州省人民医院, 贵州 贵阳 550004; 3.西安交通大学医学院第一附属医院 泌尿外科, 陕西 西安 710061)
引起男性不育的因素有很多,根据生殖环节可分为睾丸前、睾丸、睾丸后三大因素,特发性男性不育是指致病原因不明的不育,可能通过其中的一个或多个因素引起[1]。活性氧(ROS)是正常生理过程的产物,正常水平的ROS有利于维持精子获能及顶体反应等精子生理功能,而高水平ROS可通过破坏精子结构引起男性不育[2-4]。谷胱甘肽S-转移酶(glutathione S-transferases,GSTs)能促进亲电子物质及应激氧化产物与还原型谷胱甘肽结合,维持氧化还原系统的动态平衡[5-6]。GSTT1、GSTM1和GSTP1基因编码Theta、Mu和Pi亚型酶,其不同基因型在人群中存在功能差异[7-8],影响GSTs酶活性,进而导致机体氧化应激水平的差异[9]。本研究分析GSTT1、GSTM1及GSTP1基因多态性与特发性男性不育患者氧化应激水平及精子DNA氧化损伤之间的关系,为临床特发性男性不育症患者的诊疗提供参考。
1 对象与方法
1.1 研究对象
收集2008年9月-2012年6月泌尿外科门诊就诊的246例特发性男性不育症患者作为受试对象,年龄21~34岁、平均(27.0±3.6)岁。纳入标准:(1)有规律性生活1年以上,未采取任何避孕措施女方未受孕;(2)常规进行2次或以上精液分析,精子密度小于15×106/mL或精子总数小于39×106,精子前向活率小于32%[10]。排除已知原因如外伤、隐睾症、生殖系统感染、染色体核型异常、输精管道梗阻及血清性激素水平异常等导致的不育。本研究方案经医院伦理委员会批准,所有研究对象均知情同意并签署知情同意书。
1.2 方法
1.2.1GSTT1、GSTM1、GSTP1基因分型 抽取研究对象外周静脉血3 mL,严格按照全血基因组DNA提取试剂盒说明书提取DNA。参照文献[11],采用聚合酶链反应(PCR)对GSTT1、GSTM1进行基因分型,采用限制性片段长度多态性聚合酶链反应(PCR-RFLP)对GSTP1基因进行分型,GSTT1、GSTM1、GSTP1及β-actin基因引物均由上海生物工程公司设计并合成。GSTT1基因上游引物为5′-TTCCTTACTGGTCCTCACATCTC-3′、下游引物为5′-TCACCGGATCATGGCCAGCA-3′,GSTM1基因上游引物为5′-GAACTCCCTGAAAAGCTAAAGC-3′、下游引物为5′-GTTGGGCTCAAATATACGGTGG-3′,GSTP1基因上游引物为5′-ACCCCAGGGCTCTATGGGAA-3′、下游引物为5′-TGAGGGCAC AAGAAGCCCCT-3′;β-actin为内参照,上游引物为5′-ACTCCCCATCCCAAGAC C-3′、下游引物为5′-CCTTAATGTCACGCACGAT-3′[11]。采用Biomltra梯度PCR仪对目的基因进行扩增,反应体系25 μL,反应条件为95 ℃预变性5 min,94 ℃变性30 s,退火30 s(GSTM1 60 ℃,GSTT1 63 ℃,GSTP1 58 ℃,β-action61 ℃),72 ℃延伸30 s,共30个循环;72 ℃延伸7 min。采用BsmAI(ALW26I)限制性内切酶对GSTP1基因扩增产物进行处理,扩增产物及酶切产物用2%琼脂糖凝胶电泳检测。
1.2.2精浆及精子DNA中氧化应激相关指标检测 精液采集方法按第4版《WHO人类精液及精子-宫颈黏液作用实验室检验手册》[10]标准执行:禁欲3~7 d,用手淫法采集精液置于干燥无菌取精杯中,用Chelex-100提取精子总DNA;将精液置于37 ℃培养箱内液化,1 000 r/min离心获得精浆,采用ELISA法测定精浆中丙二醛(MDA)、一氧化氮(NO)、总抗氧化能力(T-AOC)水平以及精子DNA中8-羟基脱氧鸟苷(8-OH-dG)水平,严格参照试剂盒说明书进行操作。
1.3 统计学分析

2 结果
2.1 GSTT1、GSTM1、GSTP1基因多态性
如图1、图2所示,GSTT1基因扩增产物长度为480 bp,GSTM1基因扩增产物长度为219 bp,GSTP1基因扩增产物长度为177 bp;经BsmAI(ALW26I)限制性内切酶酶切后,野生型(A/A)产物长度为177 bp,突变纯合型(G/G)产物长度为87 bp及90 bp,突变杂合型(A/G)产物长度为177 bp、87 bp及90 bp,β-actin内参照扩增产物长度为400 bp。246例特发性男性不育患者中,GSTM1(+)及GSTM1(-)患者分别为97、149例,GSTT1(+)及GSTT1(-)患者分别为92、154例,GSTM1/GSTT1(+/+)、GSTM1/GSTT1(+/-)、GSTM1/GSTT1(-/+)及GSTM1/GSTT1(-/-)患者分别为38、59、54及95例,GSTP1(A/A)GSTP1(A/G+G/G)及患者分别为167、79例。
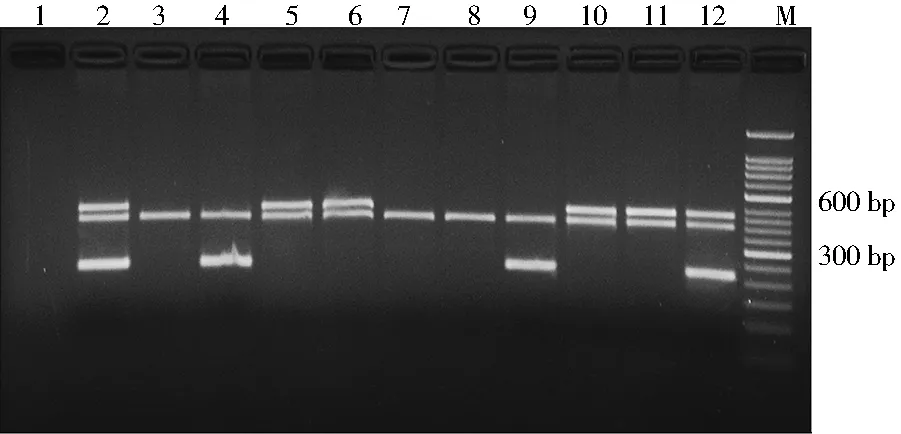
注:泳道1为阴性对照,泳道2、12为GSTM1/GSTT1(+/+),泳道3、7、8为GSTM1/GSTT1(-/-),泳道4、9为GSTM1/GSTT1(+/-),泳道5、6、10、11为GSTM1/GSTT1(-/+),M为50 bp DNA maker。图1 GSTs酶GSTT1及GSTM1基因扩增产物凝胶电泳Fig.1 Gel electrophoresis for glutathione S-transferase M1 and T1 gene polymorphisms

注:泳道1为阴性对照,泳道2、6为突变纯合型(G/G),泳道3、4、9、11为野生型(A/A),泳道5、7、8、12为突变杂合型(A/G),M为50 bp DNA maker。图2 GSTs酶GSTP1基因扩增产物经BsmAI(ALW26I)酶切后凝胶电泳Fig.2 Gel electrophoresis for GSTP1 gene amplification products digestion by BsmAl enzyme
2.2 GSTT1、GSTM1、GSTP1基因多态性与精液氧化应激水平
GSTM1(-)组精浆NO及精子DNA中8-OH-dG水平显着高于GSTM1(+)组,差异有统计学意义(P<0.01);GSTT1(-)组精浆NO及精子DNA中8-OH-dG水平显着高于GSTT1(+)组,差异有统计学意义(P<0.01);GSTM1/GSTT1(-/-)组精浆MDA、NO及精子DNA中8-OH-dG水平高于GSTM1/GSTT1(+/+)组,差异有统计学意义(P<0.05),精浆T-AOC水平低于GSTM1/GSTT1(+/+)组,差异亦有统计学意义(P<0.05);GSTP1(A/G+G/G)组精浆NO及精子DNA中8-OH-dG水平高于GSTP1(A/A)组,差异有统计学意义(P<0.05),精浆T-AOC水平明显低于GSTP1(A/A)组,差异亦有统计学意义(P<0.01)。见表1。
3 讨论
既往研究认为氧化应激(OS)是影响生殖能力的重要因素之一,精子像其他细胞一样会产生自由基和活性氧物质[12]。OS是机体产生的ROS水平和机体抗氧化水平之间失去平衡后导致的结果。低水平的ROS被认为是精子的受精、顶体反应及获能过程所必须,同时低水平的ROS引起脂质过氧化,导致细胞膜的改变,从而促进精子和卵母细胞的交互融合[13-14]。正常生育男性精液中ROS与抗氧化系统处于平衡状态,当某些病理因素导致该平衡被打破后,过量的ROS可诱发精子DNA损伤、精子线粒体膜受损、精子活力下降、畸形精子增多及精子细胞凋亡等,从而导致男性不育[2,15]。

表1 特发性男性不育患者GSTT1、GSTM1、GSTP1基因多态性与精液氧化应激水平的关系Tab.1 The oxidative stress levels in GST genotype groups
注:与野生型(+、+/+或A/A)比较,(1)P<0.05,(2)P<0.01。
GSTs属于机体Ⅱ相解毒酶系统,是人体抗氧化系统最重要的成员之一,其可以催化外源性化学物质和内源性ROS及其代谢产物与还原性谷胱甘肽结合,进而促进这些有毒物质的代谢与灭活,减少对细胞的损害[16-17]。既往研究发现GSTs的基因多态性可影响其酶分子结构,从而影响酶的活性[18]。前期通过对精索静脉曲张患者GSTs基因分型及精液氧化应激水平测定,发现GSTM1及GSTT1基因缺失型的精索静脉曲张患者对氧化应激的敏感性较基因野生型患者明显增高[11]。另外,有研究发现在特发性男性不育症患者中,GSTM1及GSTT1基因多态性影响精子对氧化损伤的易感性[19-20]。
本研究采用ELISA方法对246名特发性男性不育症患者的精浆MDA、NO、T-AOC及精子DNA中8-OH-dG水平进行检测,同时对这些患者进行GSTs基因多态性测定。通过对相关数据进行统计学分析后发现,在特发性男性不育患者中GSTM1(-)及GSTT1(-)组中精浆NO及精子DNA中8-OH-dG水平分别显着高于GSTM1(+)及GSTT1(+)组(P<0.01),而GSTM1/GSTT1(-/-)组精浆MDA、NO及精子DNA中8-OH-dG水平高于GSTM1/GSTT1(+/+)组(P<0.05),而精浆T-AOC低于GSTM1/GSTT1(+/+)组(P<0.05),这就表明GSTT1(+)及GSTM1(+)患者精液氧化应激水平较GSTT1(-)及GSTM1(-)患者处于相对低水平。GSTP1(A/G+G/G)组中NO及精子DNA中8-OH-dG高于GSTP1(A/A)组(P<0.05),而精浆T-AOC水平显着低于GSTP1(A/A)组(P<0.01),意味着基因型为GSTP1(A/G)和GSTP1(G/G)的患者比基因型为GSTP1(A/A)的患者精液氧化应激水平更高。
综上所述,GSTs基因多态性可以影响特发性男性不育患者精浆氧化水平和精子DNA氧化损伤。由于引起特发性男性不育的机制较为复杂,同时影响机体氧化应激水平的因素有很多,本研究的样本量较少,且存在地域局限性,有待大样本、多中心进一步研究。



