龙黎, 罗新华, 张茜
(贵州省人民医院 感染科, 贵州 贵阳 550002)
研究发现,当乙型肝炎病毒(HBV)进入宿主肝细胞内时,核衣壳中松弛环状DNA(rcDNA)将易位到肝细胞核内,形成游离的闭合环状DNA(cccDNA),成为HBV前基因组RNA合成的模板[1]。在肝细胞胞浆中,HBV可以重新合成rcDNA再次进入肝细胞细胞核,以此来维持肝细胞中cccDNA池的稳定性[2]。因此,对cccDNA进行研究可为乙肝抗病毒治疗提供新的方向[3]。目前上市并用于抗乙肝病毒的药物有2类:一类是核苷(酸)类似物(NAs),它能有效抑制病毒复制及肝脏炎症活动,但对于cccDNA的作用较小[4-5];另一类是干扰素类(IFNs),在治疗时的血清学转换率高于NAs,但仍不能完全实现功能性治愈,并且药物不良反应较多,在肝硬化失代偿期、严重肝功不全、肺心肾等重要脏器功能障碍、自身免疫性疾病等患者禁用[6],即便采取不同方式联合或序贯治疗,功能性治愈率仍相当有限。CRISPR/Cas9是细菌的一种免疫防御系统,其主要作用是抵抗外源性入侵[7]。CRISPRRNA与反式激活rRNA可以通过碱基互补配对原则形成核蛋白复合物,引导Cas9蛋白对与crRNA配对的DNA靶点进行剪切[8]。有研究发现HBVcccDNA中的preS1段对于产生HBsAg起到关重要作用[4],因此,本研究以人肝癌HepAD38或HepG2.2.15细胞为研究对象,采用CRISPER/Cas9基因编辑技术对HBVcccDNA中的preS1段进行基因敲除后、使用传统抗病毒药物及免疫调节剂处理细胞,观察其抗病毒活性及细胞中HBV复制情况,报告如下。
1 材料与方法
1.1 研究材料
人肝癌HepAD38或HepG2.2.15细胞系由重庆医科大学病毒性肝炎研究所馈赠,杜尔贝科改良的Eagle培养基(DMEM)、胎牛血清、双抗购买自美国GIBCO公司,胰蛋白酶和DMSO购自 Hyclone 公司,DAPI(4′,6-二脒基-2-苯基吲哚)及 lipofectamine 2000购买自 Invitrogen 公司,质粒小提试剂盒购自天根生化科技(北京)有限公司,转染级质粒提取试剂盒购自 Promega 公司,Flag单克隆抗体购自Stratagene公司,乙型肝炎病毒表面抗原定量(HBsAg)定量检测使用雅培Abbott试剂盒,质粒构建、引物合成及 DNA测序由汉恒生物科技有限公司协助完成,乙型肝炎病毒核心相关抗原(HBcrAg)和乙型肝炎病毒前基因组RNA(HBV pgRNA)检测由金域检验完成。
1.2 研究方法
1.2.1HBVgRNA质粒构建及鉴定 选用pHBAAV-CMV-Sacas9-U6-gRNA作为载体,BsaI 单酶切pHBAAV-CMV-Sacas9-U6-gRNA载体,目的gRNA序列插入该载体2个BbsI酶切位点之间,由U6启动子启动。设计gRNA序列并安排合成引物,将单链的引物退火成双链,连接入线性化载体,转化子外送测序验证,将正确的克隆进行高纯度质粒抽提。gRNA1为5′-gGGAGCTGGAGCATTCGGGCT-3′,gRNA2为5′-gAGGAGCTGGAGCATTCGGG-3′,gRNA3为5′-gAGGTAGGAGCTGGAGCATT-3′。
1.2.2细胞培养 利用HepAD38细胞系通过培养基中Tet的存在与否来调节HBV的复制,从培养基中去除Tet后,HBV开始复制并从细胞中分泌出来,而添加Tet则能完全抑制HBV复制的原理[9-10]。去HepAD38细胞在杜尔贝科改良的DMEM中培养,培养基中分别添加10%灭活胎牛血清、100 000 IU/L青霉素、100 000 g/L链霉素、100 000 g/L卡那霉素、400 000 g/L的G418及300 g/L 的Tet(用于抑制HBV复制)或不添加任何Tet(用于诱导HBV复制)。HepG2.2.15细胞也使用DMED培养基培养,并向其中添加相同浓度的胎牛血清和双抗及谷氨酰胺2 mL。
1.2.3HBVpreS1敲除细胞系的建立 将表达嘌呤霉素抗性基因及Cas9、sgRNA的载体转入到HepAD38或HepG2.2.15细胞,在无Tet培养基中生长48 h,细胞的融合度达到85%~90%。加入4 g/L的嘌呤霉素进行细胞筛选,去除未转染成功的细胞,收集上清培养基和细胞进行ELISA和实时PCR检测。对照细胞包括未转导的HepAD38细胞作为HBV复制的阳性对照(无Tet的培养基中培养),因HepG2.2.15细胞与HepAD38细胞相似,能稳定分泌HBV病毒相关HBsAg、乙型肝炎病毒DNA(HBVDNA)、HBVpgRNA等病毒标志物,故选用未转导的HepG2.2.15细胞作为相关实验的阴性对照。
1.2.4细胞固定及细胞核染色 从37 ℃恒温箱中取出转染48 h的细胞,PBS清洗3次,加入4%甲醛溶液2 mL,室温固定25 min,PBS清洗3次,在中心区域加入4′,6-二脒基-2-苯基吲哚(DAPI)70 μL,置入37 ℃恒温孵箱内放置10 min进行细胞核染色,染色结束后用双蒸水清洗3次,在中心区域加入双蒸水100 μL,用Flag单克隆抗体标记,放入孵箱内孵育30 min,PBS清洗10min/次,共3次;加入二抗,室温下孵育30 min,清洗步骤同前;向中心区域加入双蒸水100 μL,在激光共聚焦显微镜下观察saCas9蛋白核定位情况。
1.2.5HBV-CRISPR和HepAD38系统中的抗病毒活性 将CRISPR处理的HepAD38细胞以及未经CRISPR处理的HepAD38细胞接种在96孔板中,每孔浓度约50 000个;再将TDF或IFN-α加入到CRISPR处理的HepAD38细胞的孔板中,最终浓度为0.001~10 mmol/L。空白对照HepAD38细胞的孔板中加入等体积DMSO。
1.2.6HBV复制 取HepAD38和HepG2.2.15细胞培养上清液,采用0.22 μm Millex®GP过滤器过滤,采用酶联免疫吸附试(ELISA)法检测上清液中HBsAg、HBcrAg的含量,用RT-PCR方法检测HBVDNA、pgRNA水平。
1.3 统计学方法
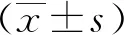
2 结果
2.1 HBV gRNA质粒的构建
将特异性干扰片段gRNA1、gRNA2及gRNA3分别连接入表达载体进行转化,转化子进行测序验证。序列分析表明插入片段gRNA1、gRNA2及gRNA3的基因序列与前期设计序列完全一致,插入方向正确,融合区域的读码框正确,表明质粒HBVgRNA构建成功。见图1。

注:灰色区域为目的序列。
2.2 荧光共定位HBV gRNA质粒转染HepAD38细胞
在共聚焦显微镜下观察到成功构建敲除细胞系的HepAD38细胞,分别发出蓝色、红色荧光,发出蓝色荧光为经DAPI染色的细胞核,发出红色荧光的为经Flag标记转染了gRNA的细胞,2者间有重叠。结果提示在HepAD38细胞中gRNA质粒与 DAPI染色具有共定位,2者能共同定位于细胞核上(图2)。
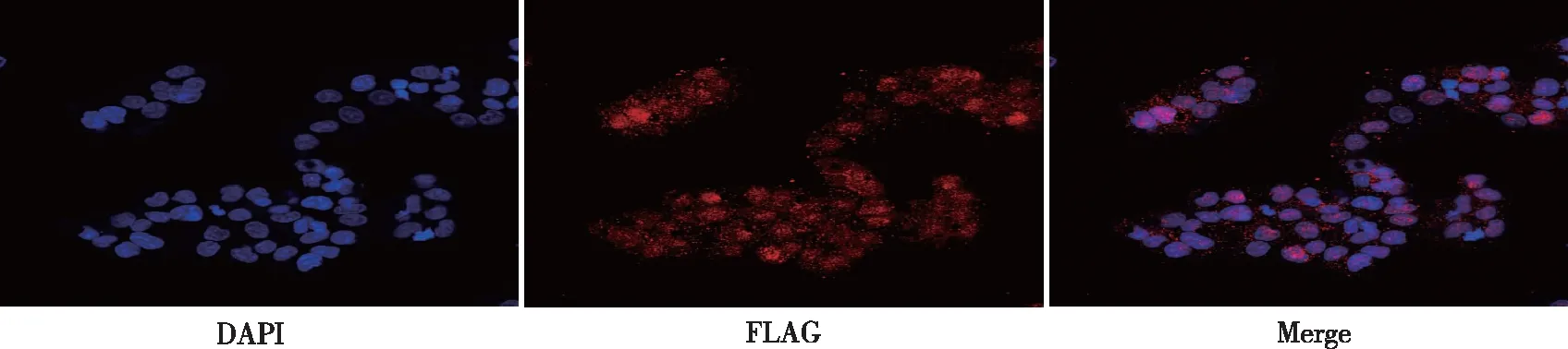
图2 HBV gRNA质粒在HepAD38细胞中的定位(荧光粒,×400)
2.3 Cas9/sgRNA组合靶向HBV对抗原分泌和病毒复制的影响
HepAD38细胞是一种很好的慢性乙肝病毒感染模型,可以检测Cas9/sgRNA组合是否对于HBV病毒具有抗病毒特性。结果显示HepG2.2.15细胞(阴性对照)和未经Tet处理的HepAD38细胞(阳性对照)上清液中HBVDNA、HBVRNA明显复制,HBsAg和HBcrAg水平明显升高,经Tet处理的HepAD38细胞中HBV复制明显抑制。经sgRNA干预的3株细胞HBV复制被明显抑制,上清中HBVDNA、HBVRNA、HBsAg和HBcrAg水平较两个对照组低,差异有统计学意义(P<0.05),并且sgRNA-3抗病毒作用最强。见图3。
注:(1)与阳性对照组相比,P <0.05;(2)与阳性对照组相比,P <0.001。
2.4 Cas9/sgRNA联合抗病毒药物的抗病毒作用
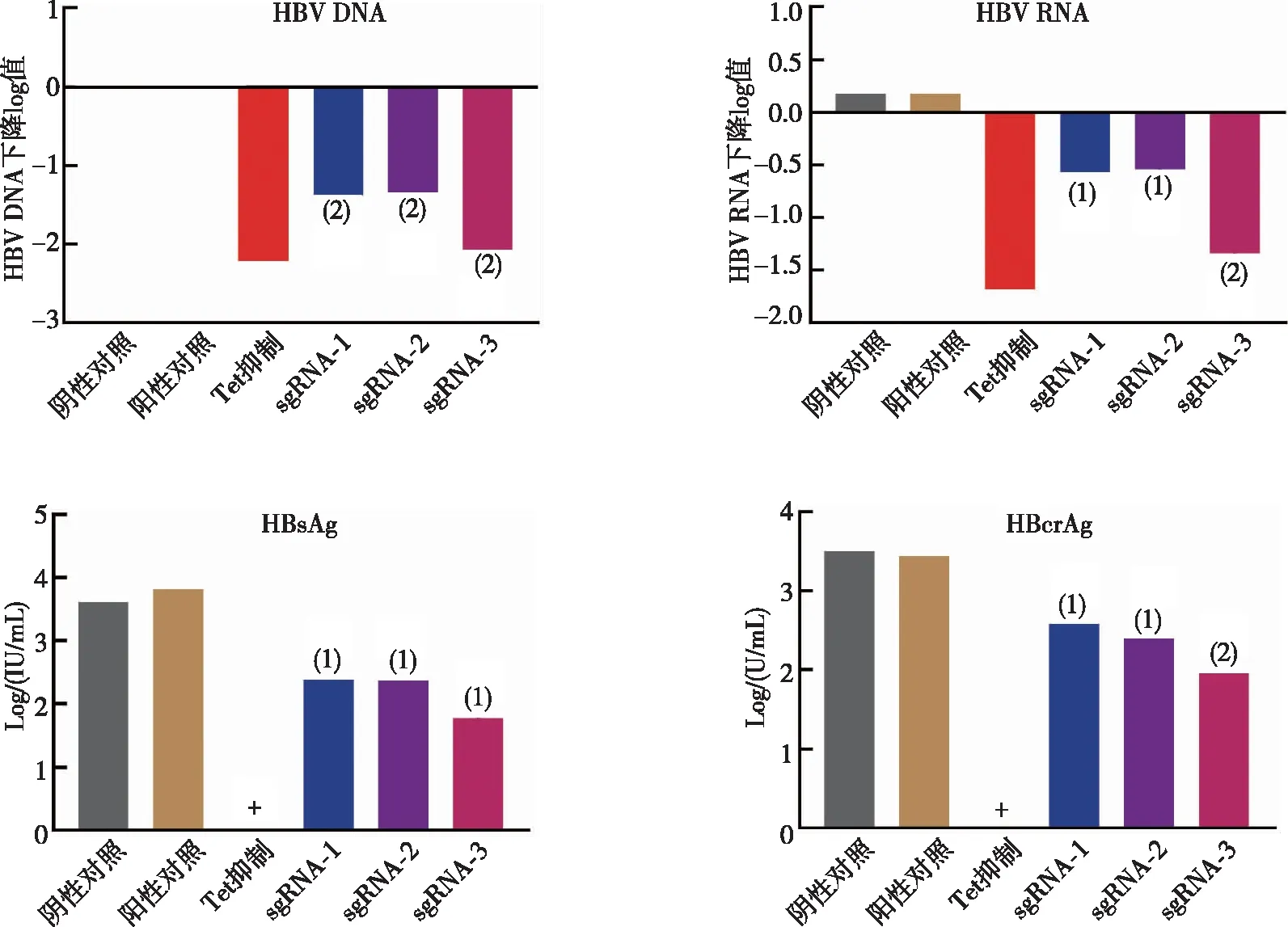
为了进一步评估逆转录酶抑制剂(TDF)和免疫调节剂(IFN-α)能否增强Cas9/sgRNA抗HBV复制的能力,本研究先评估了表达Cas9/sgRNA细胞和对照组细胞中的病毒抑制水平。选择抗病毒能力最强的sgRNA-3转染细胞,采用TDF或IFN-α处理后,检测细胞上清中抗原分泌和病毒复制情况,结果显示联合抗病毒治疗能有效增强抗病毒效应,细胞上清中的病毒复制水平和抗原水平均下降(P<0.05),并且sgRNA-3联合IFN-α对于抑制HBV RNA和HBsAg的分泌更有优势(图4)。
注:(1)与阳性对照组相比,P<0.05;(2)与阳性对照组相比,P<0.001。
3 讨论
尽管有有效的疫苗,但HBV仍然是一种严重的人类病原体,全世界每年有超过2.4亿人感染该病毒,有80万人因为肝硬化和肝癌而死亡[11]。HBVcccDNA作为病毒蛋白表达的转录模板,它的内在稳定性阻止了目前的抗病毒疗效[12-13]。因此,寻找清除cccDNA的方法被认为是治疗HBV感染的关键[13-14]。传统的核苷类似物如ETV和TDF为HBV 逆转录酶抑制剂,只能防止病毒粒子从HBV感染细胞中释放,由于cccDNA稳定存在于肝细胞中,因此HBV感染目前依然无法治愈[15]。最近,属于CRISPR/Cas家族的RNA引导的DNA内切酶被证明可以有效地切割和灭活HIV-1和HPV感染的人类细胞中的DNA病毒[16-18],针对HBVDNA基因组的Cas9/sgRNA是否也能切割和降低感染HBV的细胞中HBVDNA,包括cccDNA水平的问题,本研究设计了用于识别HBV基因组的开放阅读框S的保守序列,证明了CRISPR/Cas9系统可以有效地灭活慢性感染细胞中的HBV。
未来实现HBV感染的功能性治愈的治疗方法设想是不同抗病毒方法的结合[13-14,19]。特别是,体外工程设计核酸酶,如CRISPR/Cas9系统[20],似乎是HBV新型特异性联合治疗的很有前途的组成部分,在各种HBV模型系统中,CRISPR/Cas9的抗病毒作用已经被证实[21-24]。为了证明CRISPR/Cas9 RNA引导的核酸酶系统在HBV感染中的适用性,本研究在HBV基因组中选择了前S1区域作为靶位点,设计了3条不同的序列,并通过包含同源HBV DNA片段的指标结构确认所有3个sgRNAS都是活跃的。通过慢病毒转导将Cas9/sgRNA转染HepAD38细胞,并用标签标记,确认Cas9/sgRNA定位于细胞核中。为了确保任何观察到的抑制作用不仅仅反映单个整合的 HBV 拷贝的突变激活,本研究在转导前48 h去除了阻断 HepAD38细胞中 HBV 转录的 Tet,产生容易被检测到的未整合的 HBV DNA,结果显示在引入的3种HBV特异性Cas9/sgRNA质粒中的任何1种后,病毒DNA积累和抗原分泌都受到了很强的抑制。这与Lin等[25]报道当Cas9和HBV表达质粒能够共转染Huh7细胞时HBV特异性Cas9/sgRNA能够切割HBVDNA的结果一致。最后,本研究还测试了当与已知的HBV生命周期抑制剂(TDF)和免疫调节剂(IFN-α)一起使用时,Cas9/sgRNA的表达是否能够更有效地抑制HBV复制。结果显示,在HepAD38细胞中HBV特异性Cas9/sgRNA对HBV复制的抑制作用增强。
综上所述,本研究借助慢性HBV感染模型(HepAD38细胞)证明了Cas9/sgRNA靶向HBV DNA进行切割可以抑制HBV病毒的复制,当与HBV生命周期抑制剂(TDF)和免疫调节剂(IFN-α)一起使用时,能够更有效地抑制HBV复制。这一新的结果可为细菌CRISPR/Cas系统作为治疗DNA病毒感染的潜在方法提供了实质性的支持。



