刘 方,刘海莉,毛颖静,费小荣
氯吡格雷作为一种新型抗血小板药物在抑制支架内血栓及稳定斑块方面发挥了其重大作用,减少了心血管临床血栓事件的发生。随着氯吡格雷的广泛使用,氯吡格雷抵抗现象亦被证实存在,其发生原因包括氯吡格雷与同样经CYP3A4途径代谢的他汀药物相互作用这一可能机制。本研究旨在探讨不同代谢途径他汀药物是否影响了氯吡格雷的抗血小板作用。
1 资料与方法
1.1 临床资料 选取我院2015年7月—2016年5月诊治的急性冠脉综合征病人76例,其中男59例,女17例。入选标准:符合2012欧洲心脏病学会(ESC)急性冠脉综合征诊断和治疗指南的急性冠脉综合征诊断标准。采集静脉血检验血小板聚集率时所有病人均已接受阿司匹林肠溶片(0.1 g/d)、硫酸氢氯吡格雷(75 mg/d)口服双重抗血小板(DAPT)不间断治疗不少于7 d,且所有病人亦同步接受了他汀药物降脂不间断治疗(阿托伐他汀钙片每晚20 mg,或辛伐他汀片每晚20 mg,或氟伐他汀缓释片每晚80 mg)不少于7 d。排除标准:血小板减少症[血小板计数(PLT)<100×109/L)、PLT>450×109/L、严重肝肾功能不全、重度贫血(血红蛋白<90 g/L)、肿瘤、严重免疫性疾病病人。将病人分为CYP3A4途径代谢组39例与非CYP3A4途径代谢组37例。两组年龄、性别、吸烟史、糖尿病史及入院时收缩压、心率、血肌酐、N末端B型利钠肽原(NT-proBNP)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)比较,差异均无统计学意义(P>0.05)。详见表1。
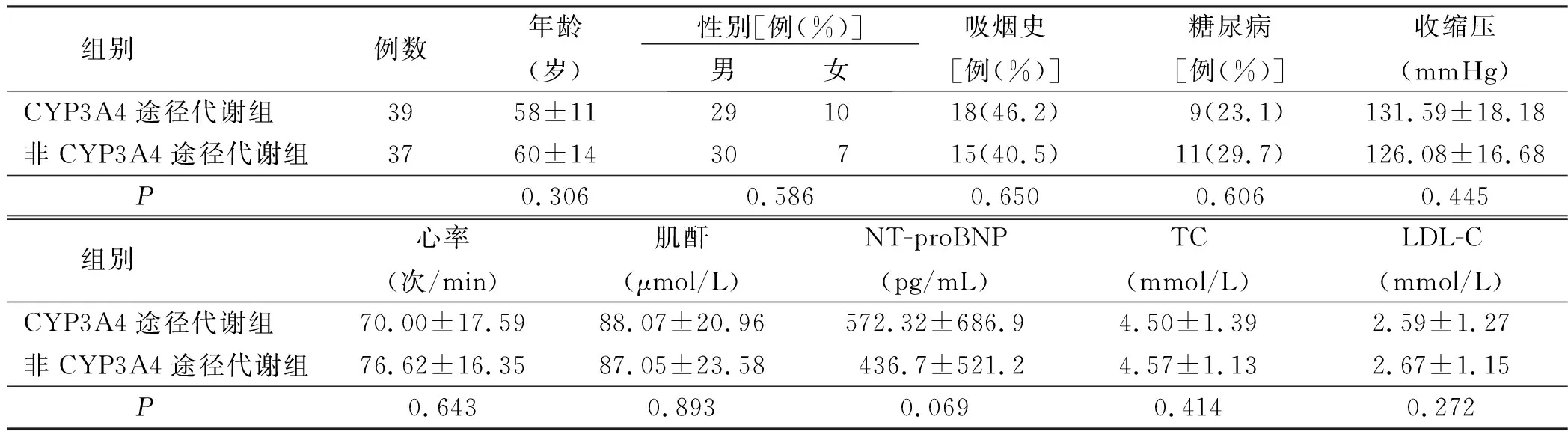
表1 两组基线资料比较
注:1 mmHg=0.133 kPa
1.2 试剂与仪器 二磷酸腺苷(ADP)(上海金穗生物科技有限公司),血小板聚集测试仪(美国Helena公司)。
1.3 研究方法 CYP3A4途径代谢组病人口服经CYP3A4途径代谢的降脂药物(阿托伐他汀钙或辛伐他汀片),非CYP3A4途径代谢组病人口服非CYP3A4途径代谢的降脂药物(氟伐他汀缓释片)。所有病人均采集空腹静脉血,3 h内采用比浊法完成(5 μmol/L)ADP诱导的血小板聚集率测定。
2 结 果(见表2)
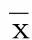
表2 两组ADP诱导血小板聚集率比较(±s) %
3 讨 论
氯吡格雷是一种口服的噻吩吡啶类抗血小板药物,其作用机制为不可逆地拮抗ADP P2Y12受体,从而抑制血小板的激活与聚集。在我国的临床应用也已有近20年历史,其起效快速、作用较强、不良反应较少,成为目前应用最为广泛的抗血小板药物之一。与阿司匹林相比,氯吡格雷被证实显着降低了动脉粥样硬化性血管疾病病人的缺血性卒中、心肌梗死及血管性死亡的风险[1]。此外,阿司匹林联合氯吡格雷应用(双重抗血小板治疗)使得急性冠脉综合征及经皮冠脉介入术(PCI)病人受益[2-4]。双重抗血小板治疗也因此成为急性冠脉综合征及PCI病人的常规治疗用药方案。然而,在具有充分获益证据的同时,相当一部分病人被发现仍然会反复经历心血管事件,尽管这些病人接受了规律的氯吡格雷治疗,其血小板功能并没有被有效地抑制。该现象被称作“氯吡格雷抵抗”,其机制现今并不明确。有研究表明,该现象发生率大约为4%~30%,甚至更高。有研究学者发现氯吡格雷抵抗在临床中的发生率为20.78%[5]。
氯吡格雷抵抗现象的发生机制至今尚无定论,药物间相互作用是其中一个可能的产生机制。氯吡格雷为无活性的前体药物,要成为有活性的抗血小板物质需要经过肝脏的细胞色素P450 CYP3A4和CYP3A5的氧化,而CYP3A4正是多种他汀等药物代谢的关键酶。临床上常用的阿托伐他汀、辛伐他汀、洛伐他汀均经CYP3A4代谢。他汀药物被广泛用于冠心病的一级、二级预防,且目前已经成为动脉粥样硬化性心血管疾病治疗的基石药物,2013年美国心脏病学会(ACC)/美国心脏学会(AHA)血脂指南推荐动脉粥样硬化性心血管疾病(ASCVD)的高危病人进行强化降脂治疗。2016年中国成人血脂异常防治指南(2016年修订版)指出,越来越多的临床研究证据证实了降胆固醇治疗对ASCVD一级预防和二级预防的有效性和安全性[6]。因此,他汀药物会与氯吡格雷一起应用。有学者研究认为,经CYP3A4通道代谢的他汀药物竞争性抑制了氯吡格雷的活性,从而影响了氯吡格雷抗血小板功能的发挥[7]。而氟伐他汀代谢途径为CYP2C9,则对氯吡格雷的药物代谢无明显影响。治疗不稳定型心绞痛、急性心肌梗死、冠状动脉支架术后等病人使用氯吡格雷加阿司匹林及他汀药物经典处方是否需考虑避免应用经CYP3A4通道代谢的他汀药物呢?有临床研究证实,经CYP3A4通道代谢的他汀药物并未发现其干扰到氯吡格雷的抗血小板作用[8]。众多药物基因学研究发现其机制可能与肝脏中存在足够丰富的CYP3A4表达,不足以造成他汀与氯吡格雷间的竞争抑制现象。此外,对氯吡格雷的药物代谢研究发现,氯吡格雷的代谢激活可能为多种CYP450同工酶参与其中,并不是单一由CYP3A4来完成。
除去病人的依从性,多项研究显示氯吡格雷抵抗现象中遗传因素起到主导作用,CYP酶活性存在较大个体差异,酶的基因多态性致使机体对氯吡格雷的反应不一。研究表明,血小板P2Y12受体基因多态性导致不同病人产生不同的抗血小板效应[9]。其他方面诸如剂量因素也参与了氯吡格雷抵抗现象,有临床研究证实增加氯吡格雷的负荷剂量与维持药量可以增强其抗血小板作用,从而降低氯吡格雷抵抗的发生率,减少氯吡格雷抵抗所致的缺血事件[10],高维持剂量的氯吡格雷可以对残留ADP诱导的血小板功能起到抑制作用。
抗血小板治疗中出现的氯吡格雷抵抗或血小板低反应性受到广大临床工作者的重视,血小板反应多样性问题存在诸多争议,氯吡格雷抵抗可能发生机制包括基因遗传学、药物相互作用、糖尿病、胰岛素抵抗、高血小板活性等。目前很多医院甚至常规开展了基因多态性的测定和血小板聚集功能(血栓弹力图)的检测。作为应对氯吡格雷抵抗的策略,增加氯吡格雷负荷剂量及维持剂量口服,新型抗血小板药物如新型P2Y12受体阻滞剂替格瑞洛、普拉格雷一部分替代了氯吡格雷开始在临床广泛使用。本研究对氯吡格雷抵抗与他汀药物相互作用相关性研究表明,不同他汀药物血小板聚集率差异无明显统计学意义,氯吡格雷抵抗现象可能与他汀药物相互作用无关。本研究样本量较小,可能存在偏倚情况,尚需大样本临床试验数据证实两者之间关系。



