伊加提·司马义,帕合热丁·努尔麦麦提,阿布都乃比·麦麦提艾力
冠心病是冠状动脉功能性或器质性病变导致的一类心脏病,病人冠状动脉供血和心肌需求平衡紊乱,心肌合并不同程度缺血、缺氧表现[1]。有研究指出,血脂代谢异常和血管内皮功能损伤是影响冠心病发生的主要因素,同时也是影响冠心病病人预后及不良心血管事件的主要因素[2-3]。因此,改善血脂水平、缓解血管内皮损伤是目前治疗冠心病的关键所在。线粒体ATP敏感性钾离子通道(mito-KATP)开放剂是一种用于缓解心肌缺血再灌注损伤的心肌保护药物,可通过作用于心肌及血管平滑肌上的mito-KATP,调节钾离子内流情况,促进线粒体氧化磷酸化及ATP 的产生[4]。二氮嗪作为mito-KATP 开放剂,已经被证明具有对抗心肌损伤的作用,但其在冠心病中对血管内皮损伤的作用及机制尚不明确[5]。本研究通过构建冠心病模型大鼠,于实验动物体内探究二氮嗪对冠心病大鼠血管内皮损伤的作用,并进一步明确其机制,为临床治疗提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 无特定病原体(SPF)级健康SD 大鼠30 只,雌雄各半,由广东省医学实验动物中心提供。体质量(220±20)g,分笼饲养,每笼1 只,室温20~22 ℃,相对湿度60%~65%,期间自由饮水,定时摄食,日光照12 h。所有动物实验均经伦理委员会批准。
1.1.2 试剂及药品 垂体后叶注射液[安徽宏业药业有限公司生产,国药准字H34022977;规格:1 mL(6 U),10支];二氮嗪(上海博顿生物化工有限公司生产,批号:100203-201301,纯度:99.95%);大鼠肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-6 酶联免疫吸附试验(ELISA)试剂盒(美国RD 公司生产);实时荧光定量逆转录试剂盒、实时荧光定量聚合酶链式反应(PCR)试剂盒(日本TaKaRa 公司生产);兔抗鼠3-磷酸甘油醛脱氢酶(GAPDH)单克隆抗体、兔抗鼠成纤维细胞生长因子2(FGF-2)单克隆抗体、兔抗鼠血管内皮生长因子(VEGF)单克隆抗体(美国Abcam 公司生产);二喹啉甲酸(BCA)蛋白定量试剂盒(美国Invitrogen 公司生产);血管紧张素Ⅱ(AngⅡ)试剂盒(南京建成生物工程研究所生产);蛋白上样缓冲液(上海碧云天生物技术有限公司生产)。
1.1.3 主要仪器 UV-9100 紫外分光光度计(美国Mettler Toledo 公司生产);Mini Protean 3 cell 电泳仪、Universal Hood Ⅱ凝胶成像系统(美国Bio-Rad 公司生产);Pureloab Classic UVF 超纯水仪(法国ELGA Labwater 生产);HITACH17080 全自动生化分析仪(上海曼普生物科技有限公司生产)。
1.2 实验方法
1.2.1 动物分组 30 只SD 大鼠随机分为对照组、模型组和二氮嗪组,每组10 只。模型组和二氮嗪组大鼠给予高脂饲料喂养6 周,饲料配方为1.0%胆固醇、5.0%蛋黄粉、10.0%猪油、0.5%胆酸钠、83.5%基础饲料。造模完成后,二氮嗪组大鼠给予3 mg/kg 二氮嗪灌胃治疗,每日1 次,连续给药4 d。对照组及模型组大鼠给予等体积生理盐水,每日1 次,连续给药4 d。
1.2.2 血清炎性因子水平检测 用50 mg/kg 苯妥英钠腹腔注射麻醉大鼠,取腹主动脉全血5 mL,室温静置4 h,4 ℃、3 000 r/min 离心15 min(离心半径10 cm),分离上层血清,采用ELISA 试剂盒检测上清液中TNF-α、IL-1β、IL-6 含量,向加入一抗的96 孔板中加入40 μL待测样品及10μL 生物素标记抗体,随后加入100 μL辣根过氧化物酶标记抗体,室温孵育60 min,清洗孔板后加入显色剂。使用酶标仪在450 nm 下测定OD 值。所有试验重复3 次。
1.2.3 血脂指标水平检测 取腹主动脉全血5 mL,室温静置4 h,4 ℃、3 000 r/min 离心15 min(离心半径10 cm),分离上层血清,采用全自动生化分析仪检测总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)等血脂指标水平。
1.2.4 血管内皮损伤指标水平检测 AngⅡ水平检测采用ELISA 法,参照试剂盒要求严格进行操作,检测血清AngⅡ水平。采用高效液相色谱分析检测非对称性二甲基精氨酸(ADMA)水平,取腹主动脉全血5 mL,加入乙二胺四乙酸(Na2EDTA)抗凝,4 ℃、3 000 r/min离心15 min(离心半径10 cm),收集血浆,分析血浆中ADMA 含量。
1.2.5 心功能检测 用50 mg/kg 苯妥英钠腹腔注射麻醉大鼠,麻醉生效后,由心房瓣插入球囊,链接压力换能器,采集血流动力学信号,记录左室收缩压(LVSP)、左心室压力变化最大上升速率(+dp/dtmax)、左心室压力最大下降速率(-dp/dtmax)。同时分离大鼠冠状动脉左旋支根部,放置微型电磁流量探头,采集血流动力学信号,记录冠状动脉血流量(CF)。
1.2.6 心肌细胞形态检测 处死大鼠后,取适量左心室组织均匀切成4 μm 厚片,4% 多聚甲醛中固定过夜。常规乙醇梯度脱水,石蜡包埋。随后将切片置于二甲苯及梯度乙醇中依次浸泡脱蜡,采用苏木素-伊红(HE)染色。梯度乙醇脱水,二甲苯透明,中性树脂覆盖玻片封固。于光学显微镜下观察并采集图片,观察心肌组织形态。
1.2.7 心肌组织血管生成因子mRNA 表达检测 用50 mg/kg 苯妥英钠腹腔注射麻醉大鼠,颈椎脱臼法处死大鼠,取每只大鼠心肌组织约50 mg,采用Trizol 法提取心肌组织细胞总RNA。采用紫外分光光度仪测定总RNA 浓度与纯度,A260/280 在1.8~2.0。参照mRNA 反转录试剂盒及SYBR®Premix Ex TaqTM试剂盒操作说明进行反转录和多重逆转录聚合酶链反应(RT-PCR)检测,反应程序:95 ℃2 min,95 ℃15 s,60 ℃30 s,68 ℃ 60 s,40 个循环,最后95 ℃15 s,60 ℃1 min,95 ℃1 5 s 收集荧光信号,计算相对定量结果。所有的试验均重复 3 次,相对定量分析按照2-△△Ct(实验组)-△△CT(对照组)求出FGF-2 及VEGF mRNA 表达水平。FGF-2、VEGF 引物及内参GAPDH 引物均由上海捷瑞生物工程有限公司设计合成,基因FGF-2正向引物5'-TTAACACTTCTTACGCAATGCT-3',反向引物5'-GCCCAGTA ACAGTACAGAACGA-3';基因VEGF正向引物5'-ATGAACTTTCTGCTCTCTTGGGTACA-3',反向引物5'-GCAGATGGACAAGCCAAGGCGGTG-3';基因GAPDH 正向引物5'-GATGCTGGTGCTGAGTATGRCG-3',反向引物5'-GTGGTGCAGGATGCATTGCTCTGA-3'。
1.2.8 心肌组织血管生成因子蛋白表达检测 取每只大鼠心肌组织约50 mg,加入蛋白提取液,冰上充分碾磨,4 ℃、10 000 r/min 离心10 min(离心半径10 cm),取上清液。采用BCA 蛋白定量试剂盒进行蛋白定量,以30~60μg 蛋白上样量,煮沸变性。取蛋白样品进行聚丙烯酰胺凝胶电泳和转膜,90 V 恒压模式电泳,220 mA 电转90 min。5%脱脂奶粉封闭1 h 后,使用抗FGF-2 抗体(1∶1 000)、抗VEGF 抗体(1∶1 000)、抗GAPDH 抗体(1∶5 000)4 ℃孵育过夜。PBS-Tween20液漂洗,辣根过氧化物酶(HRP)标记的二抗反应,再次用PBS-Tween20 液洗膜,增强化学发光(ECL)显色,凝胶成像仪中曝光并拍照,检测大鼠心肌组织中FGF-2及VEGF 等血管生成因子蛋白表达。灰度值用Image Pro Plus 6.0 软件来测定。每组实验重复3 次。
1.3 统计学处理 采用SPSS 20.0 统计软件进行数据分析。采用Shapro-Wilk 检验数据是否符合正态分布,采用Bartlett 检验进行方差齐性检验。符合正态分布的定量资料以均数±标准差(±s)表示,多组数据间比较采用单因素方差(one-way ANOVA)分析,两组数据间均数比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 3 组大鼠血清炎性因子水平比较 血清ELISA实验检测结果显示,与对照组比较,模型组及二氮嗪组血清TNF-α、IL-1β、IL-6 水平明显升高(P<0.05);与模型组比较,二氮嗪组血清TNF-α、IL-1β、IL-6 水平则明显降低(P<0.05)。详见表1。
表1 3 组大鼠血清炎性因子水平比较(±s) 单位:ng/L

表1 3 组大鼠血清炎性因子水平比较(±s) 单位:ng/L
与对照组比较,①P <0.05;与模型组比较,②P <0.05。
组别 只数 TNF-α IL-1β IL-6对照组 10 7.43±1.09 3.68±0.21 1.02±0.43模型组 10 23.43±3.48① 9.14±0.31① 25.34±2.43①二氮嗪组 10 13.54±3.41①② 6.17±0.37①② 16.43±2.83①②
2.2 3 组大鼠血脂水平比较 模型组及二氮嗪组血清TC、TG、LDL-C 水平均明显高于对照组(P<0.05),HDL-C 水平则明显低于对照组(P<0.05);二氮嗪组血清TC、TG、LDL-C 水平明显低于模型组(P<0.05),HDL-C 水平明显高于模型组(P<0.05)。详见表2。
表2 3 组大鼠血脂水平比较(±s)单位:mmol/L

表2 3 组大鼠血脂水平比较(±s)单位:mmol/L
与对照组比较,①P <0.05;与模型组比较,②P <0.05。
组别 只数 TC TG LDL-C HDL-C对照组 10 1.34±0.73 0.67±0.12 0.16±0.05 0.62±0.11模型组 10 4.76±0.67① 4.02±0.77① 2.87±0.45① 0.41±0.14①二氮嗪组 10 3.04±0.56①② 2.12±0.64①② 1.14±0.36①② 0.55±0.12①②
2.3 3 组大鼠血管内皮损伤标志物水平比较 与对照组比较,模型组及二氮嗪组血清AngⅡ和ADMA 水平明显升高(P<0.05);二氮嗪组血清AngⅡ和ADMA水平明显低于模型组(P<0.05)。详见表3。
表3 3 组大鼠血管内皮损伤标志物水平比较(±s)

表3 3 组大鼠血管内皮损伤标志物水平比较(±s)
与对照组比较,①P <0.05;与模型组比较,②P <0.05。
组别 只数 AngⅡ(pg/mL) ADMA(μmol/L)对照组 10 537.31±22.21 0.45±0.05模型组 10 692.31±25.46① 0.83±0.06①二氮嗪组 10 577.33±15.64①② 0.56±0.04①②
2.4 3 组大鼠心功能指标水平比较 模型组及二氮嗪组大鼠LVSP、+dp/dtmax、-dp/dtmax及CF 明显低于对照组(P<0.05);与模型组比较,二氮嗪组+dp/dtmax、LVSP、-dp/dtmax及CF明显升高(P<0.05)。详见表4。
表4 3 组大鼠心功能指标水平比较(±s)

表4 3 组大鼠心功能指标水平比较(±s)
注:1 mmHg=0.133 kPa;与对照组比较,①P <0.05;与模型组比较,②P <0.05。
组别 只数 LVSP(mmHg) +dp/dtmax(kPa/s) -dp/dtmax(kPa/s) CF(mL/min)对照组 10 104.54±10.32 2 815.42±110.34 2 332.41±122.42 102.42±5.43模型组 10 67.42±5.44① 1 432.42±87.32① 1 223.42±77.42① 70.42±5.45①二氮嗪组 10 96.34±4.38①② 2 493.42±96.42①② 1 943.43±65.54①② 87.43±5.37①②
2.5 3 组大鼠心肌细胞形态变化 HE 结果显示,对照组大鼠心肌细胞形态正常,细胞排列整齐、紧密,无明显炎性水肿表现;模型组大鼠心肌细胞排列紊乱,细胞间水肿明显,炎性浸润表现,核仁萎缩,成簇状改变;二氮嗪组大鼠心肌细胞排列相对整齐,细胞间质水肿缓解,核仁清晰可见。详见图1。
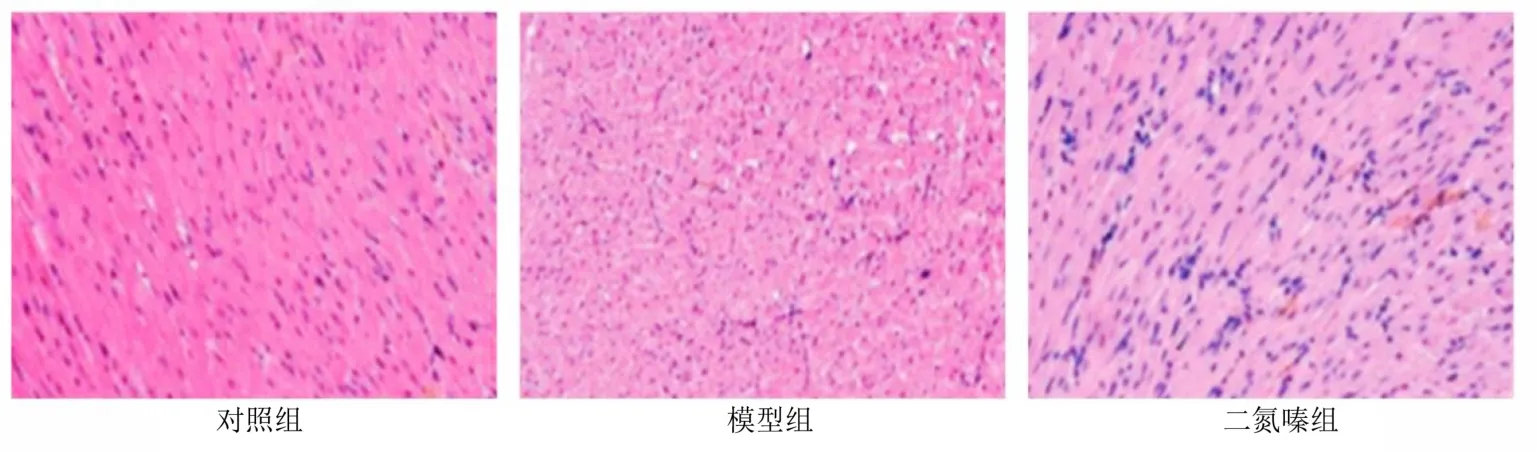
图1 3 组大鼠心肌细胞形态变化(HE,×100)
2.6 3 组大鼠心肌组织血管生成因子表达量比较RT-PCR 实验及Western Blot 实验结果显示,模型组与二氮嗪组大鼠心肌组织中FGF-2、VEGF 的mRNA及蛋白表达水平明显低于对照组(P<0.05),其中,模型组大鼠心肌组织中FGF-2、VEGF 的mRNA 及蛋白表达水平明显低于二氮嗪组(P<0.05)。详见图2。
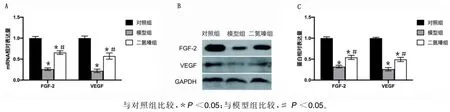
图2 3 组大鼠心肌组织血管生成因子表达量比较
3 讨 论
冠心病为冠状动脉血管发生动脉粥样硬化病变,引起血管腔狭窄或阻塞,从而造成心肌缺血、缺氧的心血管疾病,近年来发病率呈逐年上升趋势,且趋于年轻化[6]。冠心病不仅可直接引起心肌缺血、缺氧,还可导致部分心肌细胞凋亡,严重威胁病人生命安全。mito-KATP是一种广泛存在于机体各类血管及平滑肌的离子通道,主要受细胞内ATP 浓度调控,1991 年被首次发现表达于大鼠肝细胞线粒体内膜[7-8]。研究指出,mito-KATP 开放剂可用于保护缺血后心肌组织,主要通过激活心肌细胞线粒体ATP,使线粒体膜电位发生去极化[9]。有研究建立老年冠心病大鼠心肌缺血再灌注模型,从线粒体膜稳定作用出发,发现mito-KATP 开放剂尼可地尔是通过降低大鼠血清中肌酸激酶同工酶(CK-MB)和乳酸脱氢酶(LDH)的含量,提高心肌细胞线粒体膜电位,抑制心肌细胞凋亡,发挥心肌细胞保护作用[10]。目前关于mito-KATP 及mito-KATP 开放剂的心肌保护作用研究主要围绕调控氧化应激、减少线粒体钙离子超载、降低心肌细胞凋亡和平衡线粒体膜电位展开,但关于mito-KATP 开放剂对冠心病病人血脂代谢及血管内皮损伤影响的研究则鲜有报道。
研究指出,血脂代谢异常是诱发冠心病的重要危险因素之一,血脂指标长期异常,可影响血管内皮细胞结构和功能,破坏血管内皮完整性,并介导血小板长期聚集发生钙化,最终导致动脉狭窄甚至闭塞,进而影响冠心病的发生[11-12]。有关文献指出,高三酰甘油血脂是影响冠心病的独立危险因素,TC、TG、LDL-C、HDL-C 水平异常与不良心血管事件的发生密切相关[13]。本研究以高脂饮食饲养联合腹腔注射脑垂体后叶素构建大鼠冠心病模型,探究mito-KATP 开放剂二氮嗪对实验动物血管内皮损伤的影响及作用机制,研究结果显示,模型组血清TC、TG、LDL-C 水平高于对照组,HDL-C水平则较对照组降低,二氮嗪组血清TC、TG、LDL-C则低于模型组,HDL-C 水平则较高,说明mito-KATP开放剂二氮嗪可降低冠心病大鼠血脂指标水平,提示二氮嗪具有一定的降血脂作用。
炎性反应贯穿冠心病发生发展的全过程,有研究发现,冠心病病人血清TNF-α、IL-1β、IL-6 等促炎因子水平较高[14]。炎性因子高表达不仅影响动脉斑块和血栓形成速度,还可增加血管通透性,因此,炎性细胞因子也被作为冠心病的治疗靶点[15]。本研究观察到,模型组血清TNF-α、IL-1β、IL-6 水平均明显高于对照组,使用二氮嗪干预的冠心病大鼠血清炎性因子水平则明显降低,且HE 染色观察结果显示,二氮嗪组大鼠心肌细胞炎性浸润状态明显缓解,细胞间质水肿减轻,提示二氮嗪可缓解冠心病大鼠心肌炎症状。
二氮嗪又名氯甲苯噻,其心肌缺血保护作用主要与清除氧自由基、降低心肌耗氧、抑制心肌细胞凋亡和抑制钙离子超载有关[16-17]。本研究发现,模型组LVSP、+dp/dtmax、-dp/dtmax、CF 等心功能指标水平明显低于对照组,而二氮嗪组各项心功能指标水平较模型组改善,提示二氮嗪对冠心病大鼠心功能具有明显保护作用。作为一种血管活性肽,AngⅡ可参与介导内皮损伤,在众多心血管事件的发生发展中起重要作用[18]。动物实验证明,高脂饮食诱发内皮损伤大鼠等心血管疾病动物血清内源性ADMA 浓度显着升高,并伴有不同程度血管内皮舒张功能障碍,表明血清AngⅡ和内源性ADMA 含量升高是心血管内皮损伤的原因之一[19]。本实验探究血清AngⅡ、ADMA 表达发现,模型组血清AngⅡ、ADMA 表达明显升高,而二氮嗪组血清Ang Ⅱ、ADMA 表达则较模型组下调,提示二氮嗪可改善冠心病大鼠血管内皮功能障碍。
血管生长因子FGF-2 和VEGF 是血管形成过程中的重要因子。FGF-2 主要通过激活蛋白酶原活化因子和血管内皮细胞分泌蛋白酶,分解血管基底膜,促进细胞向细胞基质迁移,诱导新血管管腔形成[20-21]。VEGF 是一种高度特异性的促血管生长因子,主要与血管内皮细胞的特异性增殖、分化有关,在促进新生血管生成、改善血管壁通透性、促进受损血管内皮修复中扮演着重要角色,是血管内皮功能和侧支循环建立的重要保障[22-23]。本研究结果显示,冠心病模型大鼠心肌组织中FGF-2 和VEGF mRNA、蛋白表达均下调,给予二氮嗪干预后冠心病大鼠心肌组织中FGF-2 和VEGF mRNA、蛋白表达量上调,提示二氮嗪可升高冠心病大鼠心肌组织FGF-2 和VEGF 含量,从而减轻血管内皮损伤。
综上所述,mito-KATP 开放剂二氮嗪能降低冠心病大鼠血清炎性因子表达和血脂代谢,改善大鼠心功能,减轻冠心病大鼠血管内皮损伤,从而发挥心肌保护作用。



