刘 寒,王 龙,周 霞,江婵娟,孙中武
(安徽医科大学第一附属医院神经内科,安徽 合肥 230022)
◇临床医学◇
代谢综合征对皮质下缺血性血管病认知功能的影响
刘 寒,王 龙,周 霞,江婵娟,孙中武
(安徽医科大学第一附属医院神经内科,安徽 合肥 230022)
目的 探讨代谢综合征(Mets)对皮质下缺血性血管病(SIVD)认知功能的影响。方法 选择226例 SIVD患者,其中Mets患者104例,代谢综合征倾向(R-Mets)68例,非代谢综合征(No-Mets)54例。Mets的诊断标准采用 NCEP-ATPⅢ标准;应用简易智能精神状态量表(MMSE)、剑桥老年认知量表中文版(CAMCOG-C)对 SIVD患者的认知功能进行评定;采用 Blennow量表,按照脑损害程度分为 4个亚型(Ⅰ~Ⅳ型,0~3分)。结果 Mets组和 R-Mets组 MMSE、CAMCOG-C均显着低于No-Mets组(均P<0.05);Mets组 CAMCOG-C显着低于 R-Mets(P<0.05)。腰围、空腹血糖(IGT)、收缩压(SBP)、舒张压(DBP)、甘油三酯(TG)与SIVD患者总体认知得分呈显着负相关(均P<0.05);HDL-C与MMSE、CAMCOG-C得分呈显着正相关(均 P<0.05)。No-Mets组中Ⅰ、Ⅱ型所占比例较高,分别为 51.6%、27.8%,R-Mets组和 Mets合并组中Ⅲ、Ⅳ型所占比例较高,分别为36%、30.8%,No-Mets组与R-Mets组和Mets合并组Ⅰ、Ⅱ、Ⅲ、Ⅳ各亚型发生率比较均有统计学意义(均P<0.05)。结论 Mets及其各因子加重SIVD认知损害,其中腹型肥胖、IGT、SBP、DBP、TG、HDL-C是其重要危险因素;随着 RMets、Mets发生率增高,SIVD脑损害愈加明显。
代谢综合征;皮质下缺血性血管病;认知功能;脑白质病变;腔隙性脑梗死
皮质下缺血性血管病(subcortical ischemic vascular disease,SIVD)是脑小血管疾病,影像学上主要以腔隙性脑梗死和白质病变为主要的脑损害类型,临床上起病隐匿,以认知功能损害和皮质下特征为主要表现的一种疾病[1]。代谢综合征(metabolic syndrome,Mets)是多种代谢危险因素在同一个体内集结状态,主要包括:腹型肥胖、胰岛素抵抗、高血压、血脂异常等。目前有关 Mets中的各单独因子,如血糖、血压等对痴呆等疾病的认知功能影响有相关研究报道,本文将进一步研究和探讨Mets以及各因子对SIVD患者认知功能的影响。
1 资料与方法
1.1 临床资料 2012年 2月—2013年 10月安徽医科大学第一附属医院神经内科门诊和住院 226例 SIVD患者,依据相关文献等[1]提出的诊断标准,通过临床症状和影像学表现为白质病变和多发性腔隙性脑梗死加以确定。排除诊断和未入组标准:(1)阿尔茨海默病(AD);(2)颅内占位性病变;(3)语言障碍和精神疾病影响到认知功能检查;(4)最近或当前使用胆碱酯酶抑制剂、安定类等药物。本研究经安徽医科大学伦理委员会批准,所有研究对象均知情并签署同意书。
1.2 方法
1.2.1 Mets诊断标准和分组 采用 NCEP-ATPⅢ标准,Park等[2]认为 Mets存在≥3个因子:(1)空腹血糖(IGT)≥110 mg·dL-1或正在用胰岛素或口服降糖药物;(2)收缩压(SBP)≥130 mmHg或舒张压(DBP)≥85 mmHg,或近期使用降血压药物;(3)甘油三酯(TG)≥150 mg·dL-1;(4)高密度脂蛋白(HDL),男性,≤40 mg·dL-1女性,≤50 mg· dL-1,或近期使用降脂药物;(5)腰围的 NCEP-ATPⅢ标准为男性≥102 cm,女性≥88 cm,而根据中国人的情况,我们将腰围标准进行修订为[3]:男性≥85 cm,女性≥80 cm。代谢综合征倾向(R-Mets)是指符合以上5个因子中的2个因子的研究对
1.2.2 Mets各因子的采集 所有研究对象均空腹采集血液样本进行检测,并做相关体格检查,测量血压和腰围并记录。
1.2.3 认知功能测试 采用简易智能精神状态量表(MMSE)、剑桥老年认知量表中文版(CAMCOGC)作为评定认知功能的工具。CAMCOG-C包含定向、语言、记忆、注意、执行、计算、思维、知觉等8个认知测试亚项。
1.2.4 脑损害程度评定 应用 Blennow量表[4](0 ~3分),按照MRI脑白质病变的范围评分将SIVD分为以下4种亚型:Ⅰ型为无白质低密度,仅存在多发性腔隙性脑梗死;Ⅱ型为侧脑室的额角和枕角边缘有白质低密度;Ⅲ型为侧脑室额角和枕角的周围有白质低密度且在半卵圆中心融合;Ⅳ型为整个侧脑室周围均有白质低密度并且在半卵圆中心融合。
1.3 统计学方法 数据采用SPSS16.0软件进行分析。计量数据以±s表示。计数数据采用χ2检验;多组间均数比较用方差分析,其中各组间的两两比较采用L-S-D法;Mets各因子与认知功能之间的相关分析采用Pearson分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 如表1所示,三组研究对象中,No-Mets组、R-Mets组、Mets组分别占 SIVD的23.9%、30.1%、46.0%,三组研究对象的性别构成、年龄、受教育时间差异无统计学意义。
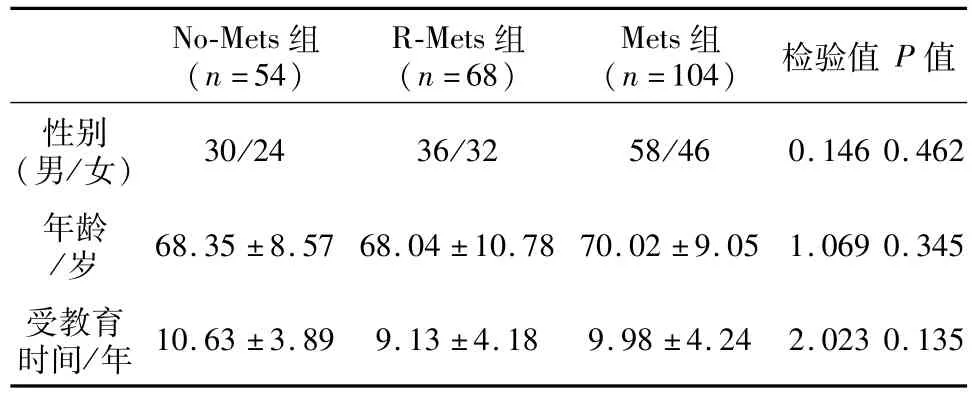
表1 三组研究对象的性别构成、年龄、受教育时间比较
2.2 SIVD中三组间认知功能比较 如表2所示,Mets组和R-Mets组MMSE、CAMCOG-C均显着低于No-Mets组(均P<0.05);Mets组CAMCOG-C显着低于R-Mets组(P<0.05)。在 CAMCOG-C子项中,Mets组和 R-Mets组定向、记忆、注意、计算、知觉均显着低于No-Mets组(均 P<0.05);Mets组定向、注意、执行、思维、知觉均显着低于 R-Mets(均 P <0.05)。由此可见,随着Mets因子从无到有地逐渐增多,SIVD的认知损害逐渐加重。
2.3 Mets各因子与总体认知功能之间的相关分析
如表3所示,腰围、IGT、DBP与MMSE、CAMCOG-C得分呈显着负相关(均 P<0.05);SBP、TG与 CAMCOG-C得分呈显着负相关(P<0.05);HDL-C与MMSE、CAMCOG-C得分呈显着正相关(P<0.05)。
2.4 SIVD四种亚型 Mets发生率的比较 如表 4所示,我们比较SIVD四种亚型Mets发生率,结果显示:No-Mets组Ⅰ、Ⅱ型中所占比例较高,分别为51.6%、27.8%,R-Mets和Mets合并组中Ⅲ、Ⅳ型所占比例较高,分别为36%、30.8%,Ⅰ、Ⅱ、Ⅲ、Ⅳ各亚型的 No-Mets和 R-Mets和 Mets合并组发生率比较均有统计学意义(均P<0.05)。
3 讨论
随着人民生活水平的提高,Mets在老年人群中的发病率正逐年升高。有研究认为Mets及其各因子可能是年龄相关认知下降、轻度认知损害(MCI)、血管性痴呆和 AD(阿尔茨海默病)发生的重要危险因素,并提出“代谢—认知综合征(MCS)”概念[5]。MCS是指Mets患者合并血管因素或神经变性导致的认知功能损害,可以用来解释代谢紊乱和认知缺损之间的复杂联系,更好地帮助我们了解Mets患者中痴呆 前期或痴呆综合征的神经心理学和神经病理学特点。
表2 三组间认知功能比较(±s)

表2 三组间认知功能比较(±s)
注:与NO-Mets组比较,aP<0.05;与R-Mets组比较,bP<0.05。
认知功能 No-Mets组(n=54) R-Mets组(n=68) Mets组(n=104) 检验值 P值MMSE 25.59±4.47 23.16±5.33a23.60±3.45a22.643 0.000 5.341 0.005 CAMCOG-G 80.94±14.20 74.21±17.24a72.03±12.36ab38.344 0.000定向 9.20±0.83 8.29±1.64a8.19±1.82ab7.816 0.001语言 24.24±3.88 22.85±4.23 24.27±3.78 2.986 0.053记忆 21.17±3.46 18.03±4.31a18.93±4.18a9.302 0.000注意 5.91±1.66 4.81±2.08a4.63±1.52ab10.188 0.000执行 9.04±2.19 8.60±2.21 8.06±1.69ab4.608 0.011计算 1.91±0.40 1.71±0.55a1.63±0.51a5.767 0.004思维 5.11±2.07 4.72±1.97 4.21±1.52ab4.725 0.010知觉 7.11±1.51 6.13±1.47a5.44±1.48ab
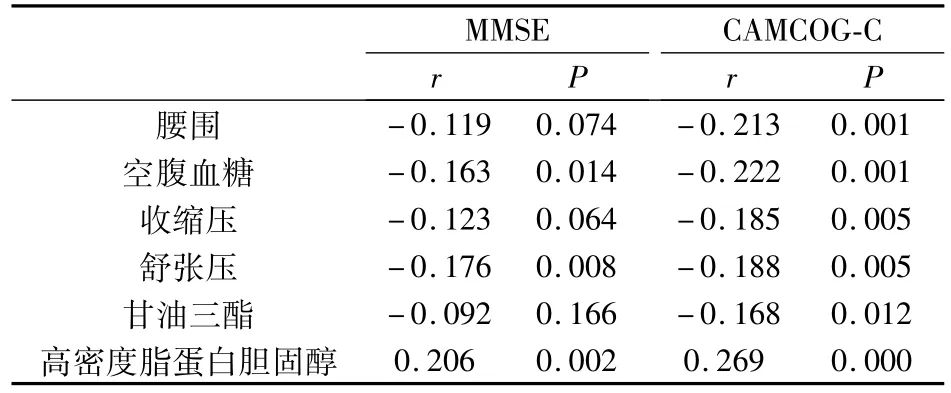
表3 Mets各因子与认知损害之间的相关分析(r值)

表 4 四种亚型 Mets发生率比较 [n(%)]
我们的研究结果发现:随着Mets因子逐渐增多,SIVD的认知损害逐渐加重,且腰围、IGT、SBP、DBP、TG、HDL-C各因子亦与总体认知功能损害显着相关。SIVD患者中,No-Mets在Ⅰ、Ⅱ型中占比例较高,分别为51.6%、27.8%,R-Mets和 Mets合并组 Ⅲ、Ⅳ型所占比例较高,分别为 36.0%、30.8%,Ⅰ、Ⅱ、Ⅲ、Ⅳ各亚型的No-Mets和R-Mets+ Mets合并组发生率比较均有显着差别。由此可见,随着R-Mets、Mets发生率增高,SIVD脑损害愈加明显。
Feng等[6]研究 Mets和遗忘型轻度认知损害(aMCI)之间的联系,结果发现 Mets与 aMCI相关,尤其是中老年携带 APOE ε4等位基因患者。Solfrizzi等[7]调查 Mets及其成分对MCI发生率及其进展为痴呆影响,结果表明经过3年半随访,Mets能够独立预测MCI进展为痴呆的风险。以上研究提示 Mets及其各因子可加重中老年认知损害,甚至影响到 MCI向痴呆的转化,且遗传易感性可能也参与其中。我们的结果也证实,随着Mets因子逐渐增多,血管性认知损害(VCI)如SIVD的认知损害亦逐渐加重。
Katz等[8]对身体活动、肥胖对认知功能的影响进行调查,结果表明肥胖和静止不动均显着、独立地与认知功能损害相关。Chu等[9]在中国人群中,对aMCI和AD患者的体重指数(BMI)和腰围进行研究,发现 BMI和腰围增加可降低老年人正常的认知功能,BMI和腰围可以作为aMCI和AD的预测指标。我们的结果同样发现 SIVD患者腰围与总体认知功能损害显着相关,因此应建议中老年人加强锻炼、减肥,此对降低老年人群痴呆发生率具有重要意义。而肥胖所致认知损害的可能机制如下:淀粉样蛋白前体(APP)是一种促炎脂肪因子,可能与肥胖、胰岛素抵抗、炎症和认知损害等相关联。瘦素是调节能量平衡、神经内分泌功能的一个重要的脂肪因子,它在学习和认知功能中有重要作用,人类大脑中瘦素受体和信使核糖核酸(mRNA)广泛表达,包括海马和新皮质,在细胞水平来看,瘦素被认为能够增强N-甲基-D-天冬氨酸的作用。Farr等[10]研究肥胖、高 TG血症和认知损害之间关系,发现肥胖与认知损害有关,高 TG血症是 Mets中的主要因子,在瘦素抵抗中有部分作用,TG在肥胖患者中对认知的损害可能是因为长期增加海马中的N-甲基-D-天冬氨酸成分所致,低水平的 TG可以逆转认知损害并改善大脑的氧化应激。腹型肥胖可使激素的合成增多,这在认知损害中起了关键的作用,特别是当过多的糖皮质激素作用于海马神经元时,可导致神经元的损害,最终造成认知功能下降。
我们的结果表明 IGT与SIVD总体认知功能损害显着相关。Mortby等[11]认为血糖升高是认知功能损害和痴呆的危险因素。Desideri等[12]研究黄烷醇的消耗和认知损害关系后发现,MCI患者经常服用可可黄烷醇可能显着改善认知功能,其部分原因可能是由于提高胰岛素敏感性。Yan-Ling等[13]在中国人群中对空腹血浆胰岛素(FSI)和IGT与认知损害的关系进行研究,结果发现老年人认知功能与FSI相关,并且高水平 FSI可能提高认知功能。有研究认为,胰岛素信号可能在AD的病理生理机制中有重要作用。事实上,胰岛素水平的高低均会在细胞水平表达信号,这些都可能导致异常信号的级联反应。胰岛素与 Aβ(淀粉样蛋白 β)缩氨酸代谢有关,胰岛素通过增加 Aβ的分泌及抑制其降解来增加细胞外 Aβ的水平,最终扰乱Aβ的生理学进程。Mc Nay等[14]认为胰岛素是海马记忆过程的关键成分,而胰岛素抵抗如2型糖尿病与认知和神经的损害有关。
Okusaga等[15]为了评估老年人心血管危险因子与认知功能间的关系,对2 312例老年人进行认知测试,发现吸烟和高血压可能是认知下降的危险因素。Sierra等[16]对高血压和MCI之间的关系进行研究,结果发现降血压药物控制血压可起到预防认知损害的作用。Israeli-Korn等[17]为了确定血管危险因素是否与MCI和 AD有关,对767例研究对象进行研究,发现高血压、年龄大、低教育程度显着增加 MCI和 AD的患病率。另外,Peters等[18]发现血压范围过宽可能预示痴呆的风险增加。上述文献表明高血压、血压范围过宽均与认知功能损害有关,我们的结果也显示 SBP、DBP与 SIVD总体认知功能损害显着相关,此结果与以上文献相符。在高血压相关的认知损害病理学机制中,最重要的当属高血压对血管损害,长期高血压会导致脑血管血流动力学储备降低,对缺血性损害更加敏感;此外,高血压与血管渗透性增加伴随蛋白渗出有关;与大脑皮质如颞叶和枕叶萎缩相关;高收缩压与低大脑重量也存在一定关系;病理上发现高收缩压和舒张压与海马区域的神经元纤维缠结增多有关,以上机制表明,高血压通过降低血流动力学储备、增加血管渗透性、促使脑萎缩以及神经元纤维缠结增多等途径影响认知功能。
Tukiainen等[19]对老年人胆固醇和 TG的水平及其动态改变进行为期 6年的随访,探索其与 MCI之间的关系,结果发现老年人中血浆胆固醇的减低可能作为认知降低的潜在标志,我们的结果同样认为高 HDL-C水平与总体认知损害呈负相关,TG与总体认知损害呈显着正相关。APOE是脂代谢过程中主要负责脂质和脂蛋白运输的一种多功能蛋白质,APOE基因多态性被认为是脑血管疾病、血管性痴呆以及神经变性疾病中的重要危险因素。Frisardi等[20]认为从基因学角度来说,APOEε4载体可能在MCS发生中发挥重要作用。在细胞水平上,胆固醇和Aβ之间可相互作用,一方面胆固醇可调节 Aβ的产生,而 Aβ也改变胆固醇在大脑内的稳态,
Mets及各因子导致认知损害和痴呆的机制复杂,目前国内外无统一定论。一方面 Mets通过腹型肥胖、IGT、SBP、DBP以及HDL等血管危险因素对血管产生影响,导致脑白质病变和脑腔隙性梗死发生,进一步引起SIVD认知损害,另方面Mets及各因子与AD相关的病理机制如Aβ沉积、神经细胞变性等密切相关,确切机制尚需要基础和临床研究加以深入探寻。
综上所述,Mets及各个因子对SIVD患者认知损害有显着影响,随着 R-Mets、Mets发生率增高,SIVD脑损害愈加明显。腰围、IGT、SBP、DBP、TG、HDL-C等各因子均与 SIVD总体认知功能损害相关,其作用机制复杂并且相互联系,我们建议应通过加强身体锻炼、饮食和药物等多种手段来控制体重、血糖、血压、血脂等,干预Mets的发生,从而降低中老年人发生痴呆的风险。
[1] O'Brien JT,Erkinjuntti T,Reisberg B,et al.Vascular cognitive impairment[J].Lancet Neurol,2003,2(2):89-98.
[2] Park K,Yasuda N,Toyonaga S,et al.Significant association between leukoaraiosis and metabolic syndrome in healthy subjects [J].Neurology,2007,69(10):974-978.
[3] 徐林发,祝华君,叶林军,等.三种代谢综合征诊断标准的应用情况比较[J].浙江医学,2011,33(1):40-43,47.
[4] 冯 涛,王拥军.脑白质疏松的影像学评测量表[J].中国卒中杂志,2009,4(3):226-230.
[5] Frisardi V,Solfrizzi V,Seripa D,et al.Metabolic-cognitive syndrome:a cross-talk between metabolic syndrome and Alzheimer’s disease[J].Ageing Res Rev,2010,9(4):399-417.
[6] Feng L,Chong MS,Lim WS,et al.Metabolic syndrome and amnestic mild cognitive impairment:singapore longitudinal ageing study-2 findings[J].J Alzheimers Dis,2013,34(3):649-657.
[7] Solfrizzi V,Scafato E,Capurso C,et al.Metabolic syndrome,mild cognitive impairment,and progression to dementia.The Italian Longitudinal Study on Aging[J].Neurobiol Aging,2011,32(11):1932-1941.
[8] Katz P,Julian L,Tonner MC,et al.Physical activity,obesity,and cognitive impairment among women with systemic lupus erythematosus[J].Arthritis Care Res(Hoboken),2012,64(4):502-510.
[9] Chu LW,Tam S,Lee PW,et al.Late-life body mass index and waist circumference in amnestic mild cognitive impairment and Alzheimer 's disease[J].J Alzheimers Dis,2009,17(1):223-232.
[10]Farr SA,Yamada KA,Butterfield DA,et al.Obesity and hypertriglyceridemia produce cognitive impairment[J].Endocrinology,2008,149(5):2628-2636.
[11]Mortby ME,Janke AL,Anstey KJ,et al.High“normal”blood glucose is associated with decreased brain volume and cognitive performance in the 60s:the PATH through life study[J].PLoS One,2013,8(9):e73697.
[12]Desideri G,Kwik-Uribe C,Grassi D,et al.Benefits in cognitive function,blood pressure,and insulin resistance through cocoa flavanol consumption in elderly subjects with mild cognitive impairment:the Cocoa,Cognition,and Aging(CoCoA)study[J].Hypertension,2012,60(3):794-801.
[13]Yan-Ling Z,Chang-Quan H,Li Y,et al.Association of fasting serum insulin and fasting serum glucose levels with cognitive impairment in Chinese nonagenarians/centenarians[J].Age(Dordr),2014,36(1):427-434.
[14]Mc Nay EC,Recknagel AK.Brain insulin signaling:a key component of cognitive processes and a potential basis for cognitive impairment in type 2 diabetes[J].Neurobiol Learn Mem,2011,96 (3):432-442.
[15]Okusaga O,Stewart MC,Butcher I,et al.Smoking,hypercholesterolaemia and hypertension as risk factors for cognitive impairment in older adults[J].Age Ageing,2013,42(3):306-311.
[16]Sierra C,Doménech M,Camafort M,et al.Hypertension and mild cognitive impairment[J].Curr Hypertens Rep,2012,14(6):548-555.
[17]Israeli-Korn SD,Masarwa M,Schechtman E,et al.Hypertension increases the probability of Alzheimer's disease and of mild cognitive impairment in an Arab community in northern Israel[J].Neuroepidemiology,2010,34(2):99-105.
[18]Peters R,Beckett N,Fagard R,et al.Increased pulse pressure linked to dementia:further results from the Hypertension in the Very Elderly Trial-HYVET[J].J Hypertens,2013,31(9):1868 -1875.
[19]Tukiainen T,Jylanki P,Makinen VP,et al.Mild cognitive impairment associates with concurrent decreases in serum cholesterol and cholesterol-related lipoprotein subclasses[J].J Nutr Health Aging,2012,16(7):631-635.
[20]Frisardi V.Apolipoprotein E genotype:the innocent bystander or active bridge between metabolic syndrome and cognitive impairment[J].J Alzheimers Dis,2012,30(Suppl 2):S283-S304.
Impact of metabolic syndrome on the cognitive function of subcortical ischemic vascular disease
LIU Han,WANG Long,ZHOU Xia,et al
(Department of Neurology,First Affiliated Hospital of Anhui Medical University,Hefei,Anhui 230022,China)
Objective To explore the relationship between metabolic syndrome and the cognitive function of subcortical ischemic vascular disease.Methods Two hundred and twenty-six patients with subcortical ischemic vascular disease(SIVD),including 104 Metabolic syndrome(Mets),68 Risk Metabolic syndrome(R-Mets),54 No Metabolic syndrome(NO-Mets),were selected.The diagnostic criteria of Mets were the standards of National Cholesterol Education Program Adult Treatment Panel III(NCEP-ATP III).Cognitive function was assessed by the mini-mental state examination(MMSE)and CAMCOG-C.MRI was evaluated by the Blennow scale,which was divided into four subtypes by brain lesions.Results Both Mets group and R-Mets group showed significantly lower MMSE,CAMCOG-C scores than No-Mets group(P<0.05).The CAMCOG-C scores in Mets group were lower than R-Mets group(P<0.05).The correlation between waistline,IGT,DBP,SBP,TG and total cognitive scores were significantly negative(P<0.05).There were positive correlation between HDL and MMSE,CAMCOG-C scores(P<0.05).The ratio ofⅠ,Ⅱ subtypes in No-Mets group was much higher,51.6%,and 27.8%respectively,while the ratio ofⅢ,Ⅳsubtypes in R-Mets and Mets group was much higher,36.0%,and 30.8% respectively.Morbidities of the four subtypes were significantly different between No-Mets group and R-Mets and Mets group(P<0.05).Conclusions Mets and its individual components can aggravate the cognitive impariment of SIVD,of which abdominal obesity,IGT,SBP,DBP,TG,HDL-C are the important risk factors.With morbidity increase of R-Mets and Mets,the brain lesions of SIVD become severer.
metabolic syndrome;subcortical ischemic vascular disease;cognitive function;white matter lesion;lacunar infarction
10.3969/j.issn.1009-6469.2014.05.014
2013-12-01)
安徽省教育厅自然科学重点基金(No KJ2011A170)
孙中武,男,教授,硕士生导师,研究方向:老年神经病学,E-mail:sunzhwu@hotmail.com



