胡秀花,孙芷馨,赵梦洋,谢佳琪,王 敏,陈海良,葛 昕,刘天龙*,王少林*
(1.中国农业大学动物医学院,兽医公共卫生安全全国重点实验室,北京 100193;2.岭南现代农业科学与技术广东省实验室,广州 510642;3.北京野生动物园,北京 102602)
肠球菌属于革兰阳性菌,呈圆形或椭圆形,广泛存在于人和动物的消化道中,属于条件致病菌[1-2]。肠球菌不仅可引起尿路感染、皮肤软组织感染,还可引起危及生命的腹腔感染、败血症、心内膜炎和脑膜炎等[3],目前已成为院内感染的主要病原菌之一,其中最主要的病原菌为粪肠球菌和屎肠球菌,约占肠球菌感染的90%[4]。
肠球菌因其特殊的生物学特性,对临床常用的多数β-内酰胺类、氨基糖苷类等抗菌药物具有天然耐药性,同时由于临床抗菌药物的不规范使用,肠球菌在抗菌药物的选择性压力下进化出多种耐药机制,使肠球菌的临床耐药情况变得更为严峻。而随着人医临床多重耐药肠球菌感染率的升高及耐万古霉素肠球菌(VRE)的出现,肠球菌感染在临床治疗中的困难程度逐渐加大[5-6]。在2015—2020年的中国细菌耐药监测(CARST)中,人医临床上耐万古霉素肠球菌(VRE)的检出率均在1.5%以上,而在这些检出VRE中,屎肠球菌的比例普遍高于粪肠球菌[7-9]。同样,在兽医临床中,猪、禽、羊等动物中分离到的肠球菌也普遍存在多重耐药特征[10-16]。此外,研究表明,肠球菌可在人源和动物源之间进行传播[17],这无疑对人类健康构成了一定的威胁,因此做好动物源的肠球菌监测工作十分必要。
肠球菌致病能力主要是依靠其毒力因子及生物被膜的产生。目前已发现的毒力因子包括细胞溶血素、心内膜炎抗原、蛋白明胶酶等。动物源肠球菌普遍同时携带多种毒力基因,尤其在患病动物中[18-19]。而近年来,动物因感染肠球菌死亡的报道不断增多[20-23],其中也包括野生动物感染屎肠球菌发病的报道[24-25],提示野生动物园管理者要对肠球菌感染引起一定的重视。
本研究通过对北京野生动物园一只突发死亡的成年雄性赤腹松鼠进行病理剖检及细菌学鉴定,并对分离得到的屎肠球菌进行致病性和耐药性分析,以期为野生松鼠的疾病治疗和预防提供重要的参考依据。
1 材料与方法
1.1 材料
1.1.1 病料 动物来源于北京大兴野生动物园兽医院,采集病死赤腹松鼠的心、肝、脾、肺、肾以及腹腔积液。
1.1.2 主要培养基及试剂与仪器 脑心浸液琼脂培养基(BHA)、脑心浸液肉汤培养基(BHI)购自北京陆桥生物科技有限公司;血清型引物、16S通用引物均购自北京擎科生物科技有限公司;1×Taq酶,琼脂凝胶粉,GL2000 Marker均购自北京擎科生物科技有限公司;细菌基因组提取试剂盒购自北京创优美生物科技有限公司;脑心浸液琼脂培养基(BHA)、脑心浸液肉汤培养基(BHI)均按照培养基说明书进行配制。
1.2 方法
1.2.1 病理剖检 对死亡赤腹松鼠进行大体剖检观察并进行记录,并对动物的肝、脾、肺、心、肾等主要脏器进行取样后置入4%甲醛固定,48 h后进行石蜡切片及HE染色并在光学显微镜下进行组织病理学观察。
1.2.2 细菌分离鉴定 使用无菌接种环将死亡赤腹松鼠肝、脾、肺、心、肾无菌接种于普通营养琼脂,37 ℃恒温培养18~24 h后观察琼脂板上细菌生长情况,挑取不同形态的单一菌落在BHA进行纯化培养,挑取纯化后单一菌落至BHI中37 ℃、200 r·min-1培养18~24 h。后将纯化好的分离菌株送北京诺赛测序公司进行菌种鉴定。
1.2.3 基因组提取 按照细菌基因组提取试剂盒方法提取分离菌株基因组。
1.2.4 种属基因及毒力基因扩增 16S特异性基因、毒力基因esp、agg、gelE、cylA、cylB、cylM、efaAfs、efaAfm、ASA、CYT、ace引物参考文献[25-28]设计,由北京擎科科技有限公司合成,引物信息如表1。PCR扩增体系25 μL:模板1 μL,上、下游引物各0.5 μL,灭菌水10.5 μL,2×TaqMaster Mix 12.5 μL。扩增条件:95 ℃预变性5 min;95 ℃变性1 min、退火(退火温度如表1)30 s、72 ℃延伸90或45 s(16S rRNA和agg基因引物为90 s,其他为45 s),30个循环;72 ℃再延伸10 min。
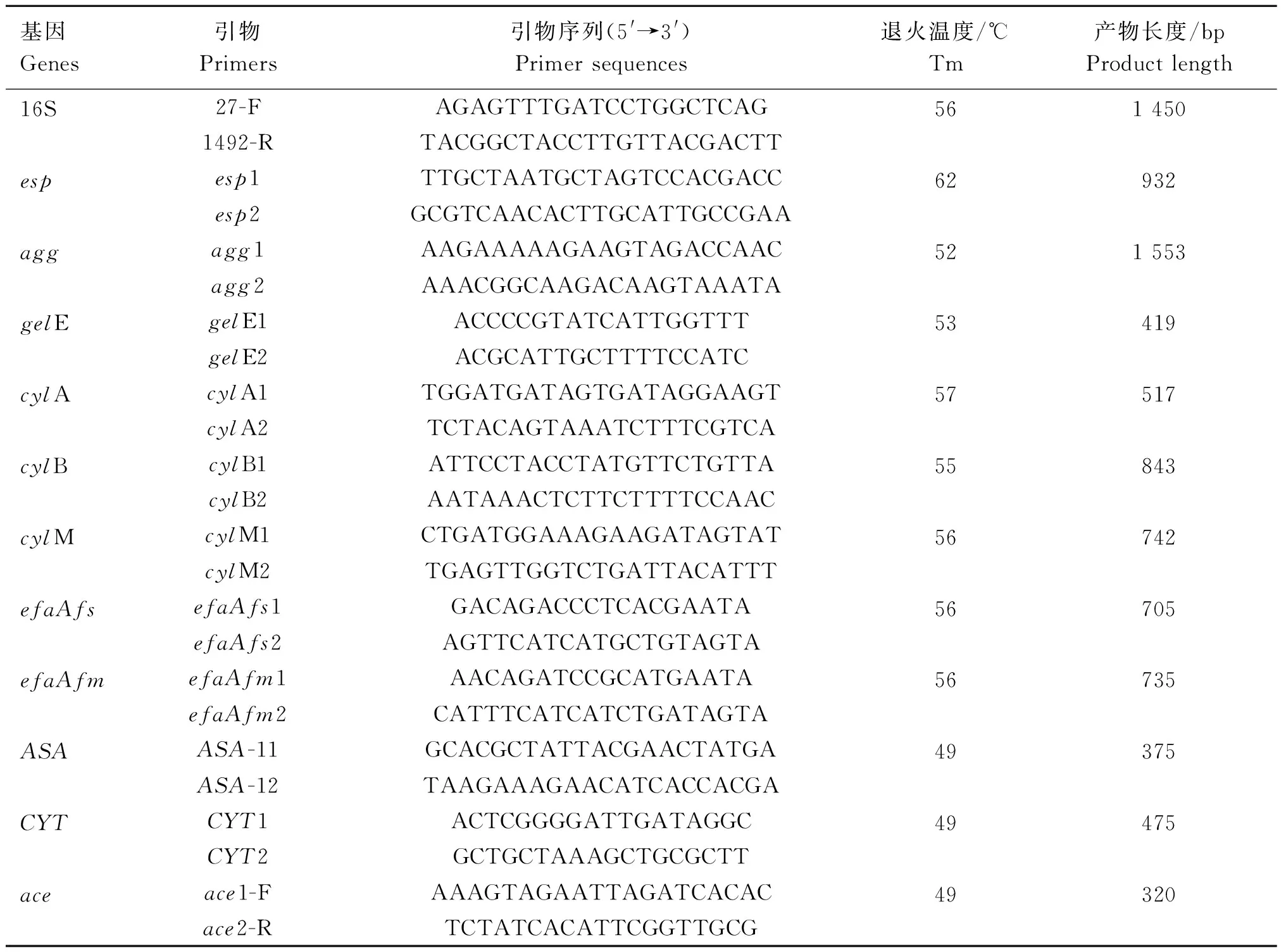
表1 引物信息Table 1 Primer information
1.2.5 药物敏感性试验 按照CLSI (M100 S2 6、 M45 A2、 VET01 A4)标准中微量肉汤稀释法进行药敏试验,质控菌株为粪肠球菌ATCC 29212。
1.2.6 全基因组测序 分离菌株按照分离部位分别命名为CFSS2012-G、CFSS2012-Fei、CFSS2012-Fu和CFSS2012-P。试剂盒提取分离菌株的基因组送北京赛默百合科技有限公司进行全基因组测序,使用SPAdes 3.9.0软件进行拼接,后将全基因组序列在CGE(Center for Genomic Epidemiology)网站上进行MLST、毒力基因及耐药基因的搜索比对,并使用Harvast 1.1.2进行核心基因组单核苷酸多态性(SNPs)分析。
1.2.7 致病性试验 从4株屎肠球菌中选取其中一株作为代表株进行动物致病性试验。选取6~8周龄SPF级的BALB/c雌鼠共32只,每组8只,分为4组,根据预试验结果分别设攻菌剂量为1×109、2×109、4×109CFU的试验组和对照组;试验组每只小鼠注射0.5 mL菌液,对照组每只小鼠注射0.5 mL的PBS (pH 7.2~7.4)。每隔24 h对所有小鼠观察一次,观察一周。观察期间对死亡小鼠进行剖检,并在无菌条件下对其肺、肝、脾以及腹腔进行病原菌分离。
2 结 果
2.1 病理剖检观察
大体病变可见,肺肿大,肺左叶有一黄豆大小的气肿且存有一定程度的自溶(图1A);腹壁和腹腔部分脏器发黑,右肾肿大(图1B);脾发黑质软(图1C);腹腔内有少量积水(图1D)。
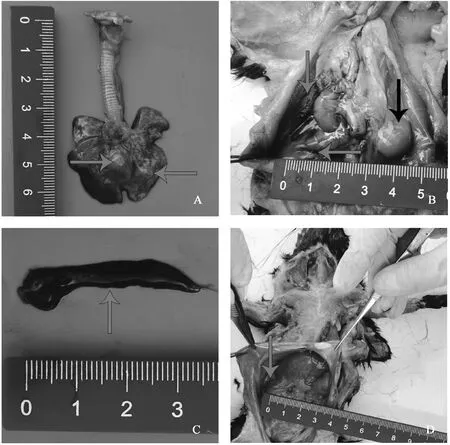
A. 肺(红色箭头所指为肺气肿部位);B. 肾(红色箭头所指为肾发黑部位,黑色箭头所指为肿大的右肾);C. 脾(红色箭头所指可见脾发黑);D. 腹腔(红色箭头所指为腹腔积水)。扫描文章首页OSID码可查看彩图A. Lung (the red arrow points to the emphysema); B. Kidney (red arrow points to the blackened part of the kidney, black arrow points to the enlarged right kidney); C. Spleen (the red arrow points to the blackened spleen); D. Abdominal cavity (the red arrow points to the hydroperitoneum).The color pictures can be found by scanning the OSID code on the front page of the article图1 肺、肾、胸腔、腹腔大体剖检示意图Fig.1 Schematic diagram of the gross autopsy of the lungs, kidneys, thoracic cavity and abdominal cavity
组织病理学检查结果显示,低倍镜下,肺可见部分肺泡腔融合形成大的“空洞”(图2A蓝色箭头),肺泡腔内可见大量纤维素样渗出物(图2A棕色箭头),细胞成分增多,局部可见蓝染的细菌菌丛(图2A黑色箭头),血管内可见大量炎性细胞以及红细胞(图2A绿色箭头);肾脏可见肾间质内蓝染的细菌菌丛(图2C黑色箭头),部分肾小管丧失了原有结构(图2C红色箭头)。高倍镜下,肺脏小血管内可见蓝染的成串状的菌丛(图2B黑色箭头),肺泡腔内含有大量粉染的纤维素样渗出物和巨噬细胞、浆细胞、淋巴细胞等炎性细胞(图2B蓝色箭头);肾可见蓝染的细菌菌丛(图2D黑色箭头)主要位于肾间质,部分肾小管上皮细胞脱离基底膜(图2D蓝色箭头)。肝、脾、心等脏器未见明显异常。

A. 肺(标尺=100 μm)(蓝色箭头所指为低倍镜下由肺泡腔融合形成的“空洞”,棕色箭头所指为低倍镜下纤维素样渗出物,黑色箭头所指为低倍镜下蓝染菌丛,绿色箭头所指为低倍镜下大量炎性细胞及红细胞);B. 肺(标尺=10 μm)(黑色箭头所指为高倍镜下肺小血管内蓝染串状菌丛,蓝色箭头所指为高倍镜下肺泡腔内粉染纤维素渗出物和炎性细胞);C. 肾(标尺=100 μm)(黑色箭头所指为低倍镜下蓝染菌丛,红色箭头所指为低倍镜下失去原有结构的肾小管);D. 肾(标尺=20 μm)(黑色箭头所指为高倍镜下肾间质内蓝染菌丛,蓝色箭头所指为高倍镜下脱离基底膜的肾小管上皮细胞)。扫描文章首页OSID码可查看彩图A.Lung (bar=100 μm) (blue arrows point to the "cavities" formed by the fusion of alveolar spaces under low magnification, brown arrow points to fibrinoid exudates under low magnification, black arrow points to Blue-stained flora under low magnification, green arrow points to a large number of inflammatory cells and red blood cells under low magnification); B. Lung (bar=10 μm) (black arrows point to blue-stained streak flora in small blood vessels of the lung under high magnification, and blue arrow points to powder-stained fibrin exudates and inflammatory cells in alveolar cavity under high magnification) ; C. Kidney (bar=100 μm) (black arrow points to blue-stained flora under low magnification microscope, red arrow points to renal tubule that has lost its original structure under low magnification microscope); D. Kidney (bar=20 μm) (black arrows point to the blue-stained flora in the renal interstitium under high magnification microscope, and the blue arrow points to the renal tubular epithelial cells detached from the basement membrane under high magnification microscope).The color pictures can be found by scanning the OSID code on the front page of the article图2 高低倍镜下肾、肺的组织切片示意图Fig.2 Schematic diagram of tissue sections of kidney and lung under high and low magnification
2.2 菌株鉴定
在BHA纯化培养之后可见形态单一,大小均等的白色不透明菌落。革兰染色可见圆形或椭圆形、呈单个或成对或短链状排列的革兰阳性球菌。16S rDNA序列在GenBank上Blast比对结果显示:与NCBI登载的GenBank中屎肠球菌的16S rDNA序列相似性均在98%~99%。
2.3 种属基因及毒力基因检测
16S PCR扩增出1 450 bp的片段,与屎肠球菌大小一致,毒力基因PCR扩增出efaAfm的条带,片段大小为735 bp。PCR扩增图如图3、4所示。

M. DL2000 DNA相对分子质量标准;1. 肺;2. 腹腔;3. 肝;4. 脾;5.阴性对照M. DL2000 DNA marker;1.Lung;2.Abdominal cavity;3.Liver;4.Spleen;5.Negative control图3 16S PCR鉴定结果Fig.3 16S PCR identification results
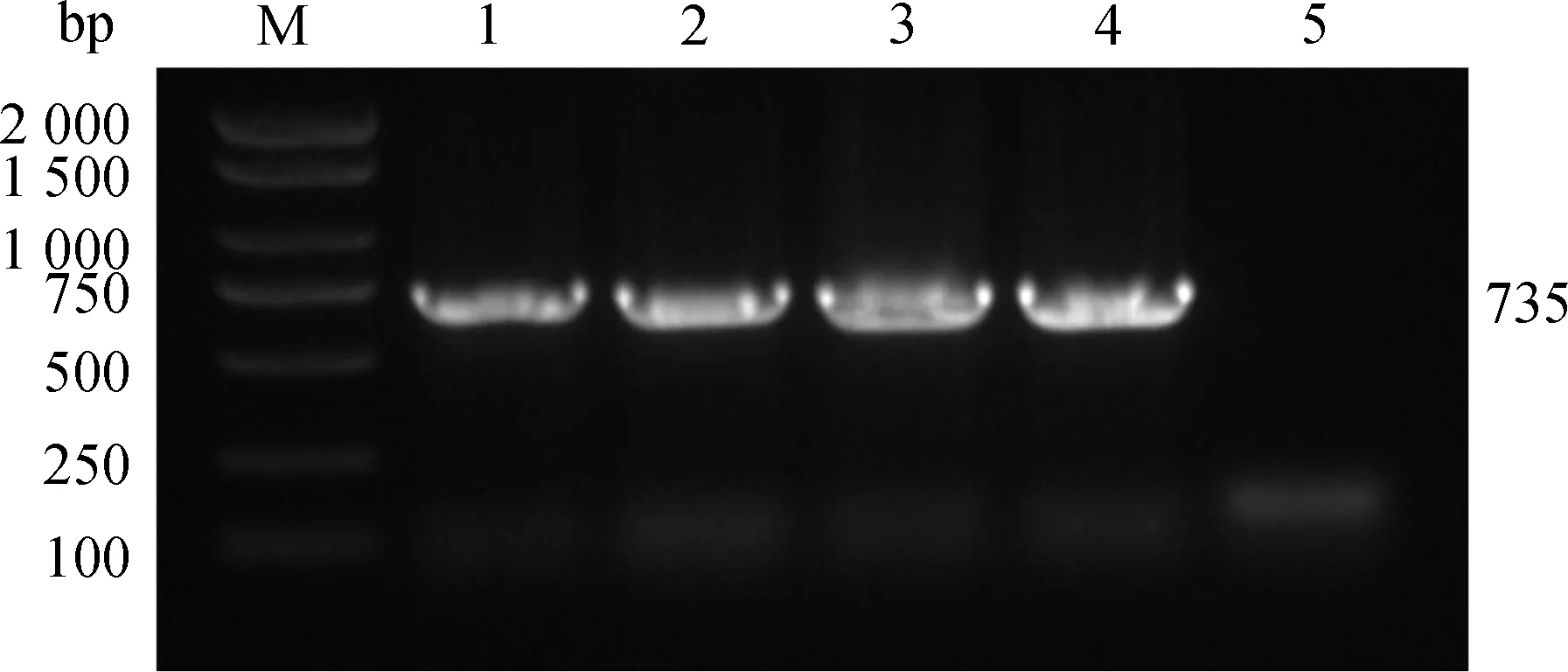
M. DL2000 DNA相对分子质量标准;1. 肺;2. 腹腔;3. 肝;4. 脾;5.阴性对照M. DL2000 DNA marker;1. Lung;2. Abdominal cavity;3.Liver;4. Spleen;5. Negative control图4 efaAfm毒力基因PCR鉴定结果Fig.4 efaAfm virulence gene PCR identification
2.4 耐药表型判定
参考CLSI(M100 S2 6、 M45 A2、 VET01 A4)标准判定细菌药物敏感性,结果表明4株菌株的药敏试验结果完全一致,如表2所示,均对磺胺异恶唑、泰妙菌素高度耐药,对红霉素、克林霉素、头孢西丁、氧氟沙星、替米考星、四环素低度耐药,对青霉素、恩诺沙星、头孢噻呋、万古霉素、多西环素、氟苯尼考、庆大霉素、利奈唑胺、苯唑西林、复方新诺明敏感,质控菌株粪肠球菌ATCC 29212药敏结果在质控范围内。
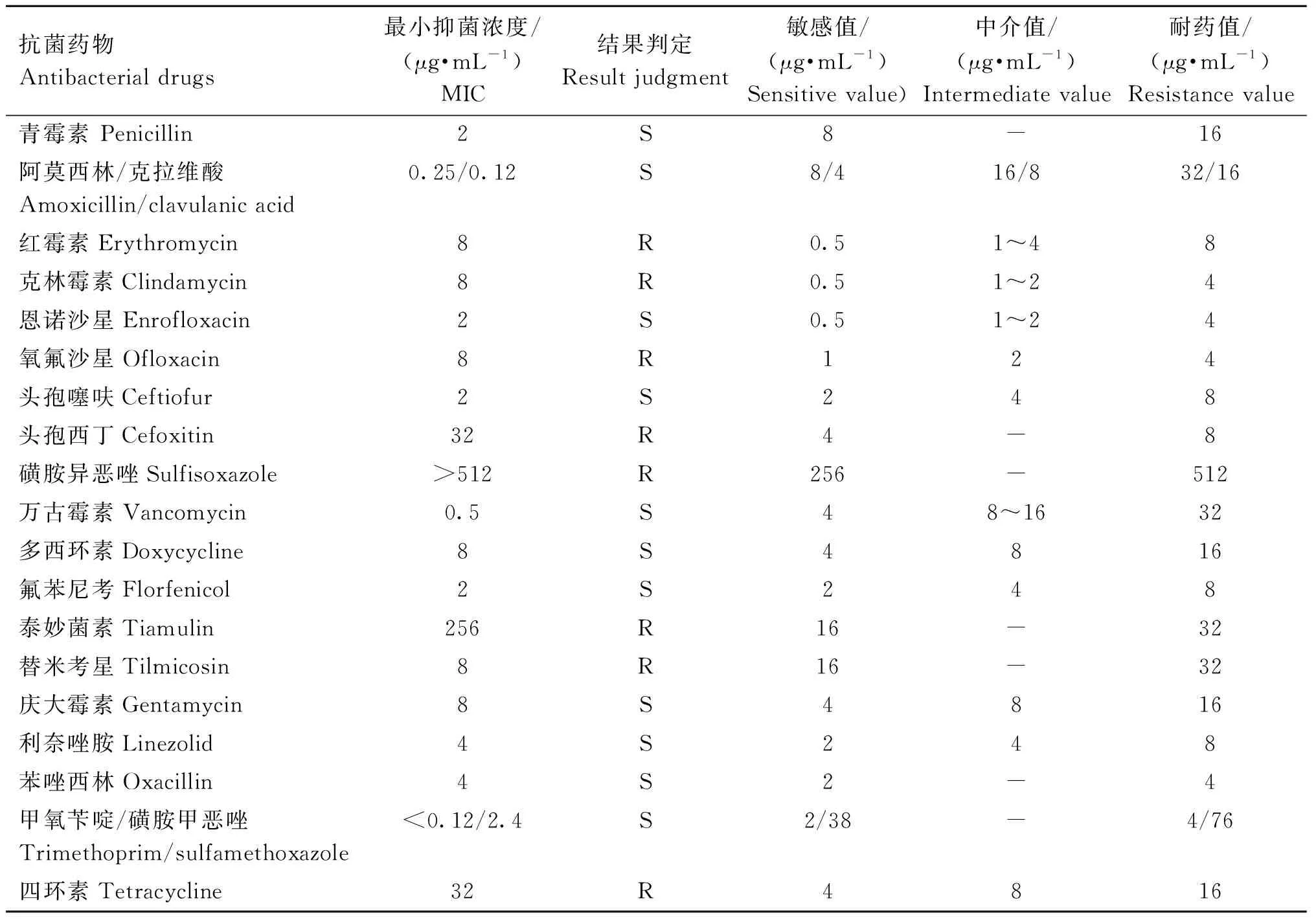
表2 药敏试验结果Table 2 Bacterial susceptibility test results
2.5 全基因组数据分析
全基因组序列分析显示,4株屎肠球菌均属于ST-324型,且菌株之间SNPs ≤22,如图5所示;毒力基因和耐药基因比对结果显示,菌株均携带毒力基因efaAfm和acm、四环素耐药基因tetM及大环内酯类耐药基因msrC,与毒力基因PCR扩增结果及药敏结果基本保持一致。
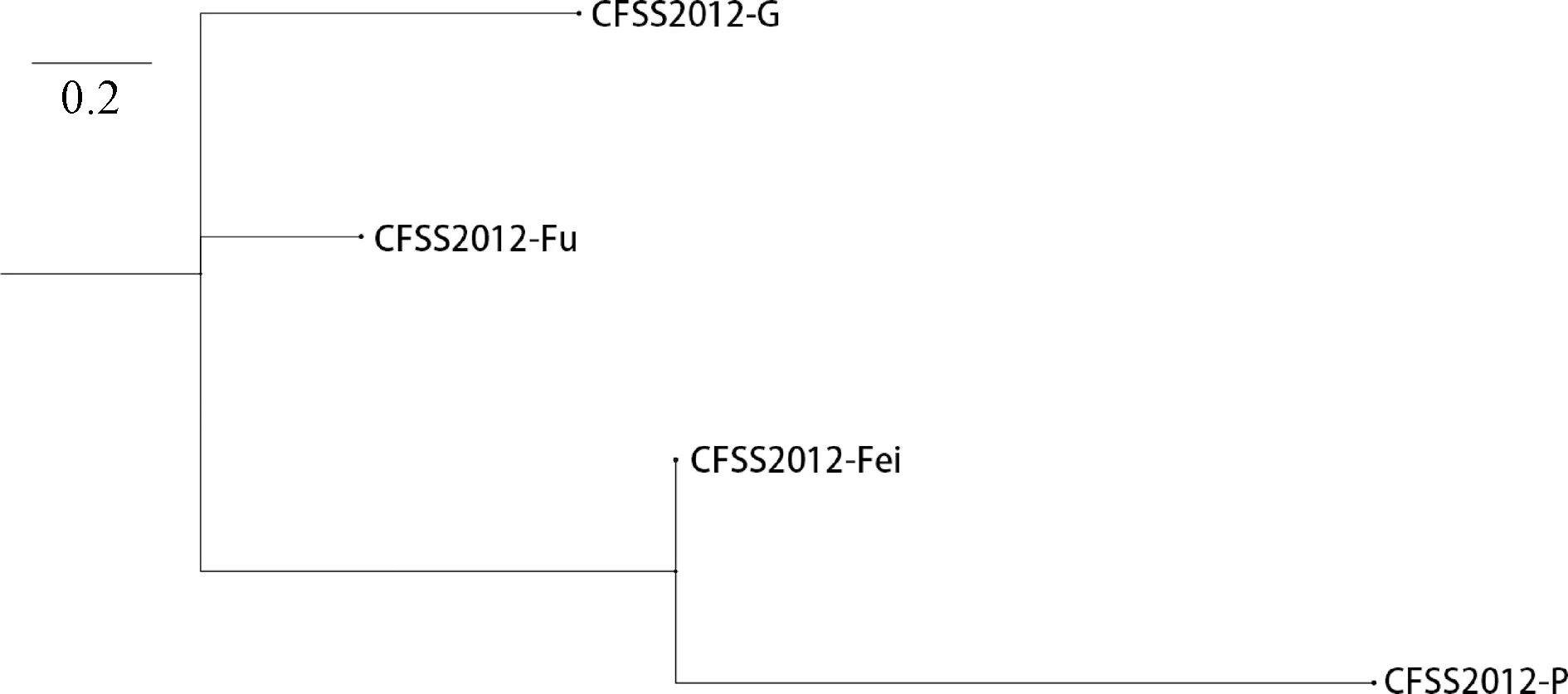
图5 不同脏器分离菌株的SNP差异Fig.5 SNP differences of strains isolated from different organs
2.6 致病性分析
1×109CFU剂量组小鼠攻菌24 h后呈现被毛凌乱,精神萎靡状态,后慢慢恢复正常状态,未见死亡情况,1周后对1×109CFU剂量组未死亡小鼠剖检可见肝表面苍白,细菌分离可见屎肠球菌典型菌落生长,其他脏器未见明显变化,未分离出细菌;2×109CFU剂量组小鼠攻菌24 h后精神萎靡,被毛凌乱,眼部出现黏液,48 h后全部死亡,后进行剖检可见大肠充满气体,肝、脾出现淤血现象,细菌分离可见屎肠球菌典型菌落生长;4×109CFU剂量组所有小鼠攻菌24 h后全部死亡,身体呈现四肢僵硬,眼部分泌有较多黏液,进行剖检可见小鼠肝、脾、肺均出现淤血现象,大肠被大量气体充满,细菌分离可见屎肠球菌典型菌落生长;对照组未见典型菌落生长。由试验组3个不同剂量的试验结果可知,分离屎肠球菌的半数致死量为1×109~2×109CFU,具有一定的致病性。
3 讨 论
本研究从野生动物园死亡赤腹松鼠的肝、肺、脾以及腹腔积液中分离鉴定到4株屎肠球菌,全基因组测序分析显示同属于ST-324型,且SNPs差异较小,该型在人类医院临床中曾被报道过[29-30],动物源中尚未见有该型的相关报道。药敏结果显示分离菌株对大环内酯类、四环素类等具有一定的耐药性,这或许与分离菌株携带四环素耐药基因tetM和大环内酯类耐药基因msrC有关。tetM是肠球菌的一种核糖体保护蛋白基因,也是介导肠球菌四环素耐药的主要基因之一[31]。msrC是肠球菌通过编码ABC型转座子蛋白基因,从而介导大环内酯类药物耐药的基因,研究表明此基因存在于大部分屎肠球菌的染色体上,而在小部分的屎肠球菌中未发现有此基因的存在[32],同时,此基因也被证明在屎肠球菌对抗大环内酯类药物中具有保护作用,但其确切功能还有待进一步研究[33]。此外,药敏结果显示分离菌株对磺胺类、截短侧耳类药物具有高耐药表型,但全基因组测序并未发现有相关耐药基因,其耐药机制还需进一步研究。
研究表明,屎肠球菌在机体免疫力低下时可从肠道转移至机体其他组织器官并进行黏附聚集引起机体发病[34-35]。而在本研究中全基因组测序发现,分离菌株携带毒力基因efaAfm的同时还携带acm基因。efaAfm基因是一种主要编码屎肠球菌心内膜炎抗原的可促进肠球菌在宿主体内定殖的毒力因子[36];acm基因编码的黏附素主要在宿主细胞受损时发挥作用,能够介导屎肠球菌黏附胶原蛋白和层黏连蛋白,定植宿主体内,从而引起感染[37]。这两种毒力基因的存在无疑在一定程度上增加了屎肠球菌入侵动物机体的能力。
由于微生物培养只在有氧条件下进行了细菌培养,故不能排除厌氧菌及其他微生物致病的可能性,但动物致病性试验显示分离菌株具有一定的致病性,在不良的生活环境下(如寒冷、饥饿或打架受伤)仍具有感染机体致病的潜在风险,提醒野生动物园工作人员要加强对野生赤腹松鼠的饲养环境管理。同时,本研究为野生动物园内赤腹松鼠屎肠球菌感染的研究提供了相关数据,为野生动物园预防赤腹松鼠屎肠球菌感染提供一些科学依据,也为其他野生动物的细菌性感染疾病的诊断提供参考。
4 结 论
本研究从死亡赤腹松鼠内脏组织中分离到屎肠球菌,经全基因组测序分型鉴定均为ST-324,致病性试验表明分离菌株具有一定的致病能力,结合组织病理学检查结果推测,赤腹松鼠死亡原因为屎肠球菌入侵机体内多器官并进入血液循环,从而引起机体败血症导致宿主死亡。



