任秀娟,康德措,苏少锋,蔺雅楠,李雅静,杜 明,白东义,李 蓓,赵一萍*,芒 来*
(1.内蒙古农业大学动物科学学院/马属动物研究中心,呼和浩特 010018;2.青海省种羊繁育推广服务中心,海北藏族自治州 812300;3.内蒙古自治区农牧业科学院,呼和浩特 010031)
蒙古马(Equusmongolianhorse)起源于蒙古草原,被人类驯化后,除定向培育类群外,大部分属于未经人工选育的原始品种。内蒙古草原的气候特点是寒冷、干旱和风大,并受沙尘暴影响严重(http://nmg.weather.com.cn/)。蒙古马采取野外散养或半圈养的饲养管理方式。蒙古马已很好地适应了当地恶劣的生存环境和粗放的饲养管理方式。纯血马(E.thoroughbred)是为了适应短距离比赛的需求,以速度性状为选育目标,经历300多年的闭锁繁育而形成的品种,其血统来源可追溯到3个父系。通常,近亲繁殖会导致严重的近交衰退,即纯合的有害隐性(或部分隐性)突变会导致个体的适应性降低[1]。如肝配蛋白A5 (ephrin A5,EFNA5)基因遗传区域单倍型的纯合状态,是赛马肌肉、骨骼灾难性损伤常见原因之一[2]。纯血马对饲养管理的要求非常严格。因此,蒙古马和纯血马已适应了不同的饲养管理、生存环境条件和人工选择压力。
马在适应特定环境和选择压力时,生理机能会发生相应的改变,但是其分子机制尚不完善。免疫系统在适应特定环境、灰尘暴露和运动等外界压力时发挥关键作用。例如,晋江马(E.jinjianghorse)对中国东南沿海地区高温和潮湿环境有很强的适应性,其可能的分子机制是热休克70kDa蛋白1A(heat shock 70kDa protein 1A,HSPA1A)基因拷贝数增加[3]。雅库特马(E.yakutianhorse)对北极极端寒冷气候有很强的适应性,这可能与其大量寒冷适应性候选基因的顺式调控区域受到正选择有关[4]。研究表明,粉尘暴露的马容易感染炎症性气道疾病,患病马对吸入性抗原会发生免疫反应,肿瘤坏死因子(tumor necrosis factor,TNF-α)、白细胞介素1β(interleukin 1 beta,IL-1β)和白细胞介素23亚单位α(interleukin 23 subunit alpha,IL-23)基因的mRNA水平显着升高[5]。运动对机体免疫功能具有双重影响。长期保持科学的运动可改善机体的免疫功能,降低上呼吸道感染等炎症性疾病的发生[6-7]。例如,与济州马(E.jejuhorse)相比,纯血马对运动应激的生理反应更不敏感[8]。另外,短暂的高强度运动、长时间的力竭运动和过度训练会导致肌肉痉挛并伴随肌纤维损伤,使机体发生炎症等免疫反应[9-10]。运动马常见伤病的病因大部分与运动负荷有关,例如屈腱炎、急/慢性关节炎和韧带炎等[11]。
NF-κB信号通路在机体抵抗病原体等免疫反应过程中发挥积极作用,参与固有免疫应答和适应性免疫应答[12]。在病原微生物感染或其诱导的炎症因子刺激下,核因子κB抑制因子α(NFκB inhibitor alpha, NFKBIA)等抑制蛋白被泛素化并降解,核因子κB亚基p50 (nuclear factor kappa B subunit 1,NF-κBp50)/核因子κB亚基p65 (RELA proto-oncogene NF-kB subunit,NF-κBp65)异源二聚体解离并释放进入细胞核,启动细胞因子IL-1β、C-X-C基序趋化因子配体8(C-X-C motif chemokine ligand 8,IL-8)和TNF-α等靶基因转录[12-13]。研究表明,因蚊虫叮咬感染西尼罗河病毒(WestNilevirus)的马,其外周血单核细胞的NF-κB、IL-1β和IL-8基因表达量升高[14]。脂多糖(lipopolysaccharide, LPS)等有害物质的过度暴露会触发肝脏NF-κB激活,导致TNF-α、IL-1β和IL-8炎症因子的释放[15-16]。给母马宫颈内接种链球菌(Streptococcusssp.)后,母体和胎儿脾脏IL-1β基因的表达升高[17]。
蒙古马具有抗病力强和环境适应性强等特点。纯血马是以运动性能定向选育形成的品种,适应舍饲且饲草料充足的饲养管理环境。蒙古马和纯血马在不同的环境及人工选择压力下,其免疫基因调控网络是否存在品种间多样性尚未可知。本研究对蒙古马和纯血马的血液进行RNA-Seq和表达谱比较分析。根据表达谱结果,对NF-κB信号通路7个基因在2个品种马肝脏、脾脏、肺脏和血液中的表达进行qRT-PCR分析。在转录组水平评价了蒙古马和纯血马的免疫功能,以探索其机体免疫性能多样性的可能分子机制。为蒙古马免疫性能深入研究和抗病育种工作的开展提供理论基础和数据依据。
1 材料与方法
1.1 试验动物
本研究的试验动物包括3匹雌性蒙古马(E.mongolianhorse) (编号: MH1、MH2和MH3)和3匹雌性纯血马(E.thoroughbred) (编号: TH1、TH2和TH3)。样品来自于内蒙古自治区包头市,蒙古马为野外自由放养,纯血马为舍饲喂养的退役比赛用马。试验动物健康状况良好,平均年龄为(5.67±1.53)岁[18]。样品采集时间是10月份,确保所有动物日常摄入营养充足和食物结构(以干草为食)相似。采集颈静脉血液并保存于-80 ℃冰箱,从全血中提取RNA,采用Illumina NextSeq 500进行测序。
用于NF-κB信号通路分析的试验动物包括3匹蒙古马(样品来自于内蒙古自治区包头市,为野外自由放养)和3匹纯血马(样品来自于内蒙古自治区包头市,为舍饲喂养)。试验马均为健康状况良好,年龄为2岁左右。脾脏、肝脏和肺脏样品的采集方法是屠宰采集,样品采集时间是10月份,所有样品保存于-80 ℃冰箱。
1.2 数据质控
对下机数据进行质控,符合以下任何一个标准的reads则被过滤:1) 包含5个以上adapter碱基污染的reads;2) 50%以上的碱基Q≤19的reads;3) 5%以上碱基是N的reads。根据上述标准,如果任何一个read被过滤,与其配对的另一条read也被舍弃。
1.3 差异表达分析
以纯血马基因组(Equcab3.0, ftp://ftp.ncbi.nlm.nih.gov/genomes/all/GCF/002/863/925/GCF_002 863 925.1_EquCab3.0)为参考,使用HISAT2(version 2.0.5)软件[19]将质控后的reads比对到参考基因组。使用HTSeq (version 0.6.0)软件进行表达量分析[20]。使用DESeq2软件进行差异表达分析[21]。基因差异表达显着的标准是:q<0.05且|log2(Fold Change)|≥1。
为了验证RNA-Seq结果的可靠性,随机选取10个基因:干扰素诱导的四肽重复蛋白3 (interferon induced protein with tetratricopeptide repeats 3,IFIT3)、干扰素诱导的四肽重复蛋白5 (interferon induced protein with tetratricopeptide repeats 5,IFIT5)、2′-5′-寡腺苷酸合成酶(2′-5′-oligoadenylate synthetase-like,OASL)、肿瘤坏死因子超家族成员10(TNF superfamily member 10,TNFSF10)、T、B淋巴细胞弱化因子(B and T lymphocyte associated,BTLA)、Fos原癌基因AP-1转录因子亚单位 (Fos proto-oncogene AP-1 transcription factor subunit,FOS)、肿瘤坏死因子受体超家族成员1B(TNF receptor superfamily member 1B,TNFRSF1B)、C-C基序趋化因子配体5(C-C motif chemokine ligand 5,CCL5)、REL原癌基因,NF-kB亚单位(REL proto-oncogene, NF-kB subunit,REL)和NF-κBp65进行qRT-PCR验证。使用Primer Premier 5.0软件进行引物设计(表1),引物由生工生物工程(上海)股份有限公司合成。使用Blast2GO软件对差异表达基因进行GO富集分析,显着富集的阈值为FDR<0.05。使用KEGG的KAAS进行KEGG注释,对KEGG中每个Pathway应用超几何检验进行富集分析,Pathway显着富集的阈值为FDR<0.05。
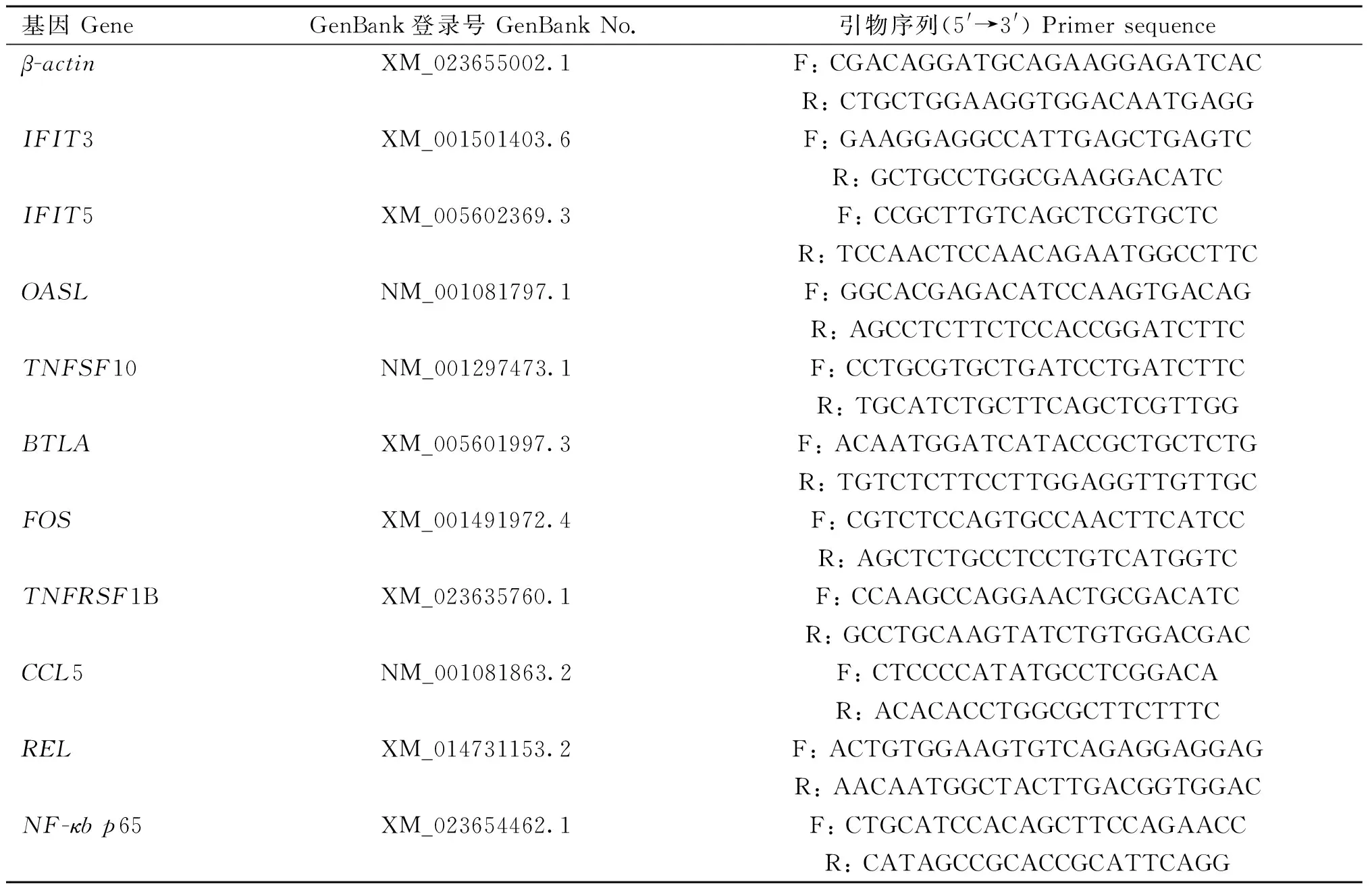
表1 用于评估RNA-Seq稳定性的qRT-PCR引物信息Table 1 Primers information for qRT-PCR to assess steady-state RNA-Seq
1.4 荧光定量PCR
以马β-actin为内参基因,以NF-κB信号通路7个基因NF-κBp65、NF-κBp50、NFKBIA、IL-1β、TNF-α、IL-8和前列素内环氧化物合成酶2 (prostaglandin-endoperoxide synthase 2,PTGS2)为目的基因。使用Primer Premier 5.0软件进行引物设计(表2),引物由生工生物工程(上海)股份有限公司合成。用Trizol提取总RNA,使用酶标仪检测总RNA的纯度和浓度,OD值在1.8~2.0之间且浓度较高的总RNA用于后续试验。根据PrimeScriptTMRT Master Mix反转录试剂盒(TaKaRa,中国)说明书进行反转录,合成cDNA。qRT-PCR反应体系根据TB Green®Premix ExTaqTMII定量试剂盒(TaKaRa,中国)说明书配制,共25 μL:TB Green Premix ExTaqTMII 12.5 μL,上、下游引物各1 μL,cDNA 2 μL,ddH2O 8.5 μL。反应条件:95 ℃预变性5 min;95 ℃变性1 min,60 ℃退火30 s,72 ℃延伸1 min,40个循环。为减少试验过程中产生的误差,每个样品进行3次重复。采用2-ΔΔCt定量分析方法进行表达量分析。采用GraphPad Prism 6软件进行t-test检验,差异显着值为P<0.05,差异极显着值为P<0.01。
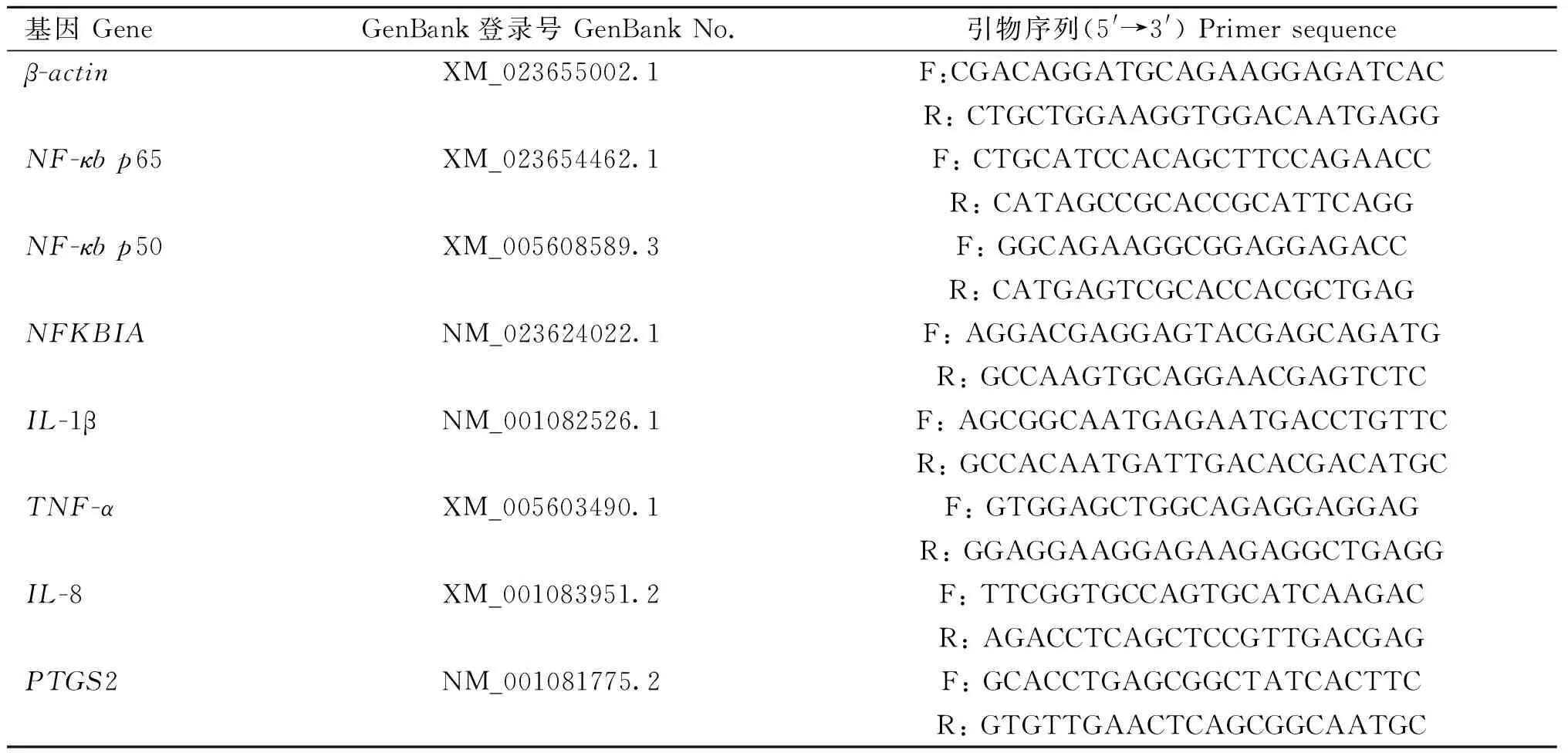
表2 引物信息Table 2 Primers information
1.5 免疫印迹分析
采用常规方法提取总蛋白。分别称取50 mg蒙古马与纯血马肺脏组织,立即放入液氮预冷的研钵中进行研磨,期间不断加入液氮。研磨至粉末状态后移入1.5 mL离心管,并加入500 μL裂解液,电动匀浆器匀浆1 min,剧烈震荡2 min,冰上孵育20 min后,超声处理3 min,4 ℃ 13 000 r·min-1离心20 min。取上清液,储存在-20 ℃冰箱备用。采用二辛可宁酸(bicinchoninic acid, BCA)蛋白定量试剂盒(Cwbiotech,中国)检测蛋白浓度。然后通过制胶、蛋白变性、凝胶电泳、转膜、封闭、一抗孵育、二抗孵育、成像和灰度分析等步骤对目的蛋白表达量进行分析。用0.45 pm孔径的PVDF膜,通过湿转法进行凝胶转膜。免疫印迹中使用的一级抗体是兔多克隆NF-κB p65抗体(Abcam,英国)、山羊多克隆IL-1β抗体(Abcam,英国)和小鼠单克隆β-actin抗体(ZSGB-BIO,中国)。二级抗体是羊抗兔IgG抗体、兔抗羊IgG抗体、羊抗鼠IgG抗体(Jackson,美国)。采用GraphPad Prism 6软件进行t-test检验,差异显着值为P<0.05,差异极显着值为P<0.01。
2 结 果
2.1 马血液转录组测序
为了比较和分析蒙古马和纯血马在适应不同生存环境过程中mRNA表达谱的整体情况,本研究对3匹蒙古马(编号:MH1、MH2、MH3)和3匹纯血马(编号:TH1、TH2、TH3)的血液样品构建了6个cDNA文库,使用Illumina平台进行转录组测序。每个样本平均产生24.92 Gb下机数据。质量控制后,共获得19.69~23.95 Gb的高质量数据,Q30≥95%(表3)。以纯血马基因组为参考,每个文库高质量数据的比对率达98%(表3)。组装后,共获得17 026个已注释的蛋白质编码基因,用于后续分析。
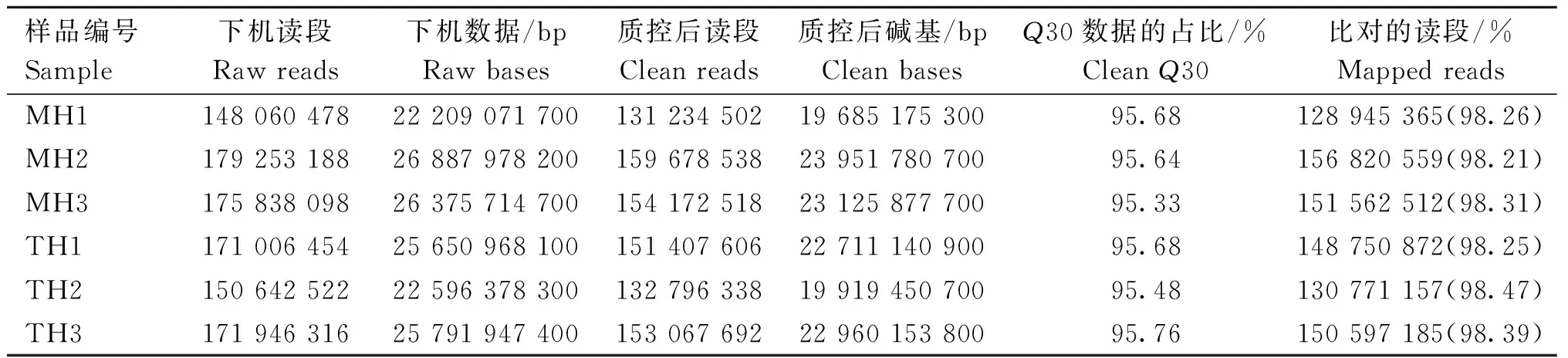
表3 各样本高质量测序数据统计Table 3 Summary of high-quality reads obtained for each sample
2.2 马血液mRNA差异表达分析结果
蒙古马与纯血马相比,共获得1 199个差异表达的mRNA,在蒙古马中460个表达上调和739个表达下调(图1A)。对这些差异表达的基因进行聚类分析,如图1B所示,明显的分为蒙古马和纯血马2个表达模式聚类,这反映了试验样本的生物学可重复性。由图1C可知,随机选取10个基因(IFIT3、IFIT5、OASL、TNFSF10、BTLA、FOS、TNFRSF1B、CCL5、REL和NF-κBp65)的qRT-PCR结果与RNA-Seq的表达趋势一致,表明RNA-Seq数据是可靠的。差异表达基因功能分析发现,大部分和机体免疫功能相关,包括主要组织相容性复合物Ⅰ类基因(Major Histocompatibility complex class I genes,MHCⅠ ),如MHC I级重链(MHC class I heavy chain,MHCX1)和 MHC I级重链 (MHC class I heavy chain,EQMHCB2)、主要组织相容性复合物Ⅱ类基因(Major Histocompatibility complex class Ⅱ genes,MHCⅡ),如MHC II类DRα链 (MHC class II DR alpha chain,DRA) 和 MHC II类DQβ链(MHC class II DQ-beta chain,DQB);促炎性细胞因子,如IL-1β和IL-8;促炎性趋化因子,如趋化因子C-C基序配体3 (chemokine C-C motif ligand 3,CCL3)和CCL5;干扰素刺激基因IFIT家族,如IFIT3和IFIT5;转录因子,如REL和Jun原癌基因AP-1转录因子亚单位(Jun proto-oncogene, AP-1 transcription factor subunit,JUN)和免疫蛋白基因,如乌头酸脱羧酶1(aconitate decarboxylase 1,ACOD1)。
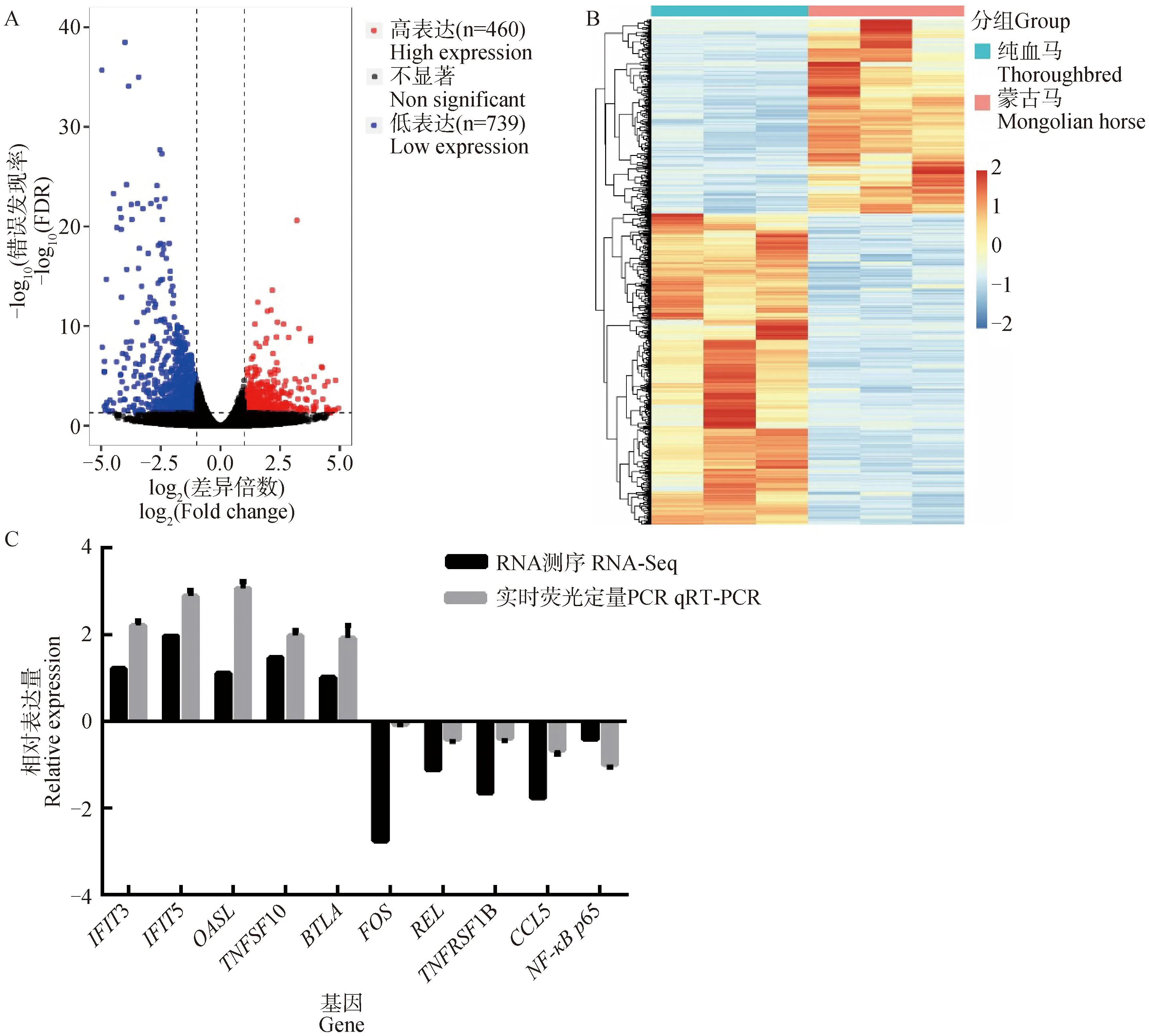
图1 蒙古马和纯血马基因表达量比较Fig.1 The comparison of gene expression between Mongolian horse and Thoroughbred
2.3 差异表达基因GO富集分析
对差异表达基因进行GO富集分析。结果显示221个GO条目被显着富集(FDR<0.05),其中生物学过程(biological process, BP)的186个条目,分子功能(molecular function, MF)的15个条目和细胞成分(cell component, CC)的20个条目被显着富集。
许多显着富集的GO条目直接和免疫反应过程相关(图2),例如免疫反应(immune response)、固有免疫反应(innate immune response)、抗原加工和提呈(antigen processing and presentation)和toll样受体4信号通路负调控(negative regulation of toll-like receptor 4 signaling pathway);炎症反应相关过程,例如炎症反应(inflammatory response)、急性炎症反应(acute inflammatory response)、炎症反应的调节(regulation of inflammatory response)和炎症反应的负调节(negative regulation of inflammatory response);和抗细菌感染反应相关过程,例如对细菌的反应(response to bacterium)、对细菌来源分子的反应(response to molecule of bacterial origin)、对LPS的反应(response to lipopolysaccharide)和细胞对细菌来源分子的反应(cellular response to molecule of bacterial origin)。
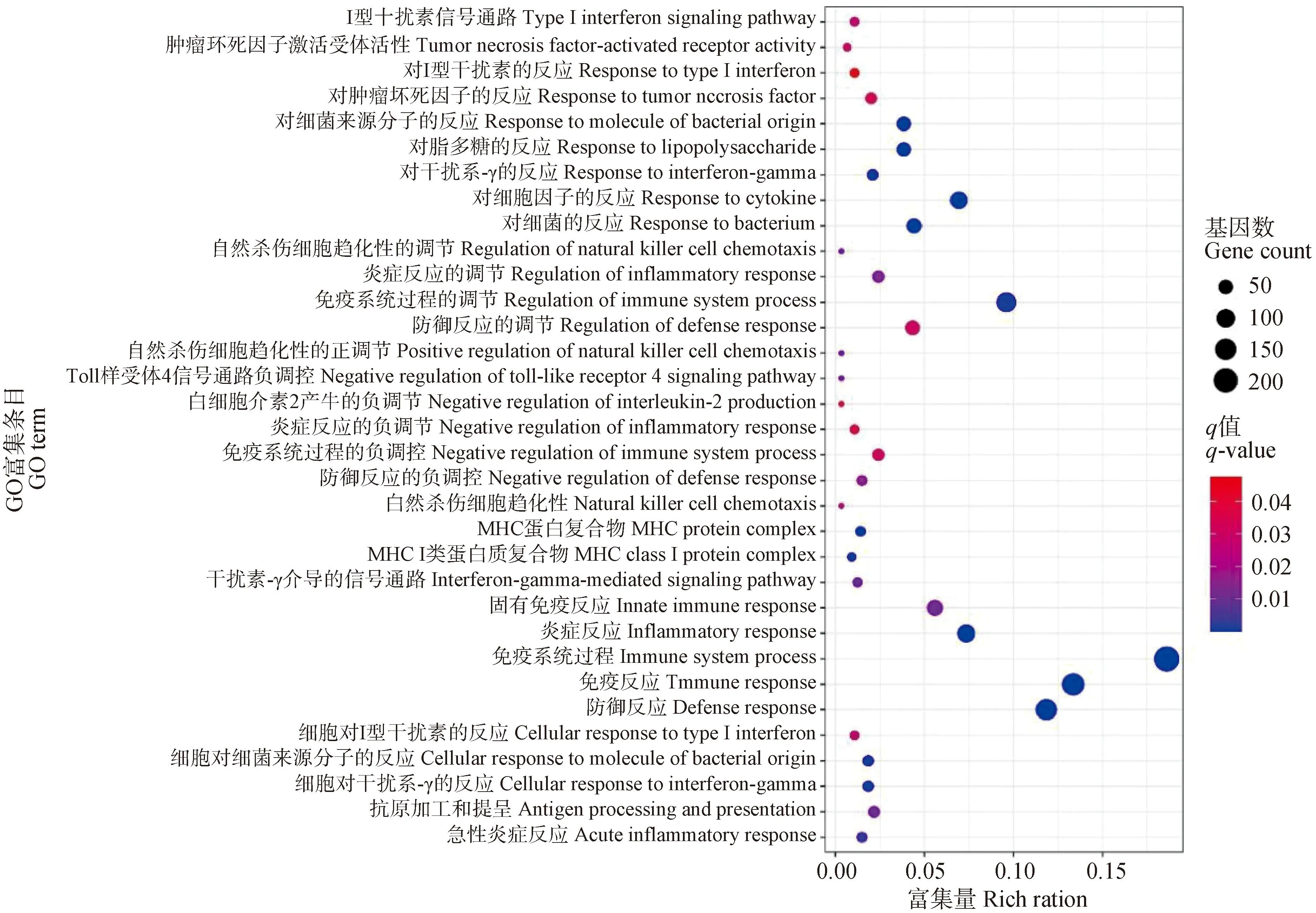
图2 差异表达基因GO富集Fig.2 GO enrichment of differentially expressed genes
2.4 差异表达基因KEGG富集分析
KEGG富集分析结果显示,差异表达的mRNA共显着富集到8个KEGG通路(图3),这些通路均与机体免疫过程相关,包括细胞因子和细胞因子受体相互作用(cytokine-cytokine receptor interaction)、移植物抗宿主病(graft-versus-host disease)、类风湿性关节炎(rheumatoid arthritis)、肿瘤坏死因子信号通路(TNF signaling pathway)、趋化因子信号通路(chemokine signaling pathway)、I型糖尿病(type I diabetes mellitus)、NF-κB信号通路(NF-kappa B signaling pathway)和造血细胞谱系(hematopoietic cell lineage)。
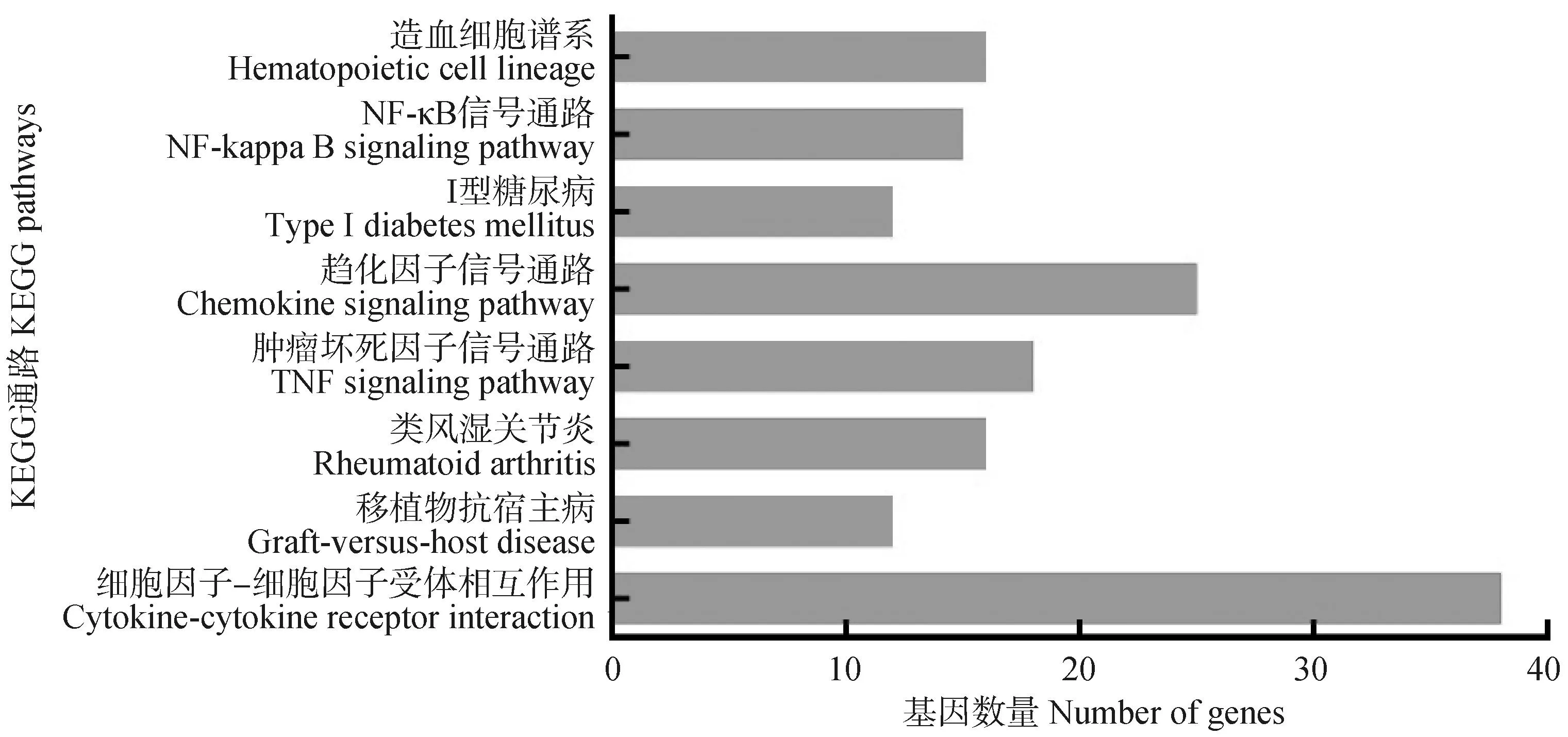
图3 差异表达基因的KEGG富集Fig.3 KEGG enrichment of differentially expressed genes
2.5 免疫组织NF-κB信号通路相关基因的表达研究
NF-κB信号通路在免疫过程中具有至关重要的作用。为了评估NF-κB信号通路相关基因在免疫组织(血液、脾脏、肝脏和肺脏)中的表达多样性,以β-actin为内参基因,使用qRT-PCR比较NF-κBp65、NF-κBp50、NFKBIA、IL-1β、TNF-α、IL-8和PTGS2基因在蒙古马和纯血马品种之间的表达多样性。
NF-κB 信号通路7个基因在蒙古马和纯血马的4个免疫组织中均表达。IL-1β、IL-8、NFKBIA和PTGS2基因在蒙古马血液中的表达显着低于纯血马 (P<0.05),NF-κBp65、NF-κBp50和TNF-α基因在蒙古马和纯血马血液中的表达差异不显着(P≥0.05),这些基因在血液中的qRT-PCR结果和RNA-Seq的趋势一致(图4A)。7个基因在蒙古马肺脏中的表达均高于纯血马,除TNF-α差异不显着(P≥0.05),其余基因均差异显着(P<0.05)(图4D)。血液、脾脏和肝脏中,NF-κBp50和NF-κBp65基因品种之间的表达差异不显着(P≥0.05);IL-1β、IL-8、NFKBIA、PTGS2和TNF-α基因在品种之间的表达差异情况存在组织多样性(图4A,4B,4C)。
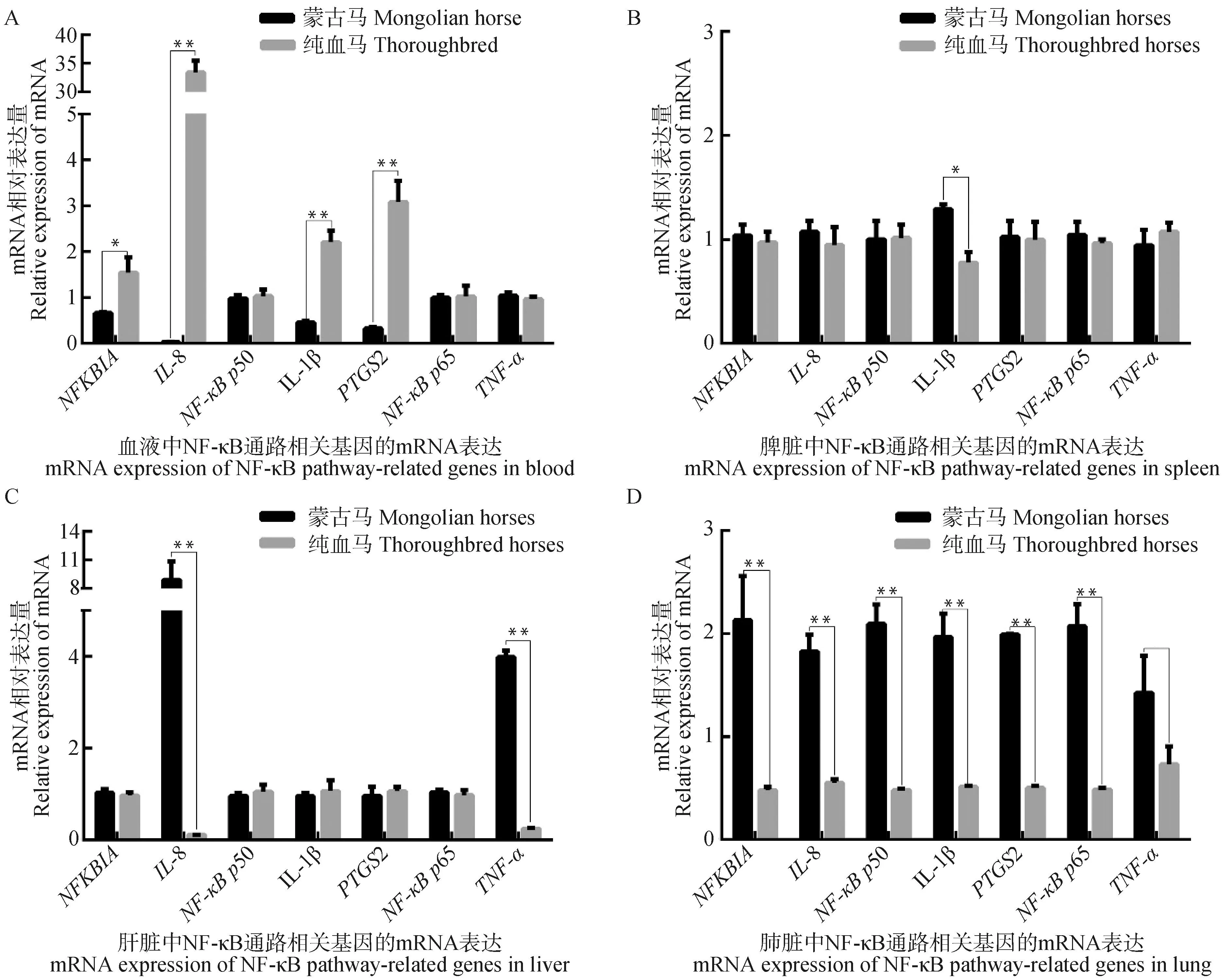
**.P<0.01,*. P<0.05。下同**.P<0.01,*. P<0.05. The same as below图4 血液(A)、脾脏(B)、肝脏(C)和肺脏(D)NF-κB信号通路相关基因的表达量Fig.4 mRNA expression of NF-κB pathway-related genes in blood (A), spleen (B), liver (C), and lung (D)
2.6 肺脏组织NF-κB通路相关基因蛋白水平表达分析
与纯血马相比,蒙古马不易患炎症性肺病。上述研究结果表明,NF-κB通路似乎影响蒙古马和纯血马肺部炎症易感性差异。以β-actin作为内参,开展Western blot试验进一步分析NF-κB信号通路关键基因NF-κB p65和下游基因IL-1β在肺脏中的蛋白相对表达量。如图5所示,蒙古马肺脏中NF-κB p65蛋白和IL-1β蛋白的表达量均高于纯血马(P<0.05)。
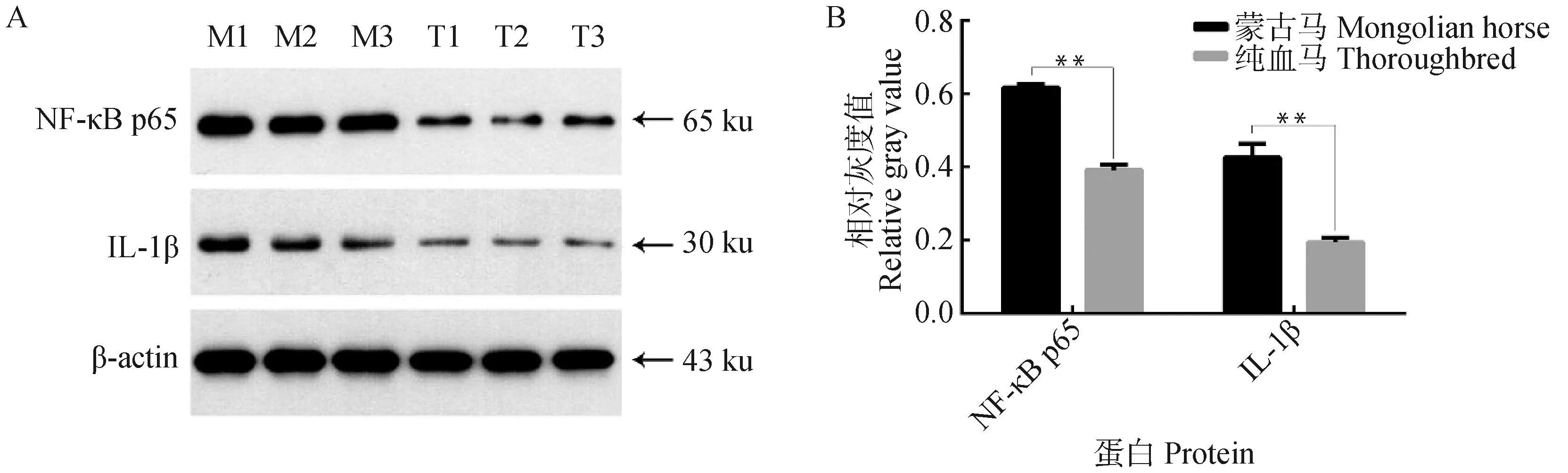
图5 蒙古马和纯血马肺脏组织中NF-κB p65和IL-1β蛋白表达Fig.5 Expression of NF-κB p65 and IL-1β proteins in lung of Mongolian horse and Thoroughbred
3 讨 论
研究表明,基因表达存在品种间差异[22-23]。蒙古马和纯血马血液转录组比较分析共发现了1 199个差异表达基因。随机选择10个差异表达基因进行qRT-PCR验证,结果显示和RNA-Seq趋势一致,说明RNA-Seq获得的差异基因数据可信。对差异表达基因进行聚类分析,结果显示明显聚为蒙古马和纯血马2个类,说明本研究试验样本的生物学可重复性。
动物的不同属、品种和个体之间存在抗病力的遗传差异[24]。血液的免疫功能主要是吞噬和分解外来病原体、自我衰老及死亡细胞和抵抗炎症。蒙古马和纯血马血液差异表达基因许多显着富集的通路在机体免疫过程中发挥关键作用,例如免疫反应途径、固有免疫反应途径和抗原加工和提呈途径。免疫反应是机体对异己成分做出的防御反应,包括固有免疫反应和适应性免疫反应。固有免疫反应是种系演化过程中形成的天然免疫防御功能,在机体受到病原体刺激后,主要通过特殊的模式识别受体(pattern recognition receptors, PRRs)识别病原体相关的分子模式(pathogen-associated molecular patterns, PAMPs)而识别入侵的病原体,后通过诱导炎性因子的分泌,抑制或清除病原菌[25]。核苷酸结合寡聚结构域1(nucleotide binding oligomerization domain 1, NOD1)是哺乳动物固有免疫系统的重要组成部分,是病原体和组织损伤产生的内源性分子的细胞内受体,被激活后通过信号转导途径介导各种效应器功能,发挥多种免疫调节作用和维持组织免疫稳态,当失调时会导致炎症性疾病[26]。ACOD1是重要的调控因子,在固有免疫和适应性免疫中发挥重要作用[27]。宿主细胞在感染病原体(如细菌和病毒)或受到病原体相关模式分子(如LPS)或细胞因子(如TNF和干扰素类,interferons, IFNs)刺激时,ACOD1基因高表达,进而参与机体应对细菌和病毒感染的免疫应答[28]。抗原加工和提呈途径的主要功能是将来自胞浆蛋白(自身和外来)的肽抗原加工并于细胞表面提呈给限制性T淋巴细胞,启动适应性免疫应答[29]。MHC I类分子(如MHCX1和EQMHCB2)主要与病毒蛋白等内源性肽抗原结合,激活CD8+ T细胞,使其转化为致敏细胞毒性T淋巴细胞(Cytotoxic T lymphocyte, CTL),发挥细胞毒作用杀伤靶细胞[30]。MHC II类分子(如DRA和DQB)主要与致病菌等外源性肽抗原结合,激活CD4+ T细胞,使其表达相应的淋巴因子,启动体液免疫,保护机体免受感染[31]。
血液中的白细胞、淋巴细胞、抗体等免疫细胞和免疫分子对病原微生物的入侵具有免疫作用。蒙古马和纯血马差异表达基因显着富集到抗细菌感染免疫反应过程,包括对细菌的反应、对细菌来源分子的反应、对LPS的反应、细胞对细菌来源分子的反应和toll样受体4信号通路负调控和趋化因子信号通路。Blanco等[32]对感染分枝杆菌(Mycobacterium)的牛(Bostaurus)外周血单核细胞进行表达谱分析,共获得172个和机体免疫炎症、细胞凋亡等过程相关的差异表达基因,并检测到分枝杆菌感染使CD14分子(CD14 molecule,CD14)、白细胞介素1受体 (interleukin 1 receptor type 1,IL-1R)、血小板凝血酶蛋白1 (thrombospondin 1,THBS1)和基质金属蛋白酶9 (matrix metallopeptidase 9,MMP9)等免疫基因在牛单核细胞中表达下调。LPS诱导仔猪(Susscrofa)外周血单核细胞, IL-1β和TNF-α炎症因子以及NF-κB p65 蛋白浓度显着上调(P<0.05)[33]。对瓦灰鸽(Columbidae)腹腔注射LPS后TNF-α表达上调,NF-κB信号通路激活[34]。趋化因子主要功能是募集白细胞在感染局部发挥抗感染作用和诱导局部炎症反应。例如,CCL5的主要功能是定向趋化和激活T 淋巴细胞和NK细胞[35],C-X-C基序趋化因子配体10 (C-X-C motif chemokine ligand 10, CXCL10)的主要功能是炎症趋化作用[36]。研究表明,刚地弓形虫症患者血液中CCL5 和 CXCL10 水平明显高于健康人群[37]。
蒙古马和纯血马血液差异表达基因还显着富集到了炎症反应相关过程,例如,炎症反应、急性炎症反应、炎症反应的调节和炎症反应的负调节。炎症反应的本质是机体对各种损伤性刺激的一种防御反应,具有杀灭病原体、限制感染及修复损伤等作用。当病原体入侵机体时,PRRs识别胞内PAMPs激活炎症反应信号通路,促使炎性因子如IL-1β和C-C基序趋化因子配体20(C-C motif chemokine ligand 20, CCL20)等释放以调控机体的免疫反应,进而发挥抗病毒作用[38]。例如,炎性因子IL-1β基因在患有炎症性气道疾病的马匹中高表达[5]。干扰素刺激基因IFIT家族(如,IFIT3和IFIT5)在免疫调节和抗病毒中发挥重要作用,是宿主抗病毒免疫分泌的标志性干扰素[39]。对小鼠体内和体外试验研究表明,IFIT3在抑制狂犬病病毒的复制和降低其致病性方面发挥重要作用[40]。炎症反应过程受到其他信号通路的调控,进而调控机体免疫应答的有序进行和维持自身稳态,例如,在病毒感染过程中,IFN信号通路与炎症反应调控网络中的关键分子(如 NF-κB p65)存在一定的交互作用,它们之间的交互调控失衡将会引起过度炎症反应,导致组织器官的免疫病理性损伤[41]。
NF-κB信号通路中的7个基因在蒙古马和纯血马4个免疫组织中均表达,但不同组织的品种间差异不同;血液中差异表达的qRT-PCR结果和RNA-Seq的趋势一致,进一步说明RNA-Seq数据的可靠性。不同的组织、生理条件、受体类型、激活的信号转导途径以及复杂的分子共同参与控制一个基因最终的表达。例如,研究表明IL-1β基因在不同组织中差异表达[42]。Li 等[43]对杜洛克猪不同组织中NF-κB基因的表达研究发现,在肺脏、脾脏、肝脏和小肠等免疫组织中相对高表达。NF-κBp50/NF-κBp65是NF-κB信号通路的核心基因,静息状态时,NF-κB p50/NF-κB p65异源二聚体与抑制蛋白结合定位于细胞质内,当抑制蛋白被降解,异源二聚体活化并释放进入细胞核,立即启动多种细胞因子基因(IL-1β和IL-8)的转录[13]。NF-κB p50与 NF-κB p65形成异源二聚体,故二者的表达趋势一致。本研究中,蒙古马肺脏NF-κBp50与NF-κBp65的表达量高于纯血马,蒙古马血液、脾脏和肝脏中NF-κBp50与NF-κBp65的表达量和纯血马之间无显着性差异。
NF-κB信号通路的7个基因在蒙古马肺脏中的表达量均高于纯血马,除TNF-α基因差异不显着外,其余基因均具有生物学统计意义。NF-κB p65蛋白和IL-1β蛋白在蒙古马肺脏中的表达也高于纯血马。这说明NF-κB信号通路在蒙古马肺脏的活性高于纯血马。Bureau等[44]通过比较健康马和受肺气肿影响的马支气管细胞中NF-κB活性,发现患肺气肿的马NF-κB活性处于高水平,但是健康马中NF-κB存在较少。Uhl等[45]发现,马驹接种马红球菌后,细胞核内NF-κB活性增加,同时细胞因子表达也明显增加。因此,马匹受到外界刺激后,NF-κB信号通路被激活,NF-κB活性增强,启动下游细胞因子(如,IL-8、TNF-α和IL-1β)等表达。本研究检测的NF-κB信号通路7个基因在蒙古马肺脏中表达量高于纯血马,这可能是由于内蒙古包头地区长期风沙较大,在该地区草原上放牧的蒙古马为了适应恶劣的风沙环境所致。本试验所用蒙古马均未患有肺部疾病,但肺脏NF-κB信号通路关键基因高表达是否起到预警的作用需要后续研究进一步论证。另外,本研究的结果是通过有限数量的试验样本获得,而且试验样品取样存在地域的局限性,研究结论的获得可能存在统计效能的不足。因此,在接下来的工作中,需要在更大样本量、更广泛自然栖息地采集样品和更深入试验研究开展的基础上来进一步验证以上结论。
4 结 论
本研究利用RNA-Seq方法对蒙古马和纯血马血液的表达谱进行了比较分析。结果表明,大量免疫相关基因在两个品种马的血液中差异表达,这可能是因为蒙古马适应内蒙古特定环境以及纯血马长期的闭锁繁育,导致两个品种的机体免疫功能发生了适应性变化。qRT-PCR 和 Western blot 方法比较了NF-κB 信号通路相关基因在蒙古马和纯血马免疫组织中的表达多样性。结果显示,7 个基因在蒙古马肺脏中的表达量均高于纯血马,这可能与蒙古马适应内蒙古包头地区风沙较大的环境有关。但是,本研究由于试验样本量有限和取样地域局限性的原因,得出以上试验结论可能存在统计效能的不足。本研究的结果为接下来在更大样本量、更广泛自然栖息地等的条件下研究蒙古马的免疫功能提供了一些信息。



