牛乃琪,赵润泽,宗文成,刘先策,刘 海,石国华,井西涛*,张龙超*
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.北京黑六牧业科技有限公司,北京 102211)
脊椎动物的脊椎经历复杂而有序的发育过程,通过体节发育形成。而轴向骨骼是脊椎动物体内体节发育的典型。主要分为颈部、躯干和尾部,躯干主要由脊椎和肋骨组成[1-3]。这些都源自一个重复的组织结构——体节。体节是受分割时钟控制(分割时钟会产生一系列周期性的信号,这些信号会逐渐扩散和传播到胚胎中不同部位的细胞。这些信号会调控细胞的基因表达和细胞分化),在脊索两侧按顺序成对形成的中胚层组织块状结构,是脊椎轴向骨骼形成必不可少的瞬时元件[4-5]。体节在机体发育中发挥着重要的作用,受到多种信号通路和转录因子(Notch、FGF、Wnt、RA、BMP、Hox、brachyury (T) 和Tbx6)相互作用的网络调控[6-10],信号分子必须在正确的位置和正确的时间以恰当的方式分布在胚胎中,调控不同的细胞命运和协调模式。体节的形成是动物胚胎发育的一个组成部分,它是脊椎动物轴向骨骼正确形成的基础元件,轴向骨骼是脊椎动物脊柱的基础。最终形成具有复杂特征的枕骨、颈椎、胸椎、腰椎、荐椎和尾椎[11-12]。每个域中的椎骨数量在物种内是固定的,在物种之间各不相同,从而产生了物种特定的轴向公式[13]。而猪是为数不多的胸腰椎数可变的经济动物之一[14]。研究表明猪胸腰椎数每增加一节,会使其胴体长增加80 mm[15],胴体重[16]也会随之增加。
由于猪的肋骨数有着重要的经济价值,因此,对于肋骨数的研究也持续了很多年,筛选到了一些候选基因,如:VRTN、NR6A1、PROX2、LTBP2、Hoxc8、PLAG1、LCORL基因等。而前期本团队基于北京黑猪群体,通过GWAS在猪6号染色体(SSC6)上筛选到了与肋骨数相关的两个基因GREB1L和MIB1[17]。而北京黑猪(Beijing black pig)是中国典型的复合型黑猪品种,是1960年代由巴克夏、大白和中国地方猪种杂交形成的一个培育猪种[18],它完美地结合了中国地方猪品种肉质优良、抗病能力强、繁殖性能好等特点和商品猪品种生长速度快、瘦肉率高、饲料转化率高等特点。在北方猪肉市场中占有重要地位,但是北京黑猪在GREB1L和MIB1基因的多态性与性状的关联分析尚未见报道。本研究对GREB1L和MIB1基因所有外显子区进行PCR及测序检测突变位点并将其与表型进行关联分析,以期探索影响性状变异的候选基因功能位点,为性状变异遗传机理的阐释奠定基础。
1 材料与方法
1.1 试验群体
本试验收集317头北京黑猪个体,均饲养在北京黑六牧业科技有限公司,饲养过程和管理方式均一致,在猪饲养至215日龄时,健康状况均良好。将317头猪提前运输至北京二商集团有限责任公司进行屠宰,在屠宰中记录耳号并采集耳组织样本,同时一一对应并记录肋骨数和胴体性状(胴体重、胴体长[19]、胴体斜长和胴体直长[20-21])。
1.2 DNA提取及检测
本试验使用QIAamp DNA Mini Kit试剂盒的提取步骤进行耳组织样品DNA提取,使用IMPLEN超微量分光光度计进行DNA浓度检测(ng·μL-1),同时用2%琼脂糖凝胶进行DNA质量检测,检测合格的DNA样品以备后期突变位点筛选试验的使用。
1.3 引物设计及合成
本试验的引物均使用Primer Premier 5.0软件设计,使用Ensembl数据库中Sscrofa11.1参考基因组,引物序列均由北京六合华大基因科技有限公司合成。本研究设计了2个基因GREB1L(ENSSSC-G00000003699)、MIB1 (ENSSSCG00000025478),共64对引物,其中在本群体中检测到SNPs的5对引物见表1。
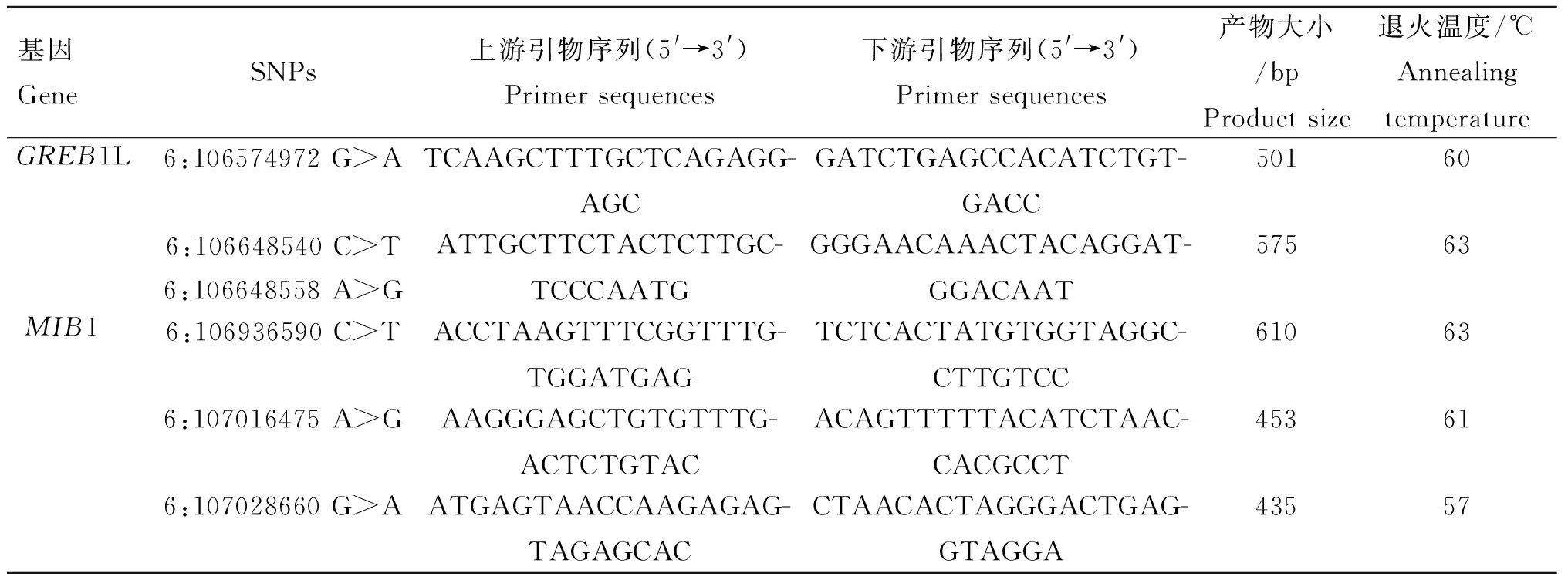
表1 引物信息Table 1 Information of primers
1.4 聚合酶链式反应(PCR)
本试验使用诺唯赞(Code: P505-d1,Vazyme)的高保真酶进行PCR,本试验对317头北京黑猪个体采用25 μL反应体系(2×Phanta Max Buffer 12.5 μL,0.5 μL 聚合酶,0.5 μL dNTP,1 μL 上游引物,1 μL 下游引物,8.5 μL 无菌水,1 μL 模板)进行PCR(ABI, Singapore),程序如下:95 ℃预变性5 min;95 ℃变性30 s,57~63 ℃退火30 s,72 ℃延伸45~60 s,35个循环;72 ℃延伸2 min。PCR产物通过切胶回收单一条带在北京六合华大基因科技有限公司平台进行双向Sanger测序。
1.5 基因分型及数据统计分析
本试验使用DNAStar中的SeqMan进行测序结果的比对和基因分型,使用Microsoft Excel 2016将分型后的结果进行基因型频率、等位基因频率的统计。将分型的结果进行基因型和表型个体间的一一对应,并使用SAS软件中的Duncan’s多重检验进行关联分析(P<0.05),动物模型:Y=μ+基因型+e,其中Y为表型值,μ为均值,e为随机误差。数据结果使用“平均值±标准误”表示,P<0.05判定为差异显着。
2 结 果
2.1 北京黑猪肋骨数和胴体性状的表型统计
317头北京黑猪个体的表型值(肋骨数和胴体性状)见表2,肋骨数的均值为14.88节,变异系数为3.56%(变异系数=标准差/均值);胴体长的均值为98.28 cm,变异系数为4.84%;胴体直长的均值为90.11 cm,变异系数为4.45%;胴体斜长的均值为76.24 cm,变异系数为4.30%;胴体重的均值为64.30 kg,变异系数为11.35%。
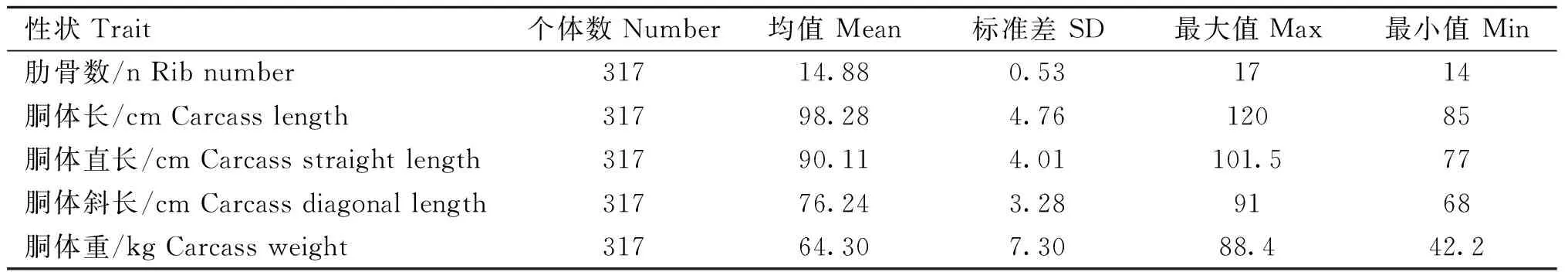
表2 肋骨数和胴体性状的表型值统计Table 2 Statistics of phenotypic values of the rib number and carcass traits
2.2 北京黑猪GREB1L和MIB1基因的多态性检测及基因型频率和等位基因频率分析
本试验通过对GREB1L和MIB1基因的mRNA序列进行变异位点检测共发现6个SNPs(表3),在GREB1L基因中检测到3个外显子区的突变且均为同义突变,MIB1基因中也检测到3个突变,其中2个是同义突变,1个是离外显子15仅有4 bp之隔的一个内含子区的可变剪切突变(表3)。这6个突变位点的等位基因频率变化范围为5%~95%,其基因型频率变化范围为1%~90%。
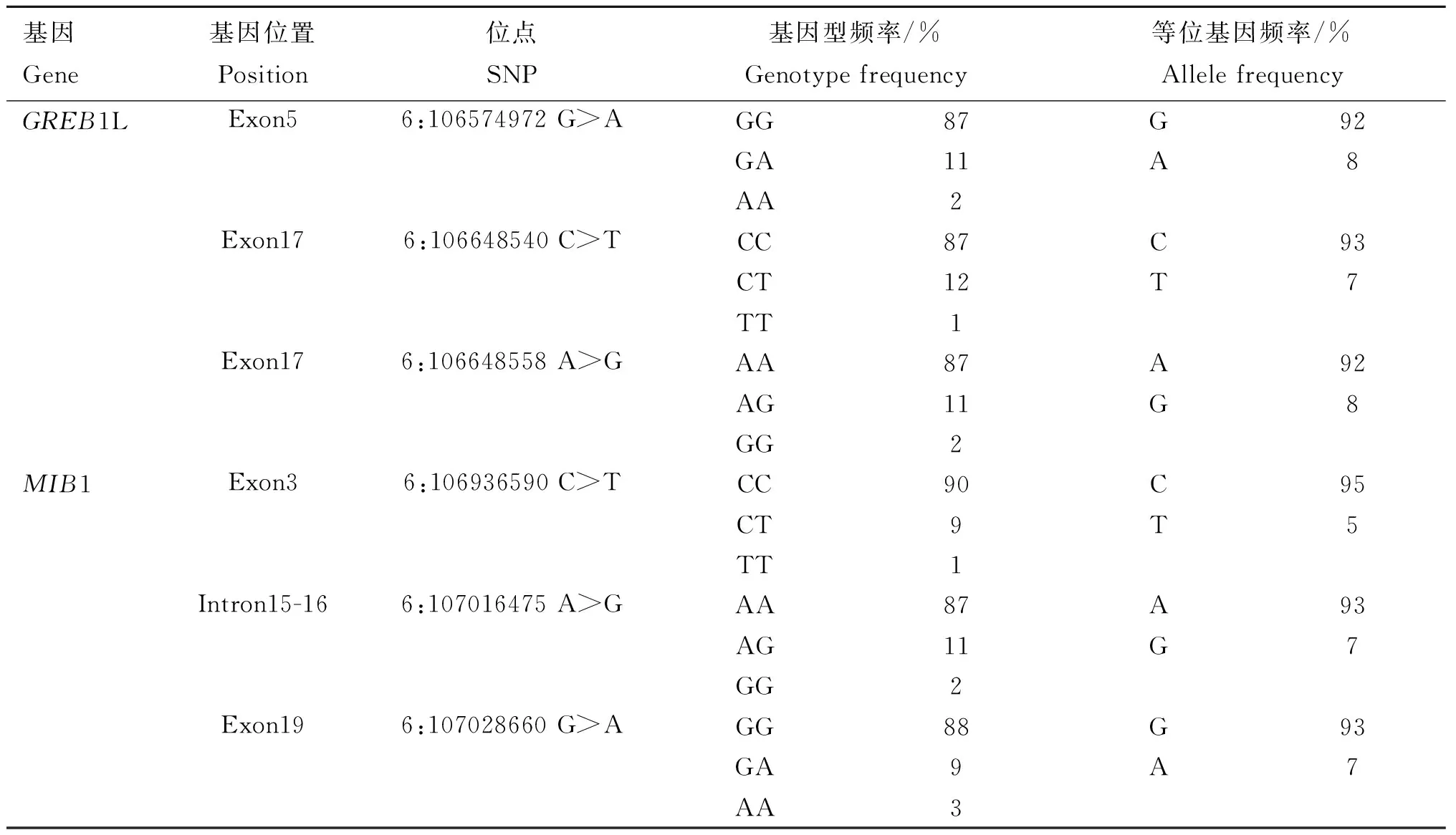
表3 北京黑猪中GREB1L和MIB1的基因型频率及等位基因频率统计Table 3 Statistics of genotype and allele frequencies of GREB1L and MIB1 in Beijing black pigs
2.3 北京黑猪GREB1L和MIB1基因的6个SNPs与肋骨数和胴体性状的关联分析
本试验将GREB1L和MIB1基因通过PCR扩增及变异检测筛选到6个SNPs,它们与肋骨数和胴体性状的关联分析结果见表4。GREB1L基因上的3个同义突变6∶106574972 G>A、6∶106648540 C>T、6∶106648558 A>G与性状关联均不显着;MIB1基因上的1个同义突变6∶106936590 C>T与胴体长显着相关,其中TT基因型个体的胴体长表现出明显优势,与其他性状关联均不显着;而内含子15~16的6∶107016475 A>G可变剪切突变与肋骨数显着相关,且AA型个体的肋骨数表现出明显优势,与其他性状均无显着关联;第三个同义突变6∶107028660 G>A与肋骨数和胴体性状均无显着相关。
3 讨 论
我国作为养猪业和猪肉消费大国,猪一直是畜禽遗传研究者关注和研究的重要畜种之一,并且猪是一个与人类相似性较高,容易获得的优选模型。猪的脊椎包括颈椎、胸椎、腰椎、荐椎及尾椎共五部分,通常颈椎数为7节,荐椎数为4节,然而胸椎和腰椎总数存在极大的变异。猪肋骨数的变异与胴体长和产肉量之间存在关联。具有偏多肋骨数的个体往往具有较大的体型和较高的产肉性能。然而,传统育种方法很难改善猪的肋骨数。因此,分子标记辅助选择成为一种有潜力的方法,可以通过分析个体的遗传组成来选育具有期望肋骨数的猪种。这种方法可以快速、准确地提高猪种的肋骨数,从而在养猪生产中带来重大的经济效益。猪的肋骨数是一个高遗传力的表型性状,一般遗传力估计为0.60~0.62[22]。研究者最先采用全基因组扫描方法对梅山母猪与杜洛克公猪的F2群体的180个微卫星进行研究,最终将影响猪脊椎数变异的QTL定位在猪1号(SSC1)和7号染色体(SSC7)上[23]。后来在SSC7上发现了与椎脊椎发育相关的基因,被称为vertnin (VRTN)[24],它被认为是与椎骨数变化相关的候选基因,且在脊椎形成过程中是一个关键的转录因子[25]。在SSC1上,Mikawa等[26]发现生殖细胞核因子(NR6A1)c.748C>T发生碱基替换,导致了192位密码子脯氨酸被取代为亮氨酸,并将其作为影响椎骨数变异的候选基因。本团队对猪胸腰椎数和胸椎数(肋骨数)也展开了大量的研究,先后在SSC7[27],SSC12[28]和SSC6[17]均发现了与其变异显着相关的候选基因和QTL。
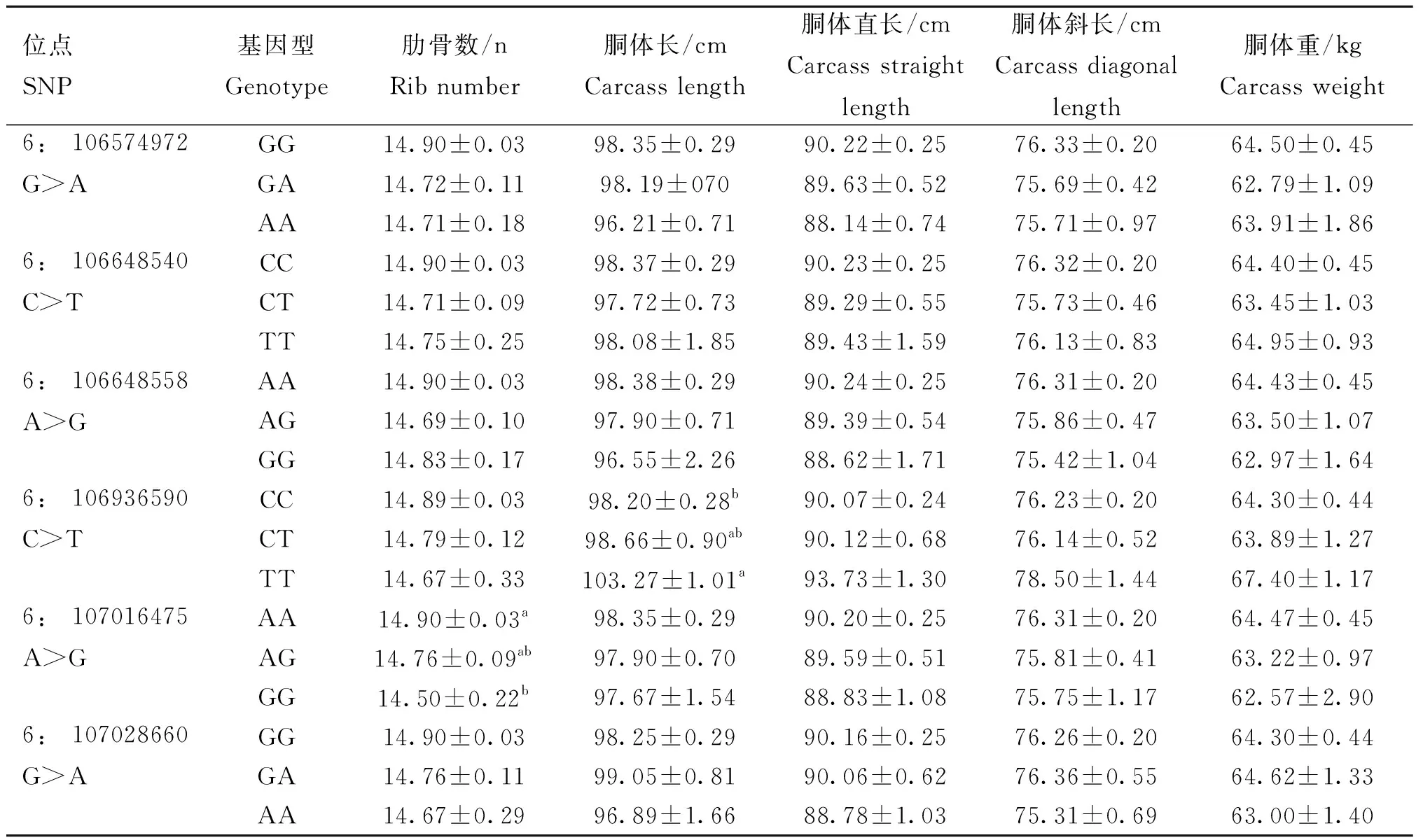
表4 GREB1L和MIB1基因6个SNPs与肋骨数和胴体性状的关联分析Table 4 Association of 6 SNPs of GREB1L and MIB1 genes with rib number and carcass traits
GREB1L基因是GREB1(生长调节雌激素受体结合1)的重要旁系同源物,在胚胎后肾和生殖器发育中起主要作用,并已被报道为维甲酸(RA)信号传导的靶点。之前的研究表明,GREB1L基因与双侧肾发育不全、内耳畸形和耳聋有关[29-31]。并与RA(维甲酸)信号通路[30]和Wnt信号通路[32]相关。在脊椎动物胚胎的近轴中胚层内,RA、Wnt和FGF信号通路的活性呈现分级分布。具体而言,Wnt和FGF信号在后部未分段的近轴中胚层中显示出最高的活性。而RA信号则在体节中建立了具有最高活性的反梯度作用。这意味着在胚胎发育过程中,这些信号的活性在近轴中胚层内呈现一定的空间分布模式,其中Wnt和FGF信号在胚胎的后部未分段区域活跃,而RA信号在体节区域活跃,并且其活性随着体节的增加而逐渐增强。这些信号的相互作用和调控有助于体节的形成,体节在脊椎动物形成脊椎的过程中起着重要作用[33]。虽然GREB1L基因在猪肋骨数变异方面的研究还相对较少,但是基于其在胚胎发育中的重要作用,可以将其定义为候选基因。进一步的研究可以帮助验证GREB1L基因在猪肋骨数变异中的确切作用机制。
MIB1是MIB E3泛素蛋白连接酶1,是一种大的多结构域环状 E3连接酶[34]。MIB被认为是Notch发育的重要调节因子[35]。MIB1 在 Notch 信号通路中的激活作用十分广泛,可以直接与各种 Notch配体(jagged 1、jagged 2、Dll1、Dll3 和 Dll4)结合促进 Notch 配体泛素化和内吞作用[36]。在MIB1 敲除小鼠中,Notch 信号通路相应表现出缺陷,Notch 信号减少,表现为 Notch 活性形式 Notch 胞内结构域(NICD)的生成受到抑制、下游靶基因表达降低以及体节发生、心脏发生等受损[36]。在斑马鱼中,MIB1 突变体也表现出类似的现象[37]。除此之外,MIB1 在 Wnt 信号通路中也发挥重要作用,主要是通过与 RYK 结合形成复合物来激活Wnt/β-catenin 信号通路[38]。之后有研究显示,MIB1 还与 Wnt 通路中的其他成分 Catenin 家族成员(α、β、delta1 和 delta2)、几个 MAP/微管亲和力调节激酶(Mark1、Mark 3和Mark 4)和酪蛋白激酶家族成员等存在相互作用。MIB1 在 Notch 信号通路和 Wnt 信号通路之间的潜在连接因子是内吞作用[39]。因此,将MIB1基因定义为候选基因,但还需进一步验证它的作用机制。
对于本试验的GREB1L和MIB1基因也在别的方向上进行了多态性的探索与研究。GREB1L基因作为一个与肾发育相关的基因,它的突变会引起肾发育不良。研究发现GREB1L基因的一个错义突变c.4507C>T会导致患者单侧缺肾[40]。研究发现,MIB1基因变异与左心室心肌致密化不全相关,但携带MIB1基因中c.376C>T变异的患者s31表现为典型的左心室心律失常性心肌病,伴有广泛的纤维-脂肪替代左心室游离壁,左心室增大但无小梁形成[41-42]。本试验主要是对两个基因的多态性进行探索,在群体中未发现GREB1L基因中突变位点与性状的显着相关。MIB1基因外显子3中的同义突变6∶106936590 C>T位点与胴体长性状显着相关;在内含子15~16的6∶107016475 A>G可变剪切突变与肋骨数显着相关。但是,在位点鉴定方面的结果还需要进一步进行试验验证。虽然本研究已经进行了严格的数据分析和统计处理,但为了确保研究结果的准确性和可靠性,需要进行更多的试验验证,以确认所鉴定的显着位点在肋骨数和胴体性状中的真实功能和作用机制。
4 结 论
在北京黑猪群体中,MIB1基因上的6∶106936590 C>T位点与胴体长性状显着相关,内含子15~16的6∶107016475 A>G可变剪切突变与肋骨数显着相关。这两个位点对于猪肋骨数和胴体长性状的分子标记辅助选育工作提供了基础。



