张德安,杨若渚,刘 杰,刘德武,2,3,邓 铭,柳广斌,2,3,孙宝丽,2,3,郭勇庆,2,3, 李耀坤,2,3*
(1.华南农业大学动物科学学院,广州 510642;2.华南农业大学畜禽育种国家地方联合工程研究中心,广州 510642;3.华南农业大学广东省农业动物基因组学与分子育种重点实验室,广州 510642)
目前,我国集约化养殖规模越来越大,饲料原料不足导致我国畜牧业发展受阻,所以优质新型青绿饲料的发掘仍是目前畜牧业着力发展的方向[1]。黄梁木又称团花,隶属于茜草科(Rubiaceae)团花属(Neolamarckia),常绿大乔木[2],主要分布于我国广东、广西和云南南部以及越南、缅甸等地[3],其生长迅速,木质黄白色,通直圆满,纹理均匀[4],在水肥管理良好的情况下,1.5年生幼黄梁木平均横径可达12 cm,是罕见的速生型用材树种[5]。黄梁木一般用于制作木质包装箱、建筑材料、工业材料,也是优良的园林绿化、蜜源、饲料和药材树种,同时,黄梁木也具有一定的药物作用,黄粱木提取物中含有多种活性成分,包括生物碱、皂苷、类黄酮、烯萜、类固醇等,具有抗菌消炎、抗病毒[6-8]和抗氧化[9]的作用。在印度,黄粱木是广泛用于治疗眼部感染、皮肤病、口腔炎、咳嗽、发烧、血液病和胃痛等病症的一种药物[9-10]。目前,利用黄粱木作为药物治疗和材料的用途较多,但是使用黄粱木作为饲料原料的应用较少,且有研究表明,青贮黄梁木pH较低,粗蛋白质含量较高,是良好的青贮饲料[3]。
本试验选择着名地方品种川中黑山羊作为试验动物,研究青贮黄梁木在川中黑山羊中的饲用效果。川中黑山羊主要分布于四川省金堂县、乐至县,是以产肉为主的山羊地方品种,具有生长发育快、体格高大、繁殖性能突出、产肉性能优良、遗传性能稳定等特点,是国内目前繁殖性能和产肉性能最好的山羊品种之一[11]。肝是脊椎动物身体内以代谢功能为主的一个器官,与动物机体生长有着密切联系,在体内糖代谢、脂类代谢、蛋白质代谢、维生素代谢、激素代谢等方面发挥重要作用[12];也是许多生理过程的关键枢纽,这些生理过程包括血量调节、免疫系统支持、生长信号通路的内分泌控制、脂质和胆固醇稳态以及许多现有药物在内的异种化合物的分解[13]。
目前国内对黄粱木的研究主要集中在禽类和羊的饲养试验上。有研究表明,饲粮添加5%黄梁木叶对麻黄鸡具有降血糖和降血脂的作用,同时在一定程度上能够促进小肠的形态发育[14]。本课题组前期研究发现,青贮黄粱木替代50%的青贮玉米能有效提高乐至黑山羊的生长性能、屠宰性能和羊肉品质,饲喂青贮黄粱木组平均日采食量随替代量的增加极显着提高,平均日增重也随替代比例的增加而增加, 但不同比例替代组间无显着差异;50%青贮黄梁木替代组显着降低了乐至黑山羊羊肉的失水率与料肉比,极显着降低了羊肉中苯丙氨酸的含量;显着提高了育肥期乐至黑山羊的肩宽、眼肌面积,显着提高了羊肉中苏氨酸和赖氨酸的含量[15]。本课题组前期采用青贮黄梁木替代青贮玉米,分析了川中黑山羊肝组织代谢谱,筛选得到8种差异代谢产物,发现相关的如脂肪酸生物合成、甘油脂代谢和脂肪酸代谢等的9个代谢项和8条代谢途径,推测青贮黄梁木通过调控脂肪代谢的相关通路来发挥生物学功能[16]。
转录组是样本的全部基因表达的转录本信息[17],随着转录组测序技术的发展,许多基因组上虽然编码蛋白质的序列只占1%左右,但基因组中70%以上的区域都可以在特定条件下转录成RNA,这些不能编码蛋白质的RNA统称为非编码RNA,包括长链非编码RNA(long noncoding RNA, lncRNA)等[17]。本研究在前期饲养试验的基础上,将试验组与对照组的肝转录组测序结果进行比较,挖掘饲喂青贮黄梁木影响川中黑山羊肝代谢的关键候选基因,可以研究出饲喂青贮黄粱木对肝功能的影响,从而探究饲喂青贮黄粱木代替青贮玉米影响川中黑山羊的生长性能的分子机制。
1 材料与方法
1.1 试验动物分组与基础日粮测定
试验分为三组分别为对照组、青贮黄粱木替代25%青贮玉米组与青贮黄粱木替代50%青贮玉米组,本试验筛选差异表达显着的青贮黄粱木替代50%青贮玉米组与对照组进行以下分析。该两组各随机选择体重为(21.07±4.05)kg的5月龄健康的乐至型川中黑山羊公羊3只,分别命名为SACRL试验组和SCL对照组,SACRL试验组为青贮黄粱木替代50%青贮玉米组;SCL对照组为青贮玉米组。10 d预饲期,40 d正式试验期,根据NRC(1981)和中国羊饲养标准(2004)配制川中黑山羊的基础日粮。饲养于高床漏缝式木地板的半开放式羊舍,自由采食饮水、充足光照、定期消毒通风、打扫栏舍。试验基础日粮组成和营养水平测定值见表1。
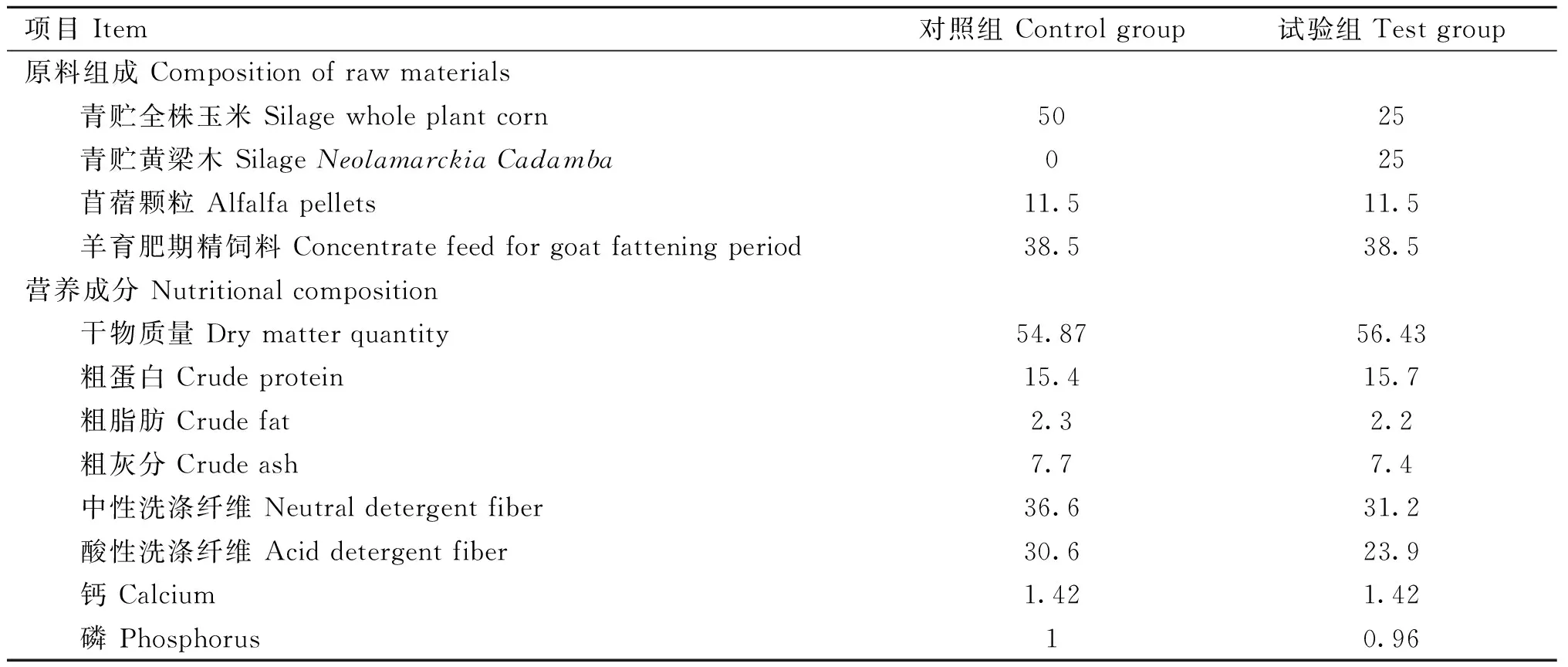
表1 试验川中黑山羊各组日粮组成及营养水平测定值(风干基础)Table 1 Determination of dietary composition and nutrient levels of each group of Chuanzhong Black Goat in the experiment (air dried basis) %
1.2 试验材料
黄梁木新鲜枝叶采集自华南农业大学增城林业基地,当植株高于3 m时刈割,留茬70 cm,去除木质化较高枝干,保留嫩枝和树叶,粉碎至每段1 cm左右,通过拉伸膜裹包青贮技术制作成(30.00±5.00)kg青贮包,常温下室内避光青贮60 d。青贮黄梁木和青贮全株玉米营养水平测定值见表2。
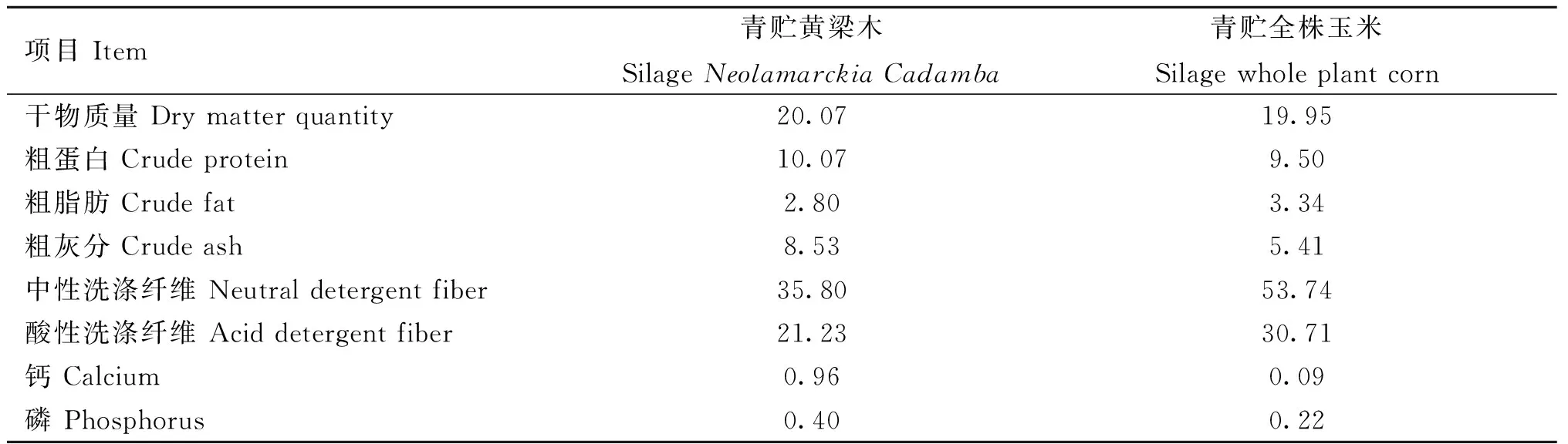
表2 青贮黄梁木和青贮全株玉米营养水平测定值(风干基础)Table 2 Determination of nutrient levels of silage Neolamarckia Cadamba and silage whole plant maize (air-dried basis) %
1.3 样品采集
根据GB/T 19477—2018所述的畜禽屠宰操作规程进行屠宰后,迅速采集肝组织样品于冻存管中,而后立刻放置于液氮冷冻,样品于-80 ℃冰箱内长期保存。
1.4 总RNA提取和建库
使用TRIzol(Thermo Fisher,上海,中国)提取组织样品中的总RNA,而后使用Agilent 2100生物分析仪和RNA 6000 Nano LabChip Kit(Agilent, Santa Clara, USA)测定RNA总量及完整性。在构建RNA测序文库前,使用Epicentre Ribo-ZeroTM(Epicentre,美国)试剂盒去除rRNA,而后将产物进行逆转录以获得cDNA文库,该文库用于mRNA及lncRNA的测序。选择符合建库标准的 RNA 并送至北京诺禾致源科技股份有限公司测序,委托该公司对测序结果进行分析。每个样品分别取1 μg总 RNA 作为文库构建,根据 NEB Next Ultra Directional RNA Library Prep Kit for Illumina(NEB,Ispawich,USA)的操作步骤,将不同的 index 进行分别标签建库。
1.5 数据质控与组装
测序得到的原始测序序列,里面含有带接头的、低质量的reads,为了保证信息分析质量,必须对raw reads进行过滤,得到clean reads,后续分析都基于clean reads。数据处理的步骤如下:1)去除带接头(adapter)的reads;2)去除N(N表示无法确定碱基信息)的比例大于10%的reads;3)去除低质量reads(质量值sQ≤5 的碱基数占整个 read 的 50%以上的 reads)。
1.6 lncRNA的筛选
在进行筛选之前,首先使用 Cuffmerge 软件,对各样品拼接得到的转录本进行合并,并去掉其中链方向不确定的转录本,得到本次测序完整的转录组信息。筛选过程分以下5个步骤:1)转录本exon个数筛选:过滤转录组拼接结果中大量低表达量、低可信度的单外显子转录本,选择exon个数≥ 2的转录本;2)转录本长度筛选:选择转录本长度>200 bp的转录本;3)转录本已知注释筛选:通过 Cuffcompare 软件,筛除与数据库注释 exon 区域有重叠的转录本,并将数据库中,与本次拼接转录本 exon 区域有重叠的 lncRNA 作为数据库注释 lncRNA纳入到后续分析;4)转录本表达量筛选:通过Cuffquant计算每个转录本的表达量,选择 FPKM ≥ 0.5的转录本;5)编码潜能筛选:使用CNCI、CPC、Pfam Scan和PhyloCSF对转录本进行编码潜能性分析。
1.7 mRNA和lncRNA差异表达分析
采用 DESeq2对川中黑山羊肝组织的lncRNA和mRNA进行差异表达分析,筛选差异表达基因条件为:显着性P<0.05。
1.8 lncRNA靶基因预测
位置相关性靶基因分析,根据lncRNA与mRNA的位置关系进行顺式调控靶基因预测,筛选的范围为100 K以内。
1.9 GO和KEGG功能富集分析
本研究所有富集分析均采用以下方法进行。使用top GO进行基因本体论(Gene Ontology,GO)富集分析,通过超几何分布方法计算显着富集的GO term(显着富集的标准为P<0.05)。使用cluster Profiler软件进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,重点关注P<0.05的通路。
1.10 RT-qPCR 验证分析
从差异表达lncRNA和mRNA中各随机选择3个基因,使用RT-qPCR进行转录组表达谱验证分析。反应体系20 μL:10 μL SYBR® Green Master Mix,上下游引物各0.5 μL,1 μL cDNA 和8 μL ddH2O。95 ℃预变性10 min;95 ℃变性5 s,60 ℃退火20 s,72 ℃延伸1 min,共40个循环。引物设计参考NCBI 的山羊(Carpahircus)相关基因序列,β-actin作为lncRNA和mRNA的内参基因,使用Primer 5.0软件设计,并送生工生物工程(上海)股份有限公司合成引物(表3)。

表3 引物序列Table 3 Primer sequences
2 结 果
2.1 测序数据的质量及比对信息
本试验测序共获得566 416 000个reads,去除接头以及低质量reads后,获得547 779 978个高质量有效reads。有效reads占原始序列reads的87.20%±0.49%。测序的质量分值(Q30)均在90%以上。各个样本测序概况如表4所示。
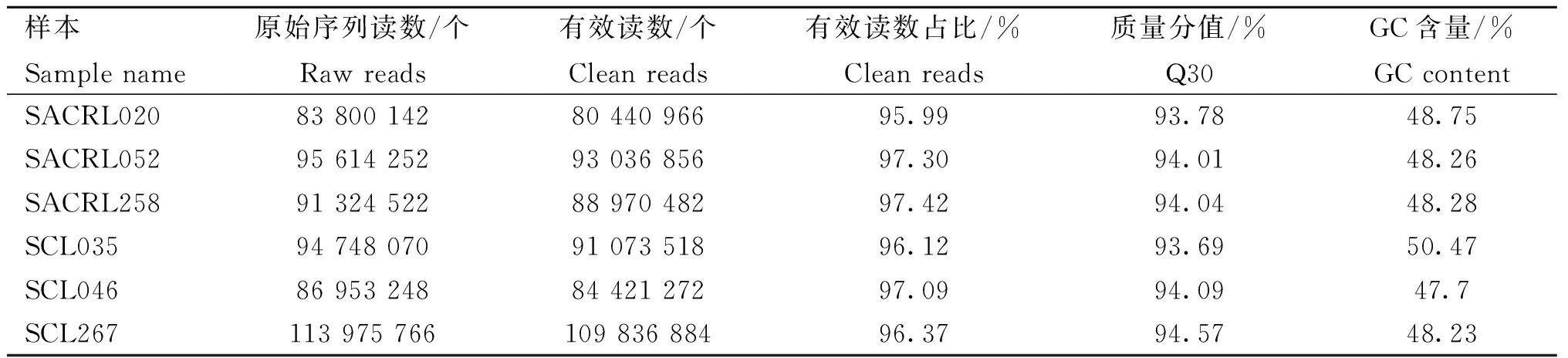
表4 试验组与对照组肝组织RNA测序概况Table 4 Overview of liver RNA sequencing in the test and control groups
2.2 mRNA表达分析
图1展示的结果为试验组与对照组肝组织样品中mRNA表达的概况。测序并分析发现有43 779个mRNA可以比对到参考基因组并被注释。使用DEseq软件进行差异表达分析,共有1 696个mRNA在试验组与对照组肝组织样品中的mRNA存在显着差异。以饲喂青贮玉米的对照组的mRNA为对照,943个mRNA表达上调,753个mRNA表达下调,分别占总差异表达mRNA的55.6%和44.4%。
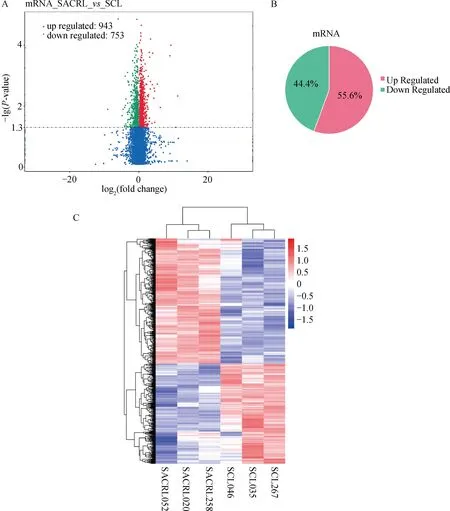
A.差异表达mRNA火山图,横坐标代表差异mRNA在不同样本中表达倍数变化,纵坐标代表mRNA变化差异的统计学显着性,红色点表示有显着性差异表达的上调mRNA,蓝色点表示有显着性差异表达的下调mRNA;B.差异显着的上、下调mRNA所占总差异表达mRNA的比例;C.差异表达mRNA表达量层次聚类图,红色表示mRNA表达上调,蓝色表示mRNA表达下调 A. Volcanic map of differentially expressed mRNA, with the horizontal axis representing the changes in expression multiples of differential mRNA in different samples, the vertical axis representing the statistical significance of mRNA changes, the red dot representing upregulated mRNA with significant differential expression, and the blue dot representing downregulated mRNA with significant differential expression; B. Proportion of significantly different up-regulated and down-regulated mRNA to the total differentially expressed mRNA; C.Hierarchical clustering diagram of differentially expressed mRNA expression levels, with red indicating upregulation of mRNA expression and blue indicating downregulation of mRNA expression图1 试验组与对照组肝组织差异表达mRNA概况Fig.1 Profile of differentially expressed mRNA in liver tissues of the test and control groups
2.3 lncRNA表达分析
试验组与对照组肝组织样品所测得的lncRNA共有8 903个,使用Deseq软件进行差异表达分析,共获得33个差异表达lncRNA(Differential Expressed lncRNA, DE lncRNA)。如图2所示,以饲喂青贮玉米的对照组肝组织的lncRNA作为对照,上调表达的lncRNA共22个,占总DE lncRNA的66.7%;下调表达的lncRNA共11个,占总DE lncRNA的33.3%。

A.差异表达lncRNA的火山图,横坐标代表差异lncRNA在不同样本中表达倍数变化,纵坐标代表lncRNA变化差异的统计学显着性,红色点表示有显着性差异表达的上调lncRNA,蓝色点表示有显着性差异表达的下调lncRNA;B.上、下调lncRNA所占总差异表达lncRNA的比例;C.差异表达lncRNA表达量层次聚类图,红色表示lncRNA表达上调,蓝色表示lncRNA表达下调 A.Volcanic map of differentially expressed lncRNA. The horizontal axis represents the change in expression multiples of differential lncRNA in different samples, the vertical axis represents the statistical significance of the difference in lncRNA changes, the red dot represents upregulated lncRNA with significant differential expression, and the blue dot represents downregulated lncRNA with significant differential expression; B. Proportion of up-regulated and down-regulated lncRNAs in the total differentially expressed lncRNAs; C. Hierarchical clustering diagram of differential lncRNA expression levels, with red indicating upregulation of lncRNA expression and blue indicating downregulation of lncRNA expression图2 试验组与对照组肝组织差异表达lncRNA概况Fig.2 Profile of differentially expressed lncRNA in liver tissues of the test and control groups
2.4 mRNA的功能聚类分析
为进一步了解差异表达的mRNA对川中黑山羊肝功能的调节作用,对显着差异表达的1 696个mRNA进行GO功能注释和KEGG信号通路富集分析。对所有显着差异表达mRNA进行GO功能注释,发现这些差异表达的mRNA被注释到2 631个GO term中。对这些GO term进行显着性分析,发现有33个GO term能被显着富集(P<0.05),其中包括4个生物过程(Biological process,BP)、18个细胞组成(Cellular component,CC)、11个分子功能(molecular function,MF)。图3A列出了试验组和对照组显着富集到的33个GO term,根据GO富集结果进行筛选,选择与肝功能相关的GO term,涉及生物过程的主要的有代谢过程(metabolic process)等;涉及细胞组成的主要有细胞(cell)、细胞组分(cell part)和细胞内(intracellular)等;涉及分子功能的主要有催化活性(catalytic activity)等。基于KEGG数据库的通路富集分析,对显着差异的mRNA进行富集得到20个通路,图3B列出了试验组和对照组显着差异的20个富集通路(P<0.05),主要富集的与肝功能相关的通路有代谢途径(metabolic pathways)等。
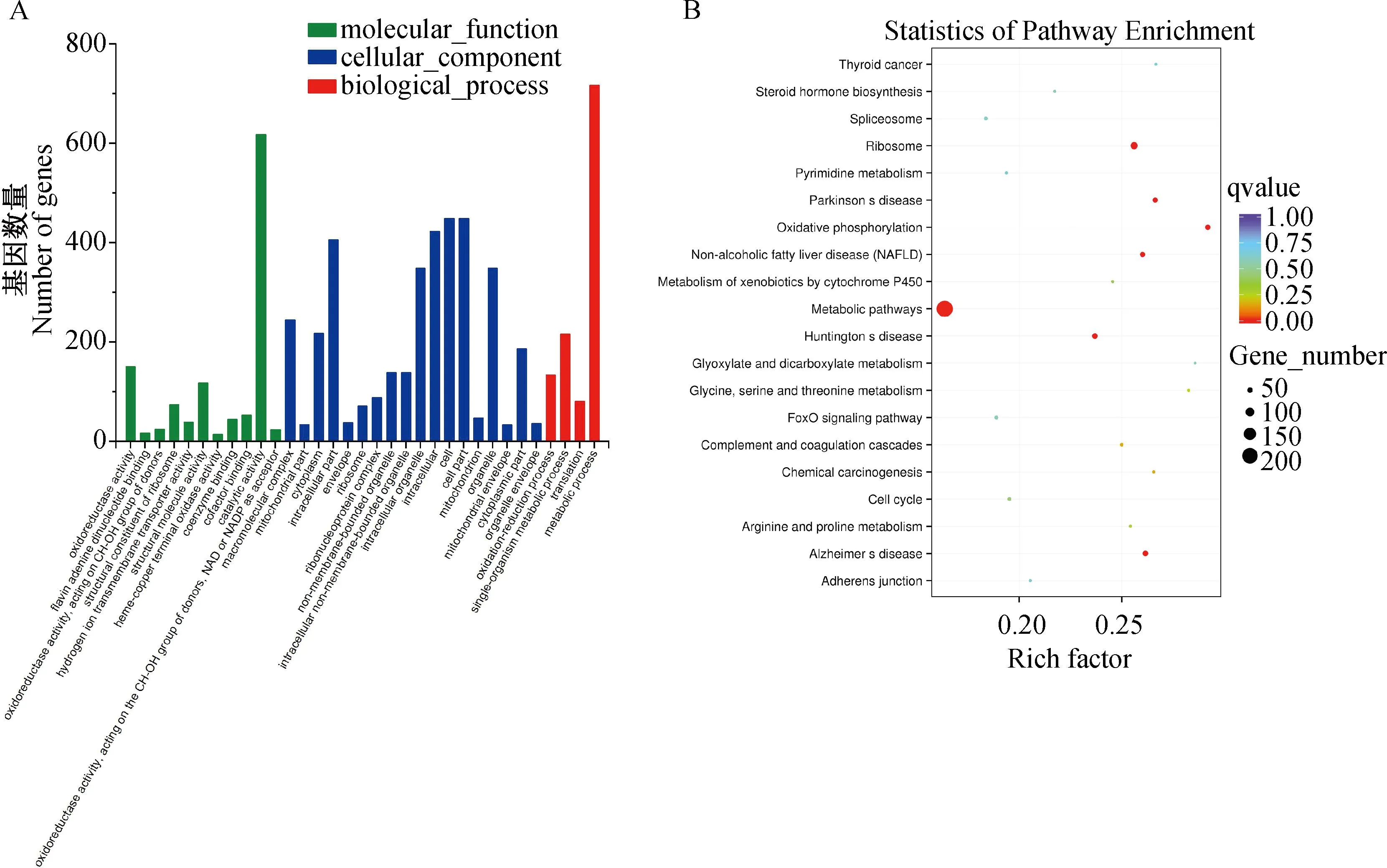
图3 差异表达mRNA的GO功能注释(A)与KEGG信号通路富集分析(B)Fig.3 GO functional annotation(A) and enrichment analysis of KEGG signaling pathway(B) of differentially expressed mRNA
2.5 差异表达lncRNA靶基因预测及功能分析
为进一步了解差异表达的lncRNA对川中黑山羊肝功能的调节作用,搜寻已测得lncRNA 基因上、下游100 kb以内的蛋白编码的基因,预测到33个差异表达的lncRNA,对显着差异表达的33个lncRNA靶基因进行了GO功能注释和KEGG功能聚类分析。对所有显着差异表达lncRNA进行GO功能注释发现,这些差异表达的lncRNA靶基因被注释到858个GO term中。对这些GO term进行显着性分析,发现有95个GO term能被显着富集(P<0.05),差异表达lncRNA靶基因的前30个GO term主要包括14个生物过程、6个细胞组成、1个分子功能。图4A根据P值列出了试验组和对照组差异显着lncRNA的前30个GO term。根据GO富集结果进行筛选,选择与肝功能相关的GO term,涉及生物过程的主要的有钾离子迁移(potassium ion transport)和抗原处理和传递(antigen processing and presentation)等;涉及细胞组成的主要有核泛素连接酶复合物(nuclear ubiquitin ligase complex)、后期促进复合物(anaphase-promoting complex)和cullin RING泛素连接酶复合物(anaphase-promoting complex)等;涉及分子功能的主要有小分子结合(small molecule binding)、核苷酸结合(nucleotide binding)和核苷磷酸盐结合(nucleoside phosphate binding)等。对所有显着差异表达lncRNA进行KEGG信号通路富集分析,基于KEGG数据库的通路富集分析,对显着差异的lncRNA进行富集得到20个通路,图4B列出了试验组和对照组显着差异的20个富集通路(P<0.05),主要富集的通路有药物代谢-细胞色素P450(Drug metabolism-cytochromeP450)及细胞色素P450对异源物质的代谢(Metabolism of xenobiotics by cytochromeP450)等。
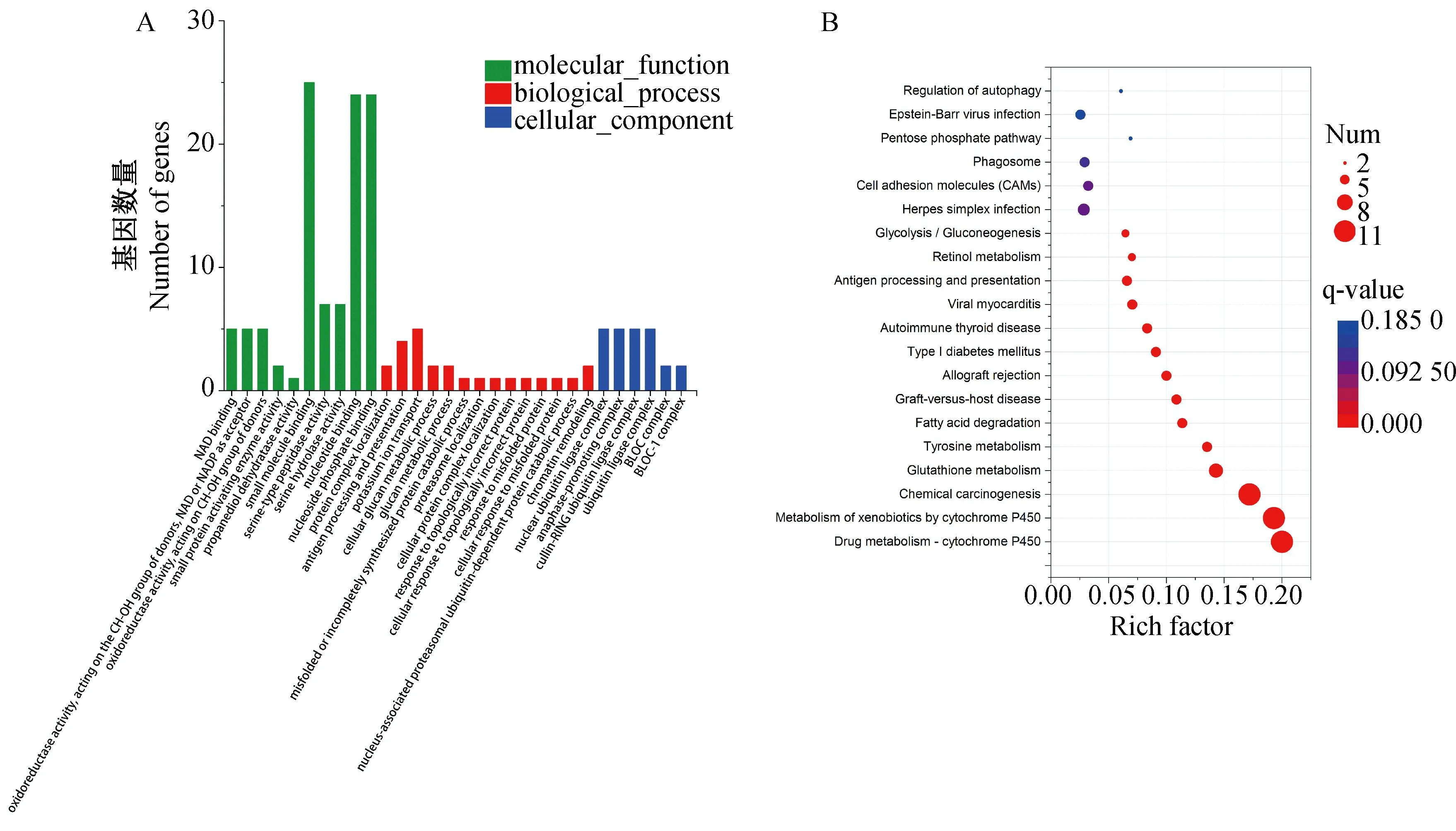
图4 差异表达lncRNA的GO功能注释(A)与KEGG信号通路富集分析(B)Fig.4 GO functional annotation(A) and enrichment analysis of KEGG signaling pathway(B) of differentially expressed lncRNA
2.6 差异表达的lncRNA顺式调控靶基因与差异表达mRNA的交集基因分析
对预测到的差异表达lncRNA顺式调控的靶基因与差异表达mRNA取交集,用于分析可能存在于川中黑山羊肝组织mRNA中,且受到lncRNA的顺式调控作用的基因,在试验组vs. 对照组中,差异表达lncRNA 顺式调控靶向了175个mRNA,其中有24个差异表达mRNA,所筛选的mRNA与lncRNA的作用关系如图5所示。其中交集的差异表达基因有NDUFA10、NDUFS5、ICK、SRRM2、TCEB2、LOC102172184、ZNFX1等。
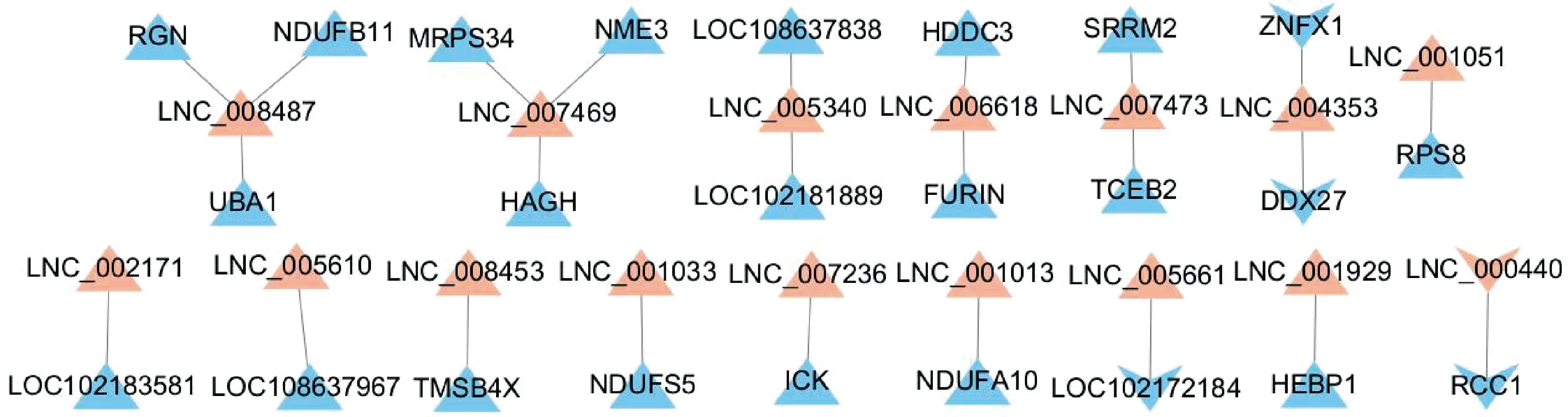
橙色代表lncRNA,蓝色代表mRNA,三角代表上调,下箭头代表下调 Orange represents lncRNA, blue represents mRNA, triangle represents up-regulation while down-arrow represents down-regulation图5 差异表达lncRNA顺式调控靶基因与差异表达mRNA作用关系图Fig.5 Relationship between differentially expressed lncRNA cis regulatory target genes and differentially expressed mRNA interactions
2.7 测序结果RT-qPCR验证
通过荧光定量对随机挑选的6个差异表达mRNA和lncRNA进行验证。结果表明,随机挑选的6个mRNA和lncRNA的荧光定量结果与转录组测序结果的表达趋势相符(图6),证实川中黑山羊肝组织转录组测序结果具有可靠性,可用于后续研究。
3 讨 论
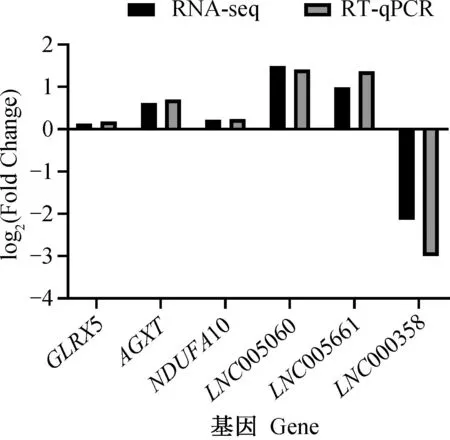
图6 差异表达基因 RT-qPCR验证Fig.6 RT-qPCR validation of differentially expressed genes
lncRNA是一种大于200个核苷酸的长链RNA,一直以来被看作是无用的剪切产物,但随着高通量技术的进步,lncRNA的多种功能已经在被逐步挖掘,可以直接通过与DNA、RNA或蛋白质结合进行顺式或反式调控[18-19]。在试验组与对照组两组间发现了一些差异表达的基因和显着富集的通路与肝功能有关,在对差异表达lncRNA靶基因的功能富集结果与差异表达mRNA功能富集结果取交集对比后发现,其中大多差异基因的功能都是代谢过程,包括细胞多糖代谢过程、葡聚糖分解代谢过程、纤维素分解代谢过程等;在针对差异lncRNA靶基因的KEGG信号通路富集分析中,发现较为显着富集的差异表达通路,如药物代谢-细胞色素P450及细胞色素P450对异源物质的代谢等。
本研究根据差异表达mRNA与lncRNA靶基因交集基因功能注释并结合mRNA的功能聚类分析发现,关于编码泛醌氧化还原酶亚基的基因如NDUFA10、NDUFB11、NDUFS5等表达显着差异,并且试验组的表达显着高于对照组。NDUF家族蛋白具有调节线粒体呼吸链功能和线粒体内蛋白质合成的生物学功能[20]。此类基因表达主要参与了肝组织细胞中的多糖代谢过程、葡聚糖分解代谢过程、纤维素分解代谢过程等生物过程。在人类医疗领域中,缺少NDUF家族蛋白可引起心肌炎、心肌梗死[21]、恶性肿瘤转移[22]、视神经病变[23]等问题。Hoefs等[24]研究发现,NDUFA10的突变会致使细胞线粒体复合物I缺陷,进而打破氧化磷酸化系统的平衡。线粒体复合体I在线粒体内膜中作为一个疏水性的“臂”,亲水性臂延伸到线粒体基质或细胞质中。复合物I的14个核心亚基包括所有NDUF家族等催化所有复合物I编码,它们包括对2个结构域作出响应的两组7个亚基,分别为7个疏水亚基和7个亲水亚基。7个核编码的亲水亚基连接黄素单核苷酸和8个铁硫簇,分别催化NADH氧化和转移黄素上的电子到醌[25]。NAD+是一种二核苷酸辅因子,具有在各种细胞氧化还原反应中接受电子的潜力。还原后的NADH是一种无处不在的细胞电子供体。NAD+、NADH和NAD+/NADH比值可以控制几种氧化还原酶的活性[26]。在这种电子转移过程中释放的能量被用来在线粒体内膜上转移质子,产生质子梯度,可用于合成ATP[27]。Panelli等[28]研究发现,NDUFB11转录后调控可能参与细胞凋亡过程,且对复合物I的功能有影响。Rea等[29]研究发现,NDUFB11在发育中的斑马鱼胚胎中被敲低会导致心组织结构异常,证明了NDUFB11在心组织病理学中的病理作用。李博[30]研究发现,咳平盐酸盐通过抑制线粒体氧化磷酸化途径中的复合物亚基NDUFS5蛋白,抑制了氧化磷酸化的发生,从体内和体外抑制了食管鳞状细胞癌的增殖。因此猜测,饲喂青贮黄粱木会影响川中黑山羊肝组织中的NDUFA10、NDUFB11、NDUFS5等基因的表达,催化细胞线粒体复合物I的编码,提高细胞ATP水平,从而影响肝的各种代谢过程。
根据差异表达lncRNA靶基因的KEGG信号通路富集分析结果可发现,细胞色素P450的代谢通路在饲喂黄粱木的试验组中富集。细胞体具有多种解毒酶,能够清除数千种自然产生的毒素和外来化学物质[31],这些有毒化合物的代谢过程一般分为I相和II相反应。大多数I期酶既能解毒又能激活代谢,细胞色素P450酶占所有I期酶的70%~80%[32]。细胞色素P450酶是一个很大且可自身氧化的亚铁血红素蛋白家族,主要在肝细胞中表达,又称混合功能氧化酶和单加氧酶[33-34],也是代谢内源性化合物即胆汁酸和外源物质的酶,这些外源物质包括药物、致癌物、毒素、天然物质和化学产物,同时参与维持脂质稳态调控,主要调控胆固醇、维生素D、氧化甾醇和胆汁酸代谢等[35]。本研究中关于细胞色素P450的代谢信号通路中所包含的有11个差异表达基因,包括了GST家族与其他编码谷胱甘肽转移酶及有关蛋白的基因,其中GSTA3、GSTA4的表达明显上调。在肝中活性和含量占优势的是GST的A类,主要功能是编码谷胱甘肽硫转移酶。谷胱甘肽硫转移酶是Ⅱ相药物代谢酶,在解毒和细胞保护方面起着关键作用[36],能通过抑制微粒体过氧化反应、修复自由基引起的膜磷脂损伤等途径发挥抗氧化作用。GSTA家族由5个不同的成员组成,包括GSTA1、GSTA2、GSTA3、GSTA4和GSTA5[31,37],GSTA1和GSTA2对过氧化物、脂肪酸和氢过氧化物具有抗氧化活性;GSTA3在人类疾病上的研究较多,杜伟一等[38]研究发现,GSTA3具有与抑癌因子一样的作用,在人类鼻咽癌复发、转移中起到保护作用,在畜牧领域中,杨世雄等[39]研究发现,重组外源GSTA3蛋白对TD肉鸡有促生长作用;GSTA4在4-羟基壬烯醛(4-HNE)与GSH10、GSH11偶联作用具有高催化效率,4-HNE是脂质过氧化的细胞毒性最终产物,可共价修饰蛋白质和DNA,并导致神经退行性疾病、衰老和癌症[40],可得GSTA4具有解毒作用。由于GST类作为细胞信号激酶途径的介质参与了细胞周期转换,如增殖和凋亡,Romero等[41]研究发现,在Caco-2细胞内,GSTA的表达增加会影响细胞对外界应激的抵抗能力,因此猜想,饲喂青贮黄粱木会影响川中黑山羊肝细胞转录组中GSTA3、GSTA4基因表达,加大谷胱甘肽硫转移酶的表达量,促进了脂质稳态,影响了肝细胞对外界应激的抵抗能力。
4 结 论
本研究对青贮黄粱木代替青贮玉米的川中黑山羊和对照组的肝组织进行高通量测序,发现差异表达的mRNA共有1 696个,其中943个上调,753个下调;差异表达lncRNA共有33个,其中22个上调,11个下调。对差异表达基因进行GO功能注释和KEGG信号通路富集分析发现,差异表达的NDUFA10、NDUFB11、NDUFS5等基因显着上调,它们可通过多糖代谢过程、葡聚糖分解代谢过程、纤维素分解代谢过程等代谢通路影响肝功能,催化细胞线粒体复合物I的编码,提高细胞ATP水平,从而影响肝的各种代谢过程;差异表达的GSTA3、GSTA4基因显着上调,影响药物代谢-细胞色素P450及细胞色素P450对异源物质的代谢等代谢通路,加大谷胱甘肽硫转移酶的表达量,促进了脂质稳态,影响了肝细胞对外界应激的抵抗能力。综上推测,饲喂青贮黄粱木可以通过影响川中黑山羊肝的代谢过程及细胞解毒能力来发挥生物功能。



