苗 舒,安济山,王 祚,肖定福,兰欣怡,刘 磊,沈维军*,万发春*
(1.湖南农业大学动物科学技术学院,长沙 410128;2.湖南农业大学动物医学院,长沙 410128)
2022年我国牛肉进口314万吨,高居全球第一,表明我国牛肉市场存在巨大缺口[1]。骨骼肌是肉牛躯体占比最高的组成部分,与产肉性能直接相关。动物出生后,成肌细胞的增殖、分化与融合被看作是参与骨骼肌发育的重要途径[2]。Leu是参与动物机体多种细胞和生理过程的关键营养物质,同时也是骨骼肌中不可缺少的支链氨基酸[3]。大量研究表明,Leu对刺激蛋白质合成、抑制蛋白质降解、增强蛋白质活性和真核起始因子的有效性等过程具有重要的意义[4-5]。在骨骼肌生长发育方面,研究发现Leu可不同程度的促进C2C12[6]、鼠卫星细胞[7]、猪成肌细胞[8]以及绵羊成肌细胞[9]的增殖与分化。目前,关于Leu对牛成肌细胞影响的研究尚未见报道,其对成肌细胞增殖的调控机制尚不清楚。PI3K-AKT通路是一条关键的细胞内信号通路,可调控多种生物学过程。研究报道,PI3K-AKT通路在骨骼肌的生长发育中具有重要的调控作用。如王琴[10]研究发现睾酮可激活PI3K-AKT通路促进鸡胚成肌细胞的增殖;付玉莹[11]发现,WDR13调控PI3K-AKT通路促进牛肌肉卫星细胞的分化。于欢等[12]研究发现,胰岛素可通过PI3K-AKT通路增强大鼠骨骼肌成肌细胞的增殖;也有研究表明,锌可通过PI3K/AKT促进肌源性细胞的增殖和激活[13]。近年来研究表明,营养素可通过信号通路发挥调控细胞发育的作用,因此推测Leu可能通过 PI3K-AKT信号通路调控牛成肌细胞的增殖。
本试验以牛成肌细胞为研究对象,探究外源性补充Leu对牛成肌细胞增殖的影响,同时利用RNA-Seq和生物信息学分析明确Leu对牛成肌细胞增殖的作用机理,旨在为Leu对肉牛肌肉发育的影响及其机制研究提供重要的理论基础,同时也为Leu在畜牧生产中调控肉品质方面的作用研究提供新的思路。
1 材料与方法
1.1 试验材料
1.1.1 试验细胞来源 试验所用细胞为湖南农业大学动物科学技术学院南方草食动物研究中心分离鉴定并保存的原代牛成肌细胞。
1.1.2 主要试剂和仪器 DMEM/F12培养液、0.25%胰蛋白酶、双抗(PS)、I型胶原酶购自Gibco公司;不含Leu的DMEM/F12培养液购自博士德生物公司;胎牛血清(FBS)购自PAN公司;Leu购自Solarbio公司;EdU检测试剂盒购自 Beyotime公司;磷酸盐缓冲液(PBS)、PAGE凝胶超快速配制试剂盒购自大连美仑生物公司;LY294002购自MCE公司;反转录和实时荧光定量试剂盒购自TaKaRa公司;抗体PAX7(A12740)购自Abclonal公司;抗体P-AKT(4060)购自CST公司;抗体Tubulin(380628)购自成都正能生物公司;倒置荧光显微镜(型号Axio Vert.A1)购自ZEISS公司;实时荧光定量PCR仪(型号CFX96)购自BIO-RAD公司;多功能成像系统(JS-1070P)购自上海培清科技公司;RNA-Seq服务由诺禾致源生物有限公司提供。
1.1.3 Leu及完全生长培养液配制 100 mmol·L-1的Leu母液:称取0.393 g的Leu加入到30 mL的(不含Leu)DMEM/F12培养液中,37 ℃加热混匀,4 ℃保存备用。
完全培养基:84% DMEM/F12+15%FBS+1%PS,混匀,4 ℃保存备用。
1.2 试验方法
1.2.1 牛成肌细胞培养与鉴定 于长沙红星屠宰场采取16月龄健康雄性利木赞牛背最长肌肌肉组织,牛成肌细胞的培养与鉴定参照王亚宁[14]和王晓刚[15]的操作方法。刚分离出的细胞于37 ℃,5% CO2培养箱中培养 2 h,此时大量的成纤维细胞贴壁,将未贴壁细胞悬液转入新的培养瓶中培养,重复此步骤2次,即为细胞纯化过程。每48 h 换液,细胞密度达80%左右进行传代和冻存。通过对成肌增殖标志因子PAX7的免疫荧光染色鉴定成肌细胞,参考孙金魁等[16]的方法进行操作,利用倒置荧光显微镜拍照,检测染色结果。
1.2.2 CCK-8法检测细胞活力 待细胞密度达到80%时,将细胞用0.25%胰酶消化下来,加入完全培养液重悬后,使用细胞计数板进行计数,以每孔5×103个细胞接种于96孔板中,加入100 μL完全培养基,待细胞生长达到合适的密度(约50%)后,更换含不同浓度(0、0.25、0.50、0.75和1 mmol·L-1)的Leu培养基处理细胞,每个处理5个重复,置于37 ℃,5% CO2培养箱中培养24 h后,每孔加入10 μL的CCK-8试剂,继续培养4 h,利用酶标仪在450 nm波长下测定OD值(测定过程应避光操作)。
1.2.3 EdU染色法检测细胞增殖 将细胞以5×103个·孔-1接种于96孔板中,设置对照组(0 mmol·L-1Leu)和最佳浓度Leu组,每组3个生物学重复,在培养箱中培养24 h后,按照EdU试剂盒说明书进行操作,在倒置荧光显微镜下观测DAPI标记的细胞总数与EdU标记的阳性细胞数,并进行EdU阳性细胞率的统计分析。
1.2.4 实时荧光定量PCR(qRT-PCR) Trizol法提取细胞总RNA,利用RNA反转试剂盒将总RNA反转录为cDNA,荧光定量试剂盒对目的基因进行实时定量检测。NCBI primer-BLAST设计目的基因的引物,所有引物均由上海生工生物工程有限公司合成,qRT-PCR反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,循环40次。引物信息序列见表1。

表1 qRT-PCR引物信息序列Table 1 Primer information sequence of qRT-PCR
1.2.5 蛋白免疫印迹(Western blot) 将细胞接种于6孔板中,每组3个生物学重复,提取各组的细胞总蛋白。采用BCA法检测蛋白浓度,统一浓度后对蛋白进行变性。WB试验检测目的蛋白的相对表达量,将变性后的蛋白样品上于10% SDS-PAGE胶,80 V电泳30 min后,调电压至120 V,直至样品跑到最底部,最后400 mA恒流30 min进行快速电转。电转结束后用5%的脱脂奶粉封闭液于摇床上封闭2 h,加入对应的一抗,4 ℃过夜孵育。次日,加入对应的二抗孵育,ECL试剂盒显色,利用凝胶成像仪显影拍照,并利用image j软件对蛋白条带进行灰度分析。
1.2.6 转录组学测序分析 为探究Leu对牛成肌细胞增殖的作用机理,以最佳浓度Leu为处理组、0 mmol·L-1Leu为对照组进行RNA-Seq,每组3个生物学重复,加入Trizol刮取细胞收集于1.5 mL离心管中,低温保存运输,样品交于北京诺禾致源生物有限公司进行测序分析。主要试验过程包括:①RNA提取与检测;②文库构建与质检;③上机测序;④数据质控;⑤序列比对到参考基因组;⑥筛选差异基因;⑦差异基因GO和KEGG富集分析。GO-KEGG富集分析通过clusterProfiler (3.8.1)软件进行。
1.2.7 数据统计与分析 数据分析与作图使用SPSS 21.0和 GraphPad 8.0软件。荧光定量PCR以GAPDH为内参使用2-ΔΔct计算基因相对表达量;利用独立样本t检验对两组试验数据进行统计处理;利用单因素方差分析对多组试验数据进行统计处理,DUNCAN检验进行多重比较。所有结果以”平均值±标准误(Mean±SEM)”表示。不同字母标注表示各组之间具有显着差异(P<0.05)。
2 结 果
2.1 牛成肌细胞的鉴定
通过免疫荧光染色检测成肌增殖标志因子PAX7蛋白的表达情况,DAPI进行细胞核染色,如图1显示,细胞核外周及胞浆均呈现绿色荧光,表明PAX7呈阳性表达,使用image j合并DAPI和PAX7后发现每个细胞核外周均呈现出绿色荧光,表明本试验成功分离了牛成肌细胞,且细胞纯度较高,可满足后续试验需求。

图1 牛成肌细胞PAX7免疫荧光染色(200×)Fig.1 PAX7 immunofluorescence staining of bovine myoblasts (200×)
2.2 Leu对牛成肌细胞增殖的影响
由图2可知,Leu处理后牛成肌细胞形态未发生改变,处于成肌细胞增殖期。与对照组(0 mmol·L-1Leu)相比,各处理组均可显着提高牛成肌细胞活力(P<0.05),且细胞活力先随着Leu浓度的增加呈上升趋势,后随着浓度的增加有所下降。其中,0.5 mmol·L-1Leu极显着高于对照组(P<0.01),因此选择0.5 mmol·L-1为牛成肌细胞增殖期的最佳浓度,进行后续试验。0.5 mmol·L-1Leu处理牛成肌细胞24 h后,采用EdU染色法检测牛成肌细胞的增殖状态。如图3所示,与对照组相比,0.5 mmol·L-1Leu组EdU阳性细胞数明显增多,其EdU阳性细胞率显着增加(P<0.05)。
2.3 转录组测序数据过滤统计
测序产生的原始数据(raw data),通过Fastp软件过滤掉不合格的序列后得到有效数据(clean data),分别进行统计后发现符合过滤条件的reads(PF)大于97%以上,过滤后reads大于Q20、Q30的比例在97%、93%以上,6个样品的序列数据中GC含量约为52%,表明数据质量符合进一步生物信息分析的需求(表2),其中A组表示对照组,B组表示Leu处理组。

A. Leu浓度筛选细胞光镜图(40×);B. CCK-8细胞活力测定图:不同字母标注表示各组之间具有显着差异(P<0.05),下同 A. Light microscope image of cells selected by Leu concentration (40 ×); B. Plot of CCK-8 cell viability assay: Different letter marks indicate significant differences between groups (P<0.05), the same as below图2 Leu对牛成肌细胞活力的影响Fig.2 Effect of leucine on the viability of bovine myoblasts

A. EdU染色图(100×);B. EdU阳性细胞率统计图 A. EdU staining diagram(100×); B. Statistical plot of EdU-positive cell rate图3 Leu处理牛成肌细胞后EdU增殖检测Fig.3 EdU proliferation detection of bovine myoblasts treated with leucine
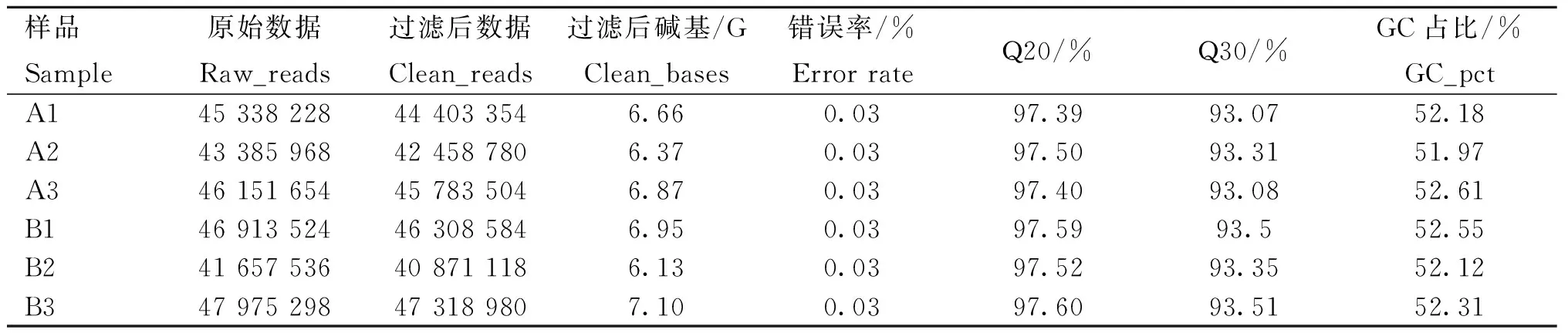
表2 测序数据质量评估Table 2 Quality assessment of sequencing data
2.4 Leu处理增殖期牛成肌细胞的差异基因分析
如图4所示,经Leu处理增殖期牛成肌细胞24 h后,以|log2foldchange|>0、校正后P值(padj)<0.05作为阈值,共筛选出1 290个差异表达基因,其中688个基因相对上调和602个基因相对下调,对差异基因进行聚类分析,可观察到明显的差异表达基因分组模式。
2.5 差异表达基因的功能注释
为了探究所筛选差异基因的生物学功能,对差异基因进行GO富集分析,按照分子功能(molecular function,MF)、生物过程(biological process,BP)和细胞组分(cellular component,CC)进行GO分类,挑选每个GO分类中padj值最小即富集最显着的前10个GO条目进行展示(图5)。与对照组相比,Leu组的差异表达基因参与了多种生物过程,包括肽的代谢合成过程、酰胺的代谢合成过程等;在分子功能类别上,大多数基因功能与核糖体的结构成分、氧化还原酶活性、NADH脱氢酶活性等相关;在细胞组分范畴内,大部分的基因被富集到核糖体、细胞质、细胞器等。
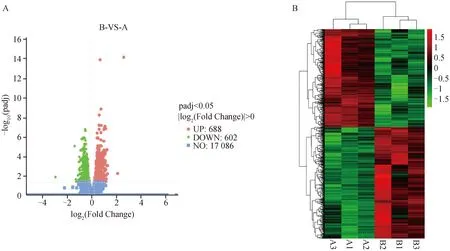
A. 差异表达基因分析的火山图:红色点表示上调基因,绿色点表示下调基因,蓝色点表示变化不显着基因。B. 差异表达基因的聚类分析热图:横坐标代表不同样品,纵坐标代表不同样品对比的差异表达基因;不同位置色块代表对应位置基因的相对表达量,红色代表高表达,绿色代表低表达 A.The volcano plot of differentially expressed genes analysis, with red dots indicating up-regulated genes, green dots indicating down-regulated genes, and blue dots indicating genes with insignificant changes. B. The heat map of the cluster analysis of differentially expressed genes: The abscissa represents different samples, and the ordinate represents the differentially expressed genes compared between different samples; The color blocks at different positions represent the relative expression levels of genes at corresponding positions, red represent high expression, green represent low expression图4 Leu处理增殖期牛成肌细胞的差异表达基因Fig.4 Differentially expressed genes in bovine myoblasts treated with leucine during proliferative phase
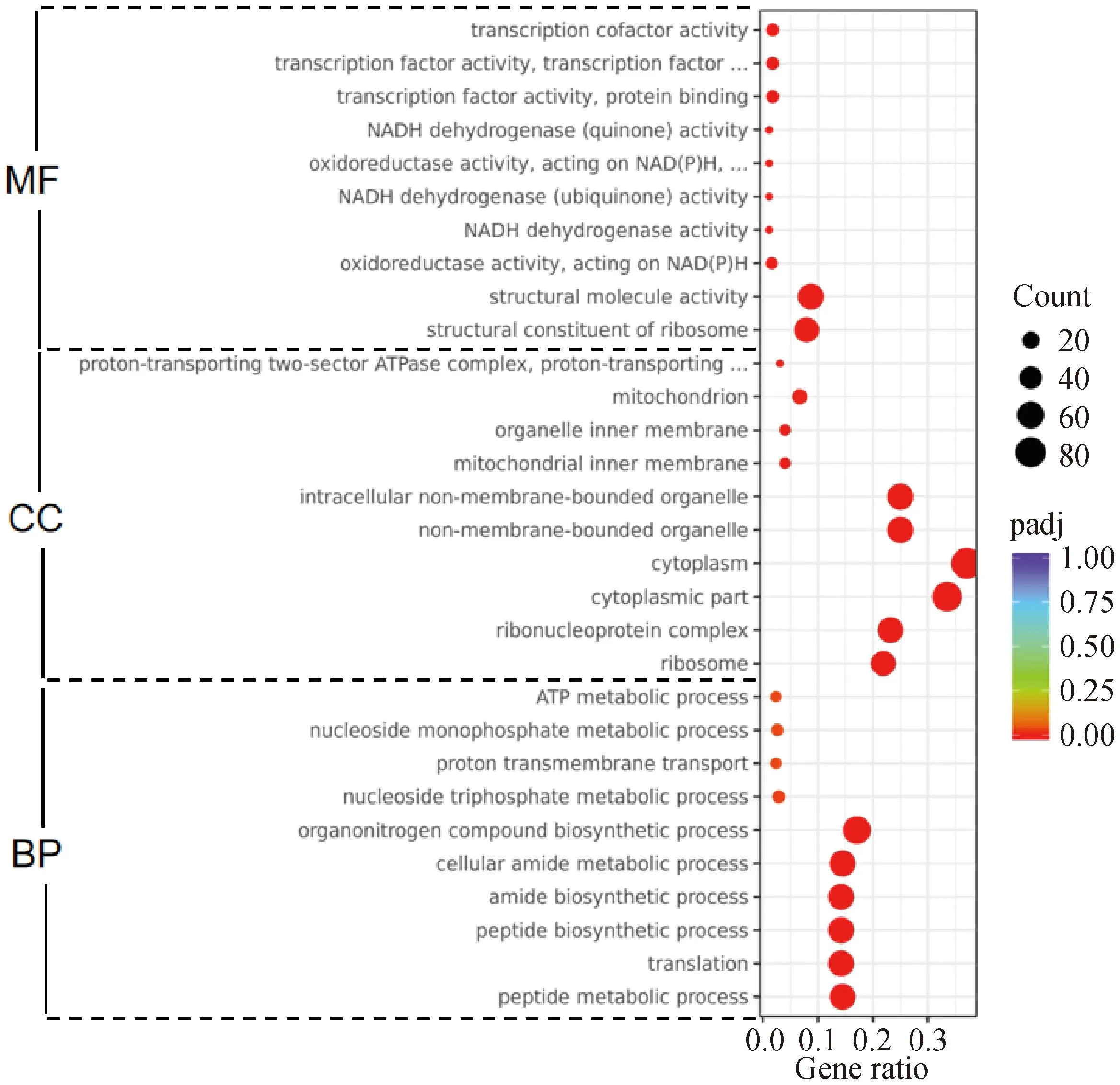
图5 Leu处理增殖期牛成肌细胞差异基因的GO富集气泡图Fig.5 GO enrichment bubble plots of differential genes after leucine treatment of proliferating bovine myoblasts
将筛选到的差异基因映射到KEGG数据库中。Leu组有644个差异表达基因得到注释,其中309个上调基因涉及47条显着富集通路(padj<0.05),其中将前20条通路以气泡图进行展示(图6)。与骨骼肌生长发育相关的通路有粘着斑、AMPK、PI3K-AKT、肌动蛋白细胞骨架调节、胰岛素信号等通路,其中PI3K-AKT信号通路最为富集,包含34个上调基因。
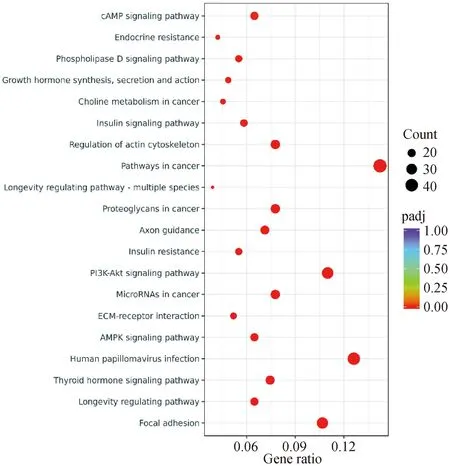
图6 Leu处理增殖期牛成肌细胞差异基因的KEGG富集气泡图Fig.6 KEGG enrichment bubble plots of differential genes in bovine myoblasts treated with leucine during proliferative phase
2.6 PI3K-AKT信号通路分析
为了检验RNA-Seq数据的准确性,随机挑选PI3K-AKT信号通路中6个差异表达基因进行荧光定量PCR验证。结果如图7 显示,Leu可提高牛成肌细胞增殖过程中PIK3R1、FOXO3、IRS1、RPTOR、MTOR和MET的基因表达水平,这与RNA-Seq的结果一致,表明测序结果是可靠的。为了进一步研究Leu对PI3K-AKT信号通路的调控作用,采用PI3K特异性抑制剂LY294002和Leu共同处理牛成肌细胞,24 h后收取细胞总蛋白和总RNA。采用WB检测PI3K-AKT信号通路中P-AKT和牛成肌细胞增殖标志因子PAX7的蛋白表达水平,qRT-RCR检测牛成肌细胞增殖标志因子PAX7、CDK1和PCNA的基因表达水平。结果如图8所示,与对照组相比,P-AKT和PAX7的蛋白水平在Leu组显着增加(P<0.05),当LY294002和Leu共同处理时,P-AKT和PAX7的蛋白水平比Leu单独处理显着降低(P<0.05);在基因表达水平上,PAX7、CDK1和PCNA的表达量经Leu处理后显着增加(P<0.05),当LY294002和Leu共同处理时,CDK1和PCNA的表达量比Leu单独处理显着降低(P<0.05),而PAX7表达量无显着变化(P>0.05)。以上结果表明,抑制PI3K-AKT信号通路后,可阻断Leu对牛成肌细胞增殖的促进作用,这说明Leu可通过调控PI3K-AKT信号通路促进牛成肌细胞的增殖。
3 讨 论
成肌细胞,又称肌肉干细胞。哺乳动物成体骨骼肌是一种相对稳定的组织,在正常的生理状态下很少发生细胞死亡或核裂变[17]。成肌细胞的增殖在骨骼肌生长发育中起着重要作用。目前,Leu对牛成肌细胞增殖的影响尚未见报道。本试验利用不同浓度Leu处理增殖期牛成肌细胞后,牛成肌细胞活力显着上升,并筛选出0.5 mmol·L-1Leu为最佳浓度,同时,经Leu处理后EdU阳性细胞率显着提高,表明Leu可促进牛成肌细胞的增殖。
为了进一步探究Leu对牛成肌细胞增殖的作用机理,进行RNA-Seq和生物信息学分析,旨在筛选出Leu调控牛成肌细胞增殖的差异基因和关键信号通路。本试验共筛选到1 290个差异表达基因,对所有差异表达基因进行GO功能注释发现,显着富集到59个条目,BP共23条,占比37.9%;MF共20条,占比34.5%;CC共16条,占比27.6%,这表明所筛选的差异基因在生物过程中具有重要影响,包括肽的代谢合成过程、酰胺的代谢合成过程等,这可能与Leu促进骨骼肌中蛋白质的合成有关。KEGG富集分析中,有644个差异表达基因得到注释,其中309个上调基因涉及47条显着富集通路,与骨骼肌生长发育相关通路有粘着斑、AMPK、PI3K-AKT、肌动蛋白细胞骨架调节、胰岛素信号等通路。PI3K-AKT通路是细胞内关键的信号通路之一,调节细胞的多种生物学过程,包括细胞生存、代谢、分化和增殖。大量研究表明,PI3K/AKT通过调控下游靶蛋白如mTOR[18]、NF-κB[19]、P70S6K[20]的表达来调控细胞增殖。在本试验中,PI3K-AKT通路是骨骼肌生长发育相关通路中最显着富集的信号通路,包含34个差异表达基因。这也符合前期的推测,即Leu与PI3K-AKT通路之间可能存在调控关系。因此,重点关注PI3K-AKT信号通路。
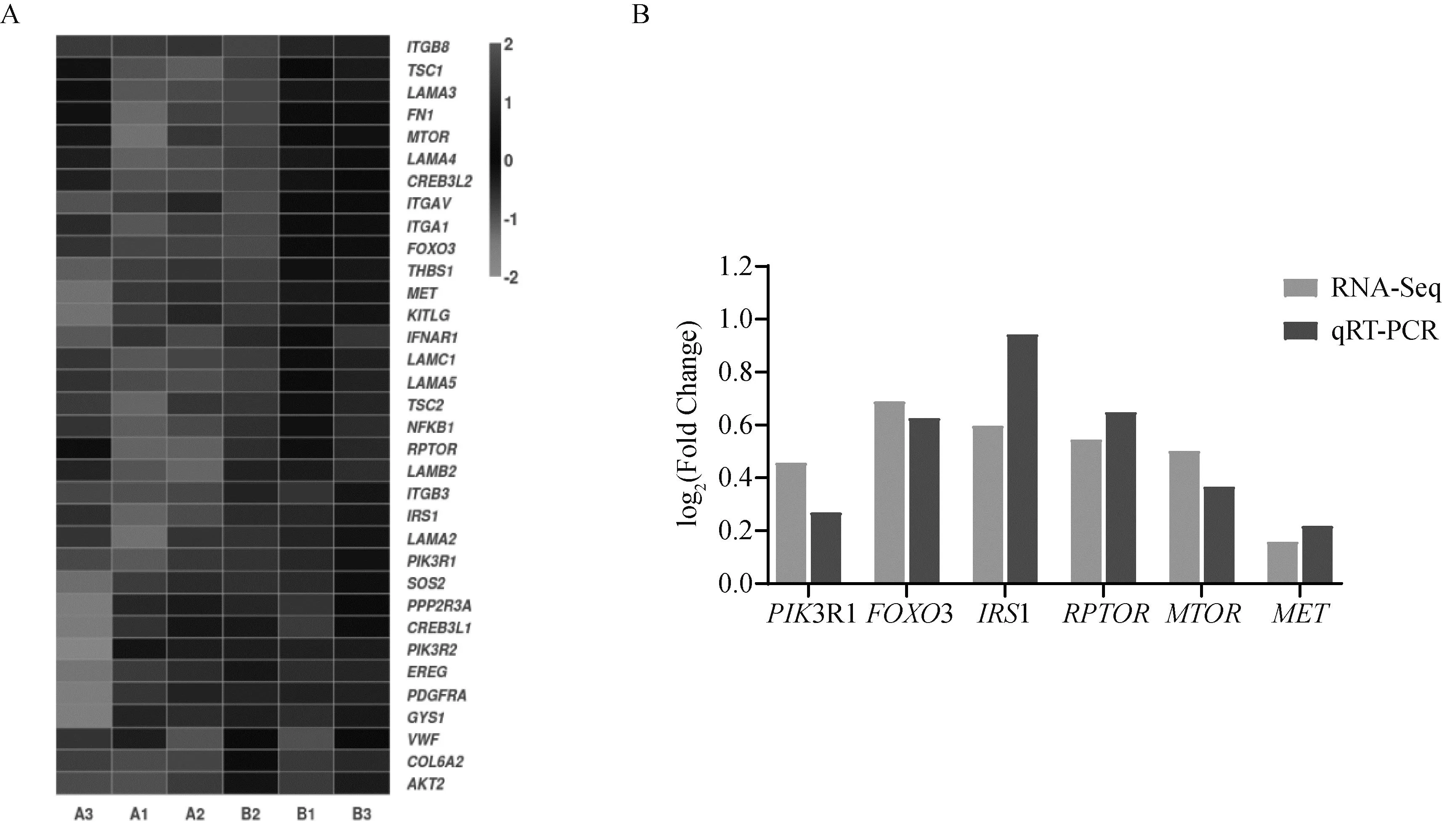
A. PI3K-AKT信号通路富集的差异表达基因聚类图;B. qRT-PCR验证随机挑选的差异表达基因 A. The cluster map of differentially expressed genes enriched in PI3K-AKT signaling pathway; B. The randomly selected differentially expressed genes verified by qRT-PCR图7 PI3K-AKT信号通路中富集的差异表达基因Fig.7 Differentially expressed genes enriched in PI3K-AKT signaling pathway
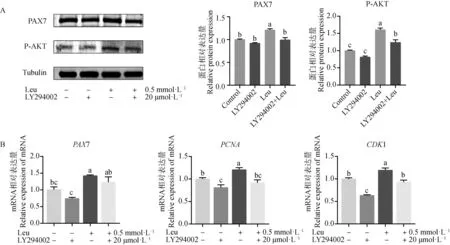
A. 添加LY294002后P-AKT和PAX7的蛋白表达量变化;B. 添加LY294002后PAX7、CDK1和PCNA的基因表达量变化 A. The protein expression changes of P-AKT and PAX7 after adding LY294002; B. The changes of PAX7, CDK1 and PCNA genes expression after adding LY294002图8 Leu处理增殖期牛成肌细胞对PI3K-AKT信号通路的影响Fig.8 Effect of leucine treatment on PI3K-AKT signaling pathway in proliferating bovine myoblasts
为了检验RNA-Seq测序数据的准确性,从PI3K-AKT信号通路中随机挑选6个差异表达基因(PIK3R1、FOXO3、IRS1、RPTOR、MTOR和MET)进行荧光定量PCR验证。这6个基因的表达模式与RNA-Seq的结果一致。PI3K是一种异源二聚体,由一个含SH2的调节亚基(p85)和一个催化亚基(p110)组成。PI3K的激活是由p85结合活化受体酪氨酸激酶(RTKs)诱导的,当二者的结合能力降低时会抑制PI3K-AKT信号传导[21]。PIK3R1基因主要编码PI3K(p85)调节亚基,同时也是正常组织中最丰富的亚型,其可调控细胞增殖过程[22]。当PIK3R1缺失或减少时会影响B细胞的发育和增殖,抑制细胞粘附,延缓胚体发育;而沉默PIK3R1可抑制Huh7细胞的增殖[23]。在肝脏中PIK3R1的缺失会引发胰岛素刺激的PI3K活性显着降低,导致肝脏糖脂平衡、肝脏大小和功能显着改变。本试验中,PIK3R1基因在Leu组中的表达量高于对照组,并且显着富集到PI3K-AKT信号通路,这表明牛成肌细胞增殖与PIK3R1基因表达上调有关。FOXO3基因是叉头盒家族(Forkhead box O,FOXO)中的一员,具有广泛的细胞功能,包括调节细胞周期、凋亡、萎缩、DNA修复、能量代谢和抗氧化应激[24]。FOXO3是PI3K-AKT信号通路的重要下游靶点,被激活的AKT通过磷酸化FOXO3调控其从细胞核到细胞质的定位,使其失活[25]。FOXO3在骨骼肌生长发育中的作用已经被广泛报道,它在大多数细胞中均有表达,是影响鸡肌肉生长的候选因子[26]。敲低鸡成肌细胞中FOXO3后,增殖标志因子PAX7基因和蛋白的表达水平均显着下调,同时分化期的肌管融合率显着高于未敲低组,这表明FOXO3可促进鸡成肌细胞增殖,抑制肌管分化[27]。有研究表明,MyoD是FOXO3的直接靶标,FOXO3缺失小鼠中MyoD下调会导致肌肉再生缺陷,这表明FOXO3在调节成肌增殖分化中发挥着关键作用[28]。本试验中,Leu促进牛成肌细胞的增殖可能与FOXO3的上调有关。IRS1又称作胰岛素受体底物1,其在哺乳动物骨骼肌中表达量最高。在细胞表面,胰岛素样生长因子(IGF1)与其受体相结合,以异构二聚体的形式磷酸化IRS1,进而激活下游的PI3K-AKT和MAPK信号通路,二者均具有促进细胞有丝分裂和生存的作用[29]。IRS1的总量或磷酸化量减少可导致细胞对IGF1或胰岛素的反应性降低,并导致PI3K/AKT和MAPK途径的激活降低[30]。IGF1/IRS1/PI3K/AKT途径通过增加蛋白质合成和阻断蛋白质降解诱导骨骼肌肥大[31]。张冬杰等[32]研究发现,过表达C2C12细胞IRS1基因后,成肌调节因子(Myf5、MyoD、MyoG、Myf4)和MYHC的转录水平发生了显着上调,这说明IRS1可促进肌细胞的增殖与分化。MTOR和RPTOR共同编码MTOR蛋白复合物1(MTORC1),MTORC1主要作用是磷酸化两个下游底物核糖体蛋白S6K1和4E-BP1调控蛋白质合成,以促进骨骼肌生长。已有研究表明,Leu可通过激活mTORC1促进骨骼肌中蛋白质的合成[33]。在本试验中,经Leu处理后,牛成肌细胞转录本MTOR和RPTOR表达量都显着提高。
蛋白激酶B(AKT)是PI3K-AKT信号通路的另一个关键因子,其对于细胞新陈代谢、增殖、存活和生长具有重要意义[34]。为了进一步明确Leu与PI3K-AKT信号通路的调控关系,本研究先用PI3K特异性抑制剂LY294002与Leu分别单独处理增殖期的牛成肌细胞,然后检测成肌细胞增殖期标志因子PAX7、PCNA和CDK1的基因表达水平,以及PI3K-AKT信号通路中P-AKT和PAX7蛋白表达水平。结果显示,抑制PI3K-AKT信号通路后,降低了PAX7、PCNA和CDK1的基因表达水平,同时P-AKT和PAX7蛋白表达水平也有所降低,这表明抑制该通路后牛成肌细胞的增殖受到抑制;添加外源性Leu后,可提高成肌增殖期标志因子的基因表达水平,同时P-AKT和PAX7蛋白表达水平也有所提升,这表明Leu可促进牛成肌细胞的增殖;当抑制剂LY294002与Leu共同处理时,与单独Leu组相比,PAX7、PCNA、CDK1基因的表达均下调,P-AKT和PAX7蛋白表达水平降低,这表明Leu对牛成肌细胞的增殖促进作用可被LY294002阻断。本试验结果表明Leu通过调控PI3K-AKT信号通路促进牛成肌细胞的增殖。
4 结 论
外源性添加Leu可促进牛成肌细胞的增殖,且0.5 mmol·L-1为增殖期的最佳浓度。添加 PI3K 抑制剂 LY294002 后阻断了亮氨酸对牛成肌细胞增殖的促进作用。以上结果表明,亮氨酸可通过PI3K-AKT信号通路促进牛成肌细胞的增殖。



