田启会,张 亮,龙亚丽
(甘肃畜牧工程职业技术学院,武威 733006)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一类具有自我更新能力和多向分化潜能的工程细胞[1-2]。在治疗过程中,需要依靠其不断的自我更新和增殖能力维持发挥其长期治疗或者辅助治疗作用,例如受损组织器官的再生与修复[1-4]。但是,异常微环境通常会引起BMSCs增殖能力的下降,限制其发挥长期的治疗作用,其中缺氧微环境是引起干细胞治疗过程效果不佳的主要的因素之一[5]。文献研究发现,缺氧环境可以导致BMSCs增殖、分化等生物学特性发生改变,这为干细胞的临床应用提出挑战[6]。BMSCs增殖活性是受损的组织器官再生和修复的基础,因此,如何防护缺氧所引起的BMSCs的增殖活性的异常改变已成为BMSCs应用前必需解决的关键问题。
BMSCs大量存在于脊髓中,黄芪作为补气类中药,具有健脾补中,升阳举陷,益卫固表的功效。前期已有文献证实黄芪成分(如黄芪多糖)能够维护MSCs的生物学稳定性[6-7]。基于以上分析,推测黄芪可能对BMSCs的增殖活性具有调节作用、是维持缺氧环境中BMSCs增殖活性的潜在药物。本研究拟通过建立缺氧微环境,探究黄芪对缺氧环境中BMSCs增殖活性的影响,并初步探讨黄芪的作用机制。
1 材料与方法
1.1 材料
骨髓间充质干细胞(BMSCs)细胞株,购自美国 ScienCell 公司(编号:7500)。
1.2 主要试剂与仪器
黄芪购自甘肃省中医院;间充质干细胞基础培养基、胎牛血清(ScienCell,22846);兔抗人p-PI3K(Immunoway,YP0765)、p-AKT(Immunoway,YP0006)多克隆抗体;山羊抗兔多克隆抗体二抗(Immunoway,RS0002);RT-PCR转录试剂盒(TaKaRa公司,批号:AKG1212A),RT-PCR荧光定量试剂盒(TaKaRa公司,批号:AL12412A);山羊抗兔多克隆抗体二抗(Alexa Fluor ® 594)(Abcam公司,GR596447);JC-10细胞线粒体膜电位(MMP)活细胞荧光染料(美国AAT公司,批号:2191362)。
CO2细胞低氧培养箱(Thermo,SKYJH);酶标仪(BIO-RAD,IMARK);激光共聚焦显微镜FV10-ASW 2.1 Viewer(Olympus,IX80),高内涵成像系统(PerkinElmer,Operetta CLS)。
1.3 试验分组
试验以BMSCs为研究对象,分为空白对照组(Ctrl)、低氧模型组(M)、黄芪冻干粉低剂量组(HQ-D)、黄芪冻干粉中剂量组(HQ-Z)、黄芪冻干粉高剂量组(HQ-G),细胞培养氧浓度为10%,黄芪冻干粉溶液低、中、高组浓度分别为100、200、400 μg·mL-1。
1.4 黄芪冻干粉溶液制备
将100 g黄芪用0.5 L蒸馏水煮沸1 h,提取水煎液,然后用滤纸过滤,将滤液放入冷冻干燥机内冻干。黄芪冻干提取物的提取率约为30%。冻干粉在使用前溶于蒸馏水,然后用0.22 μm注射器过滤器过滤。
1.5 细胞培养
取第 3 代的状态良好的 BMSCs 细胞,使用 MSCM 完全培养基调整成细胞浓度为 1×104·mL-1的单细胞悬液,每孔4 mL接种于细胞培养瓶内,每组设3个平行重复。将细胞置于常氧环境培养箱中培养,当细胞汇合达到60%时弃去瓶内培养基,加入新鲜完全培养基开始干预。黄芪冻干粉溶液组分别加入含有100、200、400 μg·mL-1的黄芪冻干粉完全培养基,低氧组和黄芪冻干粉溶液组置于10%的氧浓度环境中培养24 h。
1.6 细胞增殖检测
将干预后的细胞转移至96孔板中,每组3个复孔。贴壁后将细胞培养板放置到高内涵成像系统内,设置24 h无标记成像,记录细胞增殖、分化过程。
1.7 细胞运动检测
细胞前处理同上,利用高内涵成像系统实时无标记示踪程序,对细胞运动轨迹进行示踪并标记。根据细胞运动轨迹分析细胞运动速度、位移距离和路程。
1.8 细胞线粒体膜电位检测
干预完成后,用PBS对细胞清洗1遍后,加入新鲜培养基,将JC-10荧光探针工作液加入培养基中,37 ℃条件下避光孵育20 min后,在激光共聚焦显微镜下进行观察。当膜电位水平低时,激发波长527 nm,通过AF 488荧光通道观察拍照;当膜电位水平高时,激发波长590 nm,通过AF 594荧光通道观察,每组细胞进行3次重复。
1.9 激光共聚焦显微镜检测p-PI3K和p-AKT蛋白荧光表达
将盖玻片平铺入24孔细胞培养板中,将干预后的细胞消化、吹散并接种于6孔板中,汇合度控制在20%左右,进行培养。待细胞汇合度达到60%~70%时,每个孔中加1 mL 4%多聚甲醛,室温固定20 min,弃多聚甲醛,再加入1 mL甲醇继续固定5 min。弃甲醇,加入1 mL免疫荧光用Blocking buffer,室温封闭10 min。弃封闭液,加入含兔抗p-PI3K抗体(1∶500)和p-AKT抗体(1∶500)的Blocking buffer,慢摇过夜。PBS液,洗3遍后,加入1 mL含Alexa Fluor® 594 (ab)羊抗兔荧光二抗(500∶1)的Blocking buffer,避光慢摇1 h。PBS液润洗细胞5遍,每遍5 min。载玻片上滴加含DAPI染料的封片液,将盖玻片取出并倒扣在封片液上,于激光共聚焦显微镜下观察,每组细胞随机挑选3个视野,每个视野随机选择10个细胞进行荧光定量,荧光表达水平通过FV10-ASW 2.1 Viewer软件进行分析。
1.10 RT-PCR检测成骨分化关键基因表达水平
干预完成后,提取各组细胞中RNA并进行浓度测定。以20 μL的体系反转录合成cDNA,并进行实时荧光定量检测,反应条件:95 ℃变性1 min,[95 ℃ 10 s,57 ℃ 20 s,72 ℃ 20 s收集荧光]40个循环,熔解曲线制备65~95 ℃,0.5 ℃·s-1。
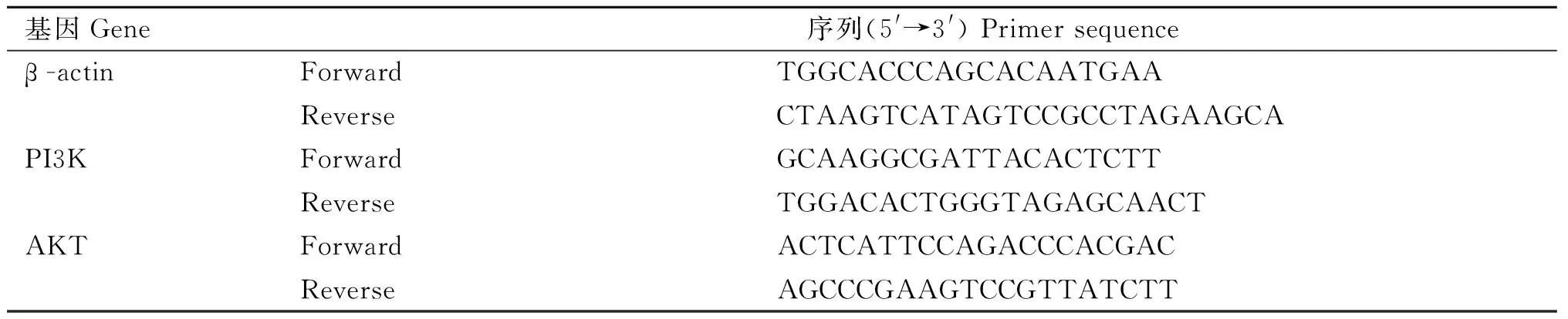
表1 RT-PCR检测成骨分化关键基因的引物序列Table 1 Primer sequences for detecting key genes for osteogenic differentiation by RT-PCR
1.11 统计学方法
2 结 果
2.1 黄芪对低氧环境中BMSCs增殖的影响
本研究首先观察不同浓度的黄芪冻干粉溶液对缺氧环境中BMSCs增殖的影响。通过高内涵成像系统24 h无标记动态监测,与Ctrl组细胞相比,M组细胞在各时间点数量明显减少(图1 A和B),细胞分化代数明显减少(图1C),差异有统计学意义(P<0.01);与M组相比,HQ-Z和HQ-G组细胞数量增多(图1、2),HQ-G组细胞分化代数增高(图1C),差异有统计学意义(P<0.05或0.01)。上述结果提示,黄芪冻干粉溶液具有逆转缺氧环境导致的BMSCs增殖能力下降的作用。
A. 不同干预条件下细胞实时动态增殖情况监测(24 h细胞无标记动态增殖情况,每3 h同视野成像记录,10×);B. 不同干预条件下细胞实时动态增殖情况统计;C. 24 h不同干预条件下细胞分化代数;n=3,*.P<0.05,**.P<0.01 A. Real time dynamic cell proliferation monitoring in different intervention conditions (24 hours of unmarked dynamic cell proliferation, recorded every 3 hours with the same field imaging, 10×); B. Real time dynamic cell proliferation statistics in different intervention conditions; C. Cell differentiation generation in different intervention conditions within 24 hours; n=3,*.P<0.05,**.P<0.01图1 黄芪对缺氧环境中BMSCs增殖的影响Fig.1 Effects of Astragalus membranaceus on the proliferation of BMSCs in hypoxic environments
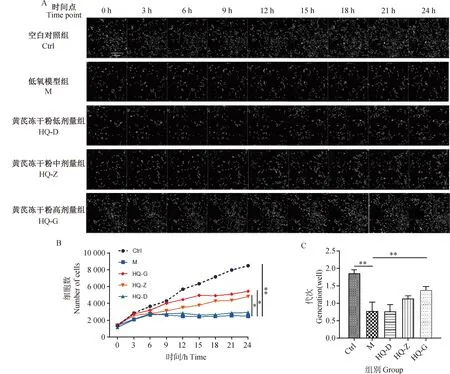
2.2 黄芪对低氧环境中BMSCs运动能力学影响
细胞运动能力是反映细胞活力的重要标志,本研究进一步对各干预条件下的细胞进行运动轨迹的示踪,并分析细胞在不同干预条件下的运动速度、位移距离和运动路程。与Ctrl组细胞相比,M组细胞运动速度、位移距离和总运动路程均明显减少(图2),差异有统计学意义(P<0.01);与M组相比,HQ-Z和HQ-G组细胞运动速度、位移距离和总运动路程均有所增加(图2),差异有统计学意义(P<0.05或0.01)。以上结果提示,缺氧环境导致BMSCs运动活力下降,而黄芪中、高剂量的黄芪冻干粉对缺氧环境中BMSCs的运动活力具有一定的保护作用。
A. 24 h不同干预条件下细胞运动轨迹示踪(细胞运动轨迹由计算机进行动态模拟,为区分单个细胞由不同颜色进行标记,40×);B. 24 h不同干预条件下细胞平均运动速度;C. 24 h不同干预条件下细胞位移距离;D. 24 h不同干预条件下细胞运动路程;n=3,*.P<0.05,**.P<0.01 A. Tracing of cell movement trajectory in 24 hour continuous intervention conditions (The trajectory of cell movement is dynamically simulated by computer, and different colors are used to distinguish individual cells, 40×); B. 24 h Mean motion speed of cells in different intervention conditions; C. Cell displacement distance in different intervention conditions within 24 hours; D. Cell movement distance in different intervention conditions within 24 hours; n=3,*.P<0.05,**.P<0.01图2 黄芪对低氧环境中BMSCs运动能力学影响Fig.2 Effects of Astragalus membranaceus on the movement ability of BMSCs in hypoxic environments
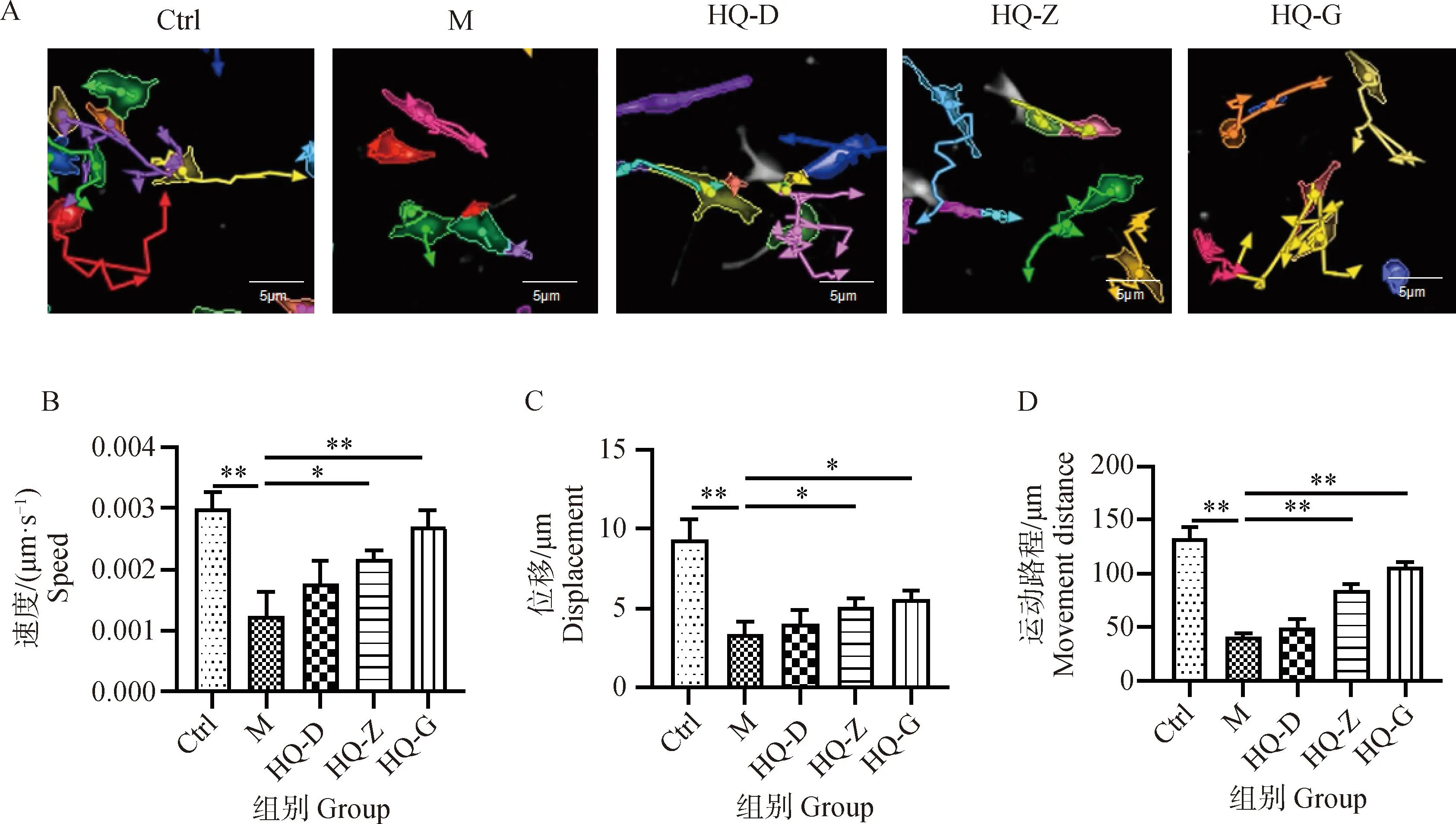
2.3 黄芪对低氧环境中BMSCs线粒体膜电位的影响
线粒体是为细胞提供能量的关键细胞器,缺氧易导致线粒体受损,并引起细胞的活力减弱,因此本研究通过JC-10荧光探针对线粒体膜电位的标记,来评价不同干预条件下线粒体的活性。当线粒体膜电位较高时,JC-10聚集在线粒体的基质中,形成聚合物,为橘红色荧光(594 nm);当线粒体膜电位降低时,JC-10不能聚集在线粒体基质中,此时JC-10为单体,主要为绿色荧光(488 nm)。Ctrl组细胞胞质中有大量橘红色JC-10聚合物,绿色JC-10单体较少;与Ctrl组细胞相比,M组细胞线粒体膜电位降低明显,细胞胞质中橘红色JC-10聚合物减少,绿色JC-10单体明显增多;与M组相比,HQ各剂量组细胞线粒体膜电位均有所升高,细胞胞质中橘红色JC-10聚合物增多,绿色JC-10单体减少(图3)。提示缺氧可能通过影响线粒体活性导致BMSCs增殖和运动状态异常,而黄芪冻干粉能够一定程度上维持缺氧环境中BMSCs线粒体活性。
2.4 黄芪对低氧环境中BMSCs p-PI3K和p-AKT蛋白荧光表达的影响
为了证实黄芪冻干粉溶液对BMSCs的调节作用是否与PI3K-AKT信号通路相关,本研究通过免疫荧光检测了通路中关键蛋白p-PI3K和p-AKT的荧光表达情况。与Ctrl组细胞相比,M组细胞对p-PI3K和p-AKT蛋白的荧光表达降低(图4、5);与M组相比,HQ各剂量组细胞p-PI3K和p-AKT蛋白的荧光表达升高,其中HQ-Z和HQ-G组升高更明显(P<0.05或0.01)(图4、5)。以上结果提示,缺氧条件抑制了PI3K-AKT信号通路中关键蛋白PI3K和AKT蛋白的磷酸化,而黄芪冻干粉溶液具有一定的逆转作用,因此,黄芪可能通过恢复PI3K-AKT信号通路的活化发挥对BMSCs的调节作用。但蛋白的磷酸化修饰不能完全代表信号通路的活化,仍然需要进一步检测。
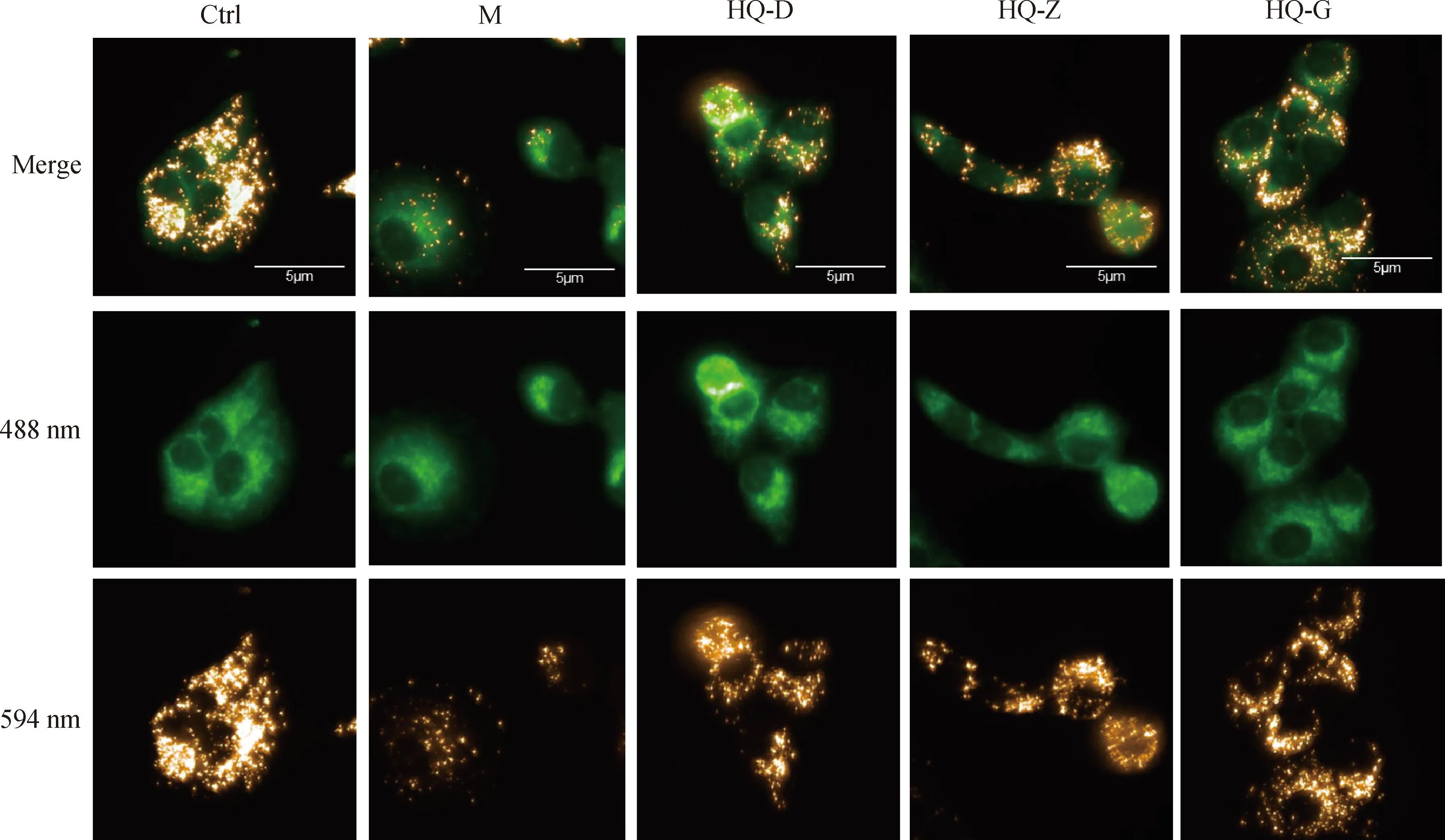
JC-10聚合物发橘红色荧光(594 nm),JC-10单体发绿色荧光(488 nm) JC-10 polymer emits orange red fluorescence (594 nm), while JC-10 monomer emits green fluorescence (488 nm)图3 不同干预条件下细胞线粒体膜电位情况(60×)Fig.3 Membrane potential of cell mitochondria under different intervention conditions (60×)
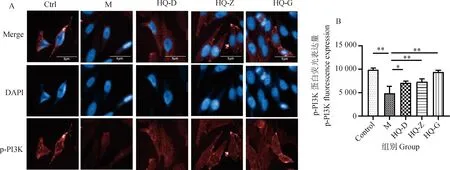
A. 不同干预条件下细胞p-PI3K蛋白荧光表达情况,细胞核用蓝色DAPI标记(405 nm),p-PI3K蛋白用AF 647标记(647 nm);B. 不同干预条件下细胞p-PI3K蛋白荧光表达值(n=3),*.P<0.05,**.P<0.01 A. Fluorescence expression of p-PI3K protein in cells under different intervention conditions, the nucleus was labeled with blue DAPI (405 nm), the p-PI3K protein was labeled with AF 647 (647 nm); B. Fluorescence expression values of p-PI3K protein in cells under different intervention conditions (n=3),*.P<0.05,**.P<0.01图4 黄芪对低氧环境中BMSCs p-PI3K蛋白荧光表达的影响Fig.4 The effect of Astragalus membranaceus on the fluorescence expression of p-PI3K protein in BMSCs in hypoxic environments
2.5 黄芪对低氧环境中BMSCs PI3K和AKT mRNA表达水平的影响
上述试验证实了黄芪冻干粉能够促进PI3K和AKT的磷酸化,提示黄芪冻干粉可能具有激活PI3K-AKT信号通路作用,为进一步验证,本研究进检测了黄芪冻干粉溶液对PI3K和AKT在转录水平的变化情况。与Ctrl组细胞相比,M组细胞PI3K和AKT mRNA水平降低(图6、7);但与M组相比,HQ各组细胞PI3K和AKT mRNA水升高(P<0.05或0.01)。以上结果提示,黄芪当干粉不仅能够促进PI3K和AKT的mRNA水平,还能促进其发生磷酸化,证明了黄芪冻干粉对PI3K-AKT信号通路的调节作用。
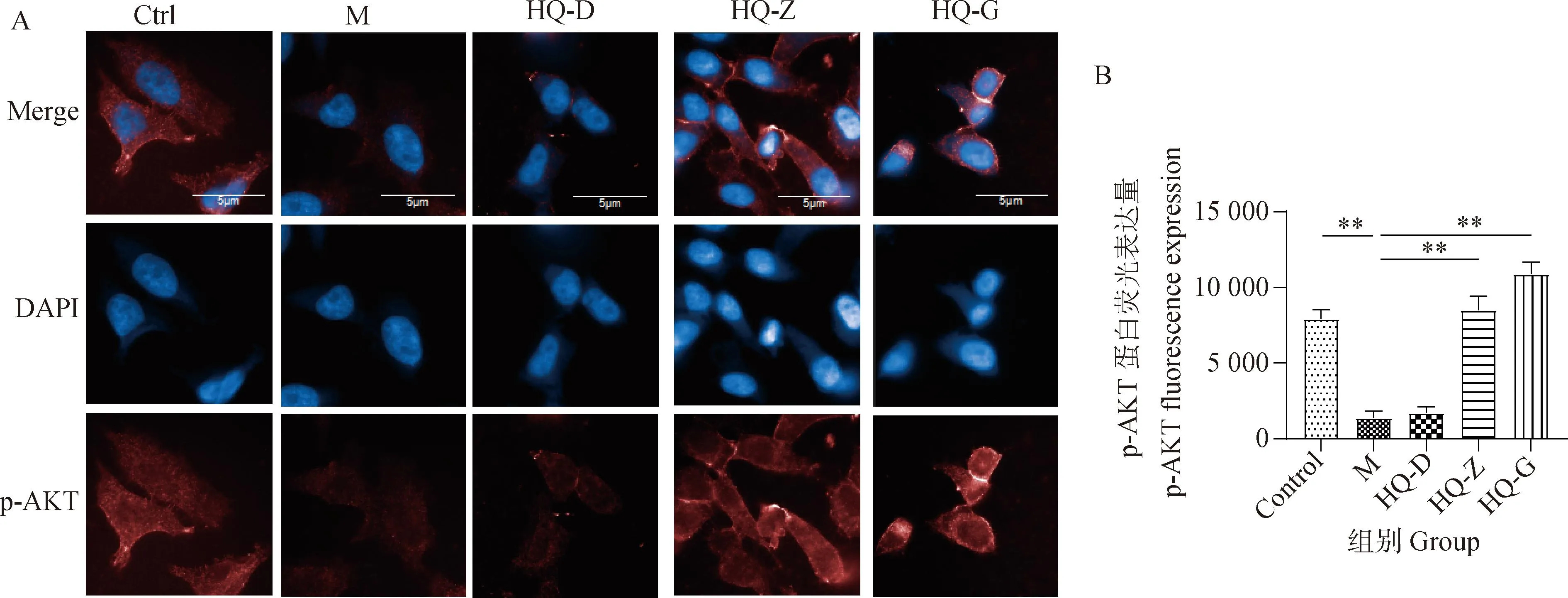
A. 不同干预条件下细胞p-AKT蛋白荧光表达情况;细胞核用蓝色DAPI标记(405 nm),p-AKT蛋白用AF 647标记(647 nm);B. 不同干预条件下细胞p-AKT蛋白荧光值(n=3),*.P<0.05,**.P<0.01 A. Fluorescence expression of p-AKT protein in cells in different intervention conditions, The nucleus was labeled with blue DAPI (405 nm); The p-AKT protein was labeled with AF 647 (647 nm); B. Fluorescence values of p-AKT protein in cells under different intervention conditions (n=3),*.P<0.05,**.P<0.01图5 黄芪对低氧环境中BMSCs p-AKT蛋白荧光表达的影响Fig.5 The effect of Astragalus membranaceus on the fluorescence expression of p-AKT protein in BMSCs in hypoxic environments
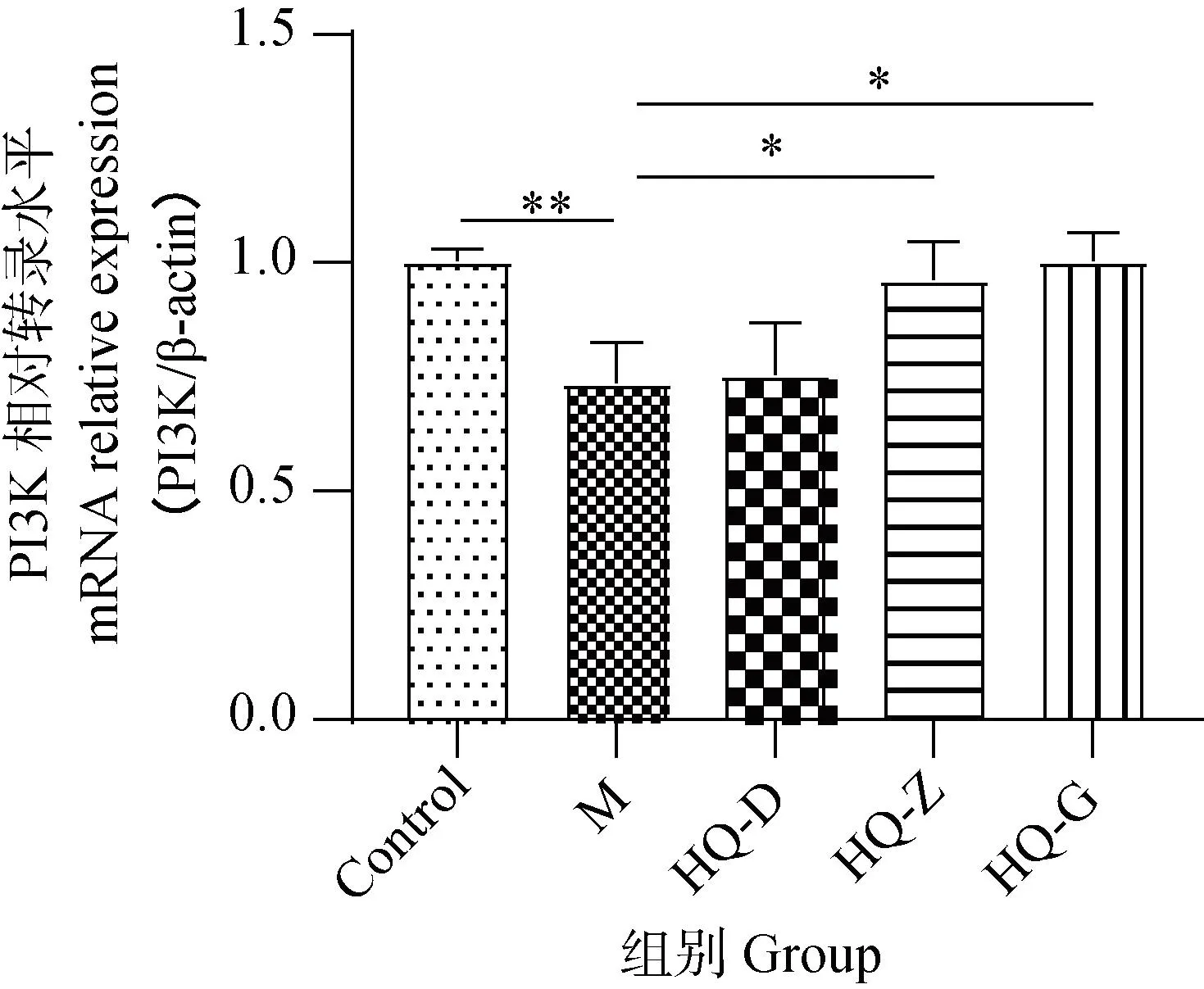
n=3,*.P<0.05,**.P<0.01图6 不同干预条件下细胞PI3K mRNA表达情况Fig.6 Expression of PI3K mRNA in cells under different intervention conditions
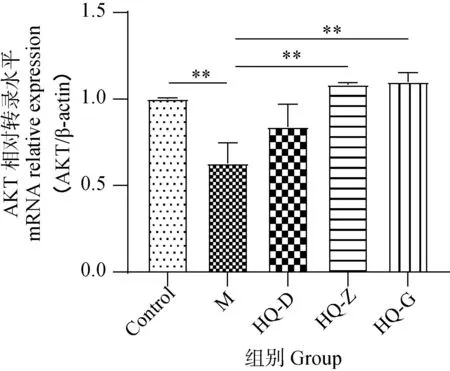
n=3,*.P<0.05,**.P<0.01图7 不同干预条件下细胞AKT mRNA表达情况Fig.7 Expression of AKT mRNA in cells under different intervention conditions
3 讨 论
课题组在前期研究中已经证实,缺氧会导致BMSCs的自我更新和多向分化的能力降低,本研究希望基于线粒体途径探讨黄芪在维护缺氧条件下的BMSCs增殖活性的作用。
黄芪作为补气类中药,具有健脾补中,升阳举陷,益卫固表的功效,对脾气亏虚等疾病具有很好的调节作用。现代研究也发现,黄芪及其有效成分针对缺氧所介导的相关疾病具有很好的防治作用。赵芳等[8]发现黄芪甲苷能通过calpain-1/NO信号通路改善慢性间歇性缺氧诱导血管内皮功能障碍;谢耀锟等[9]发现黄芪注射液可有效通过提升Bcl-2/Bax比值来抑制缺氧的神经细胞凋亡;黄芪多糖能够通过抑制KLF5/HIF-1α信号通路保护低氧诱导的肺动脉高压小鼠肺血管重构[10]。为了进一步探讨具有补气作用的黄芪是否对缺氧环境中的BMSCs的增殖活性具有保护作用,作者对BMSCs的增殖和运动情况进行了24 h的无标记动态监测,发现黄芪冻干粉溶液能够维持缺氧环境中BMSCs的增殖和运动的活性。
线粒体是细胞进行氧化代谢的主要细胞器,也是能量物质氧化释放能量的场所。线粒体负责的最终氧化的共同途径是三羧酸循环与氧化磷酸化,利用这些物质还原氧气释放能量合成ATP[11-12]。线粒体是产生能量维持细胞增殖的关键场所[13]。尽管前期已有研究发现黄芪注射液能够促进体外培养的hMSCs的增殖[14],但未对其调节机制有详细的阐明。本研究推测黄芪可能通过调节线粒体活性进而影响BMSCs的增殖和运动。通过线粒体膜电位检测发现,黄芪干预后线粒体活性明显增强,基本证实了作者的推测。
PI3K/AKT信号通路在缺氧引起的线粒体损伤过程中扮演者重要的角色[15-17]。有研究报道,血小板生成素通过活化PI3K/AKT通路稳定线粒体膜电位防止化学性缺氧所致的细胞凋亡作用[18];白扁豆多糖可通过PI3K/AKT信号转导通路稳定线粒体膜电位、抑制神经细胞的缺氧性凋亡[19]。本研究也发现,黄芪冻干粉溶液能够激活缺氧环境中的PI3K/AKT信号通路,因此,PI3K/AKT信号通路可能是黄芪稳定缺氧环境中BMSCs线粒体活性,维持其增殖稳定的主要机制。
尽管本研究证实了黄芪可以激活PI3K-AKT信号通路,同时维持缺氧环境中BMSCs增殖活性稳定,但是,PI3K-AKT信号通路是否是黄芪防护缺氧环境中BMSCs增殖活性的关键通路仍然需要通过敲减或过表达试验去进一步证实,但黄芪仍然值得被作为维护缺氧条件下干细胞生物稳定性的天然化合物进行深入的研究。
4 结 论
缺氧环境会导致BMSCs增殖和运动能力降低,而黄芪可能通过激活PI3K-AKT信号通路维持缺氧环境中BMSCs增殖活性稳定。



