谢青云,邢蕙萱,于岩飞,袁 厅,熊祺琰,熊富强,冯志新,3,4*
(1.江苏省农业科学院兽医研究所,农业农村部兽用生物制品工程重点实验室,南京 210014; 2.西藏农牧学院,动物科学学院,林芝 850400; 3.兽用生物制品(泰州)国泰技术创新中心,泰州 225300; 4.南京农学大学动物医学院,南京 210095)
由猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)感染引起的猪气喘病,是一种接触性慢性呼吸道传染病,全球范围内发病率高达38%~100%,给全球养猪产业造成严重的经济损失[1-2]。疫苗和抗生素联用是防治猪气喘病的主要方法,但并不能完全控制疾病发生,猪肺炎支原体的持续性感染问题频发[3]。普遍认为,病原微生物逃避宿主免疫监测和控制是导致其持续性感染的主要诱因[4],而同源重组介导的抗原变异是支原体逃避宿主免疫系统的重要途径之一[5-7]。
据报道,原核微生物的同源重组首先由RecBCD多酶系统发起同源重组事件,再经RecA催化同源DNA序列的置换反应,形成一种称为霍利迪连接体(holliday junctions,HJs)的交叉链中间体[8-10];接着,RuvABC多酶系统利用水解ATP供能催化HJs分支迁移(branch migration),进而形成成熟的重组双链DNA分子。研究表明,DNA解旋酶RuvA和RuvB专一性催化HJs的分支迁移与解离是同源重组的关键步骤,并且在多种病原体的抗原变异中扮演重要角色[4,11-12]。例如,针对淋球菌Pilin基因抗原变异突变株的基因筛选鉴定研究发现,RuvA和RuvB是介导淋球菌Pilin基因抗原变异的必需基因[13]。
RuvA最初于大肠杆菌中发现,属于SF6解旋酶超家族中的一员。它作为紫外光敏感突变体之一被命名为Ruv, 继而又根据对萘啶酸的敏感性以及微量琼脂或泛酰内酯对紫外线照射细胞存活的影响,进一步细分为RuvA和RuvB[14]。普遍认为,原核微生物的同源重组机制相对保守。但是,对解旋酶RuvA体外生化活性研究发现,不同病原体中RuvA的生物活性存在差异。例如:大肠杆菌RuvAE.coli对HJs的亲和力是双链DNA的20倍[15];肺炎支原体RuvAMpn对HJs和单链DNA(single strand DNA,ssDNA)具有相似亲和力,而生殖支原体RuvAMge对HJs的亲和力更高[16-17];RuvAMge、RuvAMpn和RuvAE.coli均能够与ssDNA形成一种复合物,而RuvAMpn和RuvAE.coli能够与HJs形成两种不同的复合物,RuvAMge只能与HJs形成一种复合物[16-18]。目前,解析RuvAMhp生化活性的研究仍是空白。
鉴于此,本研究主要针对RuvAMhp基因进行原核表达、DNA结合活性鉴定及多克隆抗体制备,为深入探索RuvA调解同源重组介导猪肺炎支原体抗原变异的分子机制提供生物学材料并奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 生物样本来源E.coliDH5α、E.coliBL21(DE3)购自北京擎科生物科技有限公司;pET21a载体购自生工生物工程股份有限公司;猪肺炎支原体168-L株由江苏省农业科学院兽医研究所保存;新西兰大白兔由江苏省农业科学院实验动物中心黄梅基地提供。
1.1.2 主要试剂 限制性核酸内切酶NdeⅠ和XhoⅠ购自 NEB 公司;琼脂糖凝胶回收试剂盒和质粒小提试剂盒购自OMEGA公司;PrimeSTAR HS DNA聚合酶购自TaKaRa公司;无缝克隆试剂盒和点突变试剂盒购自南京诺唯赞生物有限公司;Histrap HP层析柱购自GE Healthcare公司;5×SDS-PAGE上样缓冲液、Bradford蛋白浓度定量试剂盒和TMB显色液购自上海碧云天生物技术有限公司;超滤离心管购自Millipore公司。
1.1.3 主要仪器 PTC-100 PCR扩增仪(MJ-Research);TGL-16 G-A型高速冷冻离心机(上海安亭科学仪器厂);SHZ-82A恒温震荡培养器;PTC-100 PCR扩增仪(MJ-Research);超声波细胞破碎仪(宁波新芝生物科技股份有限公司);DYCZ-24垂直电泳仪(北京六一);Typhoon多功能激光扫描成像仪(GE Healthcare);SUNRISE触摸屏酶标仪(TECAN);蛋白电泳仪和半干转印仪(Bio-Rad)。
1.2 试验方法
1.2.1 引物的设计与合成 以Mhp168-L RuvA(Gene ID: 57101295)的基因序列为模板,参照无缝克隆试剂盒引物设计方案设计特异性扩增引物(表1),同源臂和酶切位点(NdeⅠ:5′CATATG3′;XhoⅠ:5′CTCGAG3′)分别以下划线和斜体表示。值得注意的是,RuvAMhp氨基酸序列中的Trp103由在原核表达系统中为终止子的密码子TGA编码,因此需要参照点突变试剂盒设计方案设计突变引物RuvAMhp-TGA-F和RuvAMhp-TGA-R,将307TGA309突变为TGG。上述引物均由金斯瑞科技有限公司合成。

表1 引物序列Table 1 Primer sequences
1.2.2 重组质粒pET21a-RuvAMhp的构建 参照OMEGA质粒小提试剂盒说明书,提取Mhp168-L全基因组DNA。以Mhp168-L全基因组DNA为模板,利用引物RuvAMhp-F、 RuvAMhp-R和PrimeSTAR HS DNA聚合酶扩增目的片段。利用1%琼脂糖凝胶电泳检测PCR产物,大小约为672 bp。参照无缝克隆试剂盒说明书,利用经琼脂糖凝胶回收试剂盒纯化后的PCR产物和线性化pET21a载体(NdeⅠ和XhoⅠ双酶切)构建pET21a-RuvAMhp-TGA重组质粒。转化重组质粒至E.coliDH5α,37 ℃固定培养18 h后,挑取单克隆送至生工生物工程股份有限公司测序。参照点突变试剂盒说明书,以测序成功的pET21a-RuvAMhp-TGA重组质粒为模板,利用引物RuvA-TGA-F、RuvA-TGA-R构建pET21a-RuvAMhp重组质粒。PCR和双酶切验证pET21a-RuvAMhp重组质粒。转化pET21a-RuvAMhp至E.coliDH5α,37 ℃固定培养18 h后,挑取单克隆送至生工生物工程股份有限公司测序。
1.2.3 重组蛋白RuvA的表达与纯化 转化测序成功的pET21a-RuvAMhp重组质粒至E.coliBL21(DE3)中,37 ℃固定培养18 h后挑取单克隆接种于5 mL LB液体培养基中(含100 μg·mL-1氨苄青霉素),37 ℃、180 r·min-1振荡培养18 h。表达方式鉴定:取新鲜培养的菌液以1∶100接种于20 mL液体LB培养基中(含100 μg·mL-1氨苄青霉素),37 ℃、180 r·min-1振荡培养3 h。取2 mL菌液离心收集沉淀,1 mL PBS重悬后作为未诱导对照;以0.5 mmol·L-1IPTG诱导RuvAMhp重组蛋白表达,16 ℃、120 r·min-1振荡培养18 h,取2 mL菌液离心收集沉淀,1 mL PBS重悬后作为诱导后全菌;剩余菌液离心后收集菌体,1.5 mL PBS重悬后于冰上超声破碎10 min,11 000 r·min-1离心15 min收集上清为诱导后上清样品;10 mL PBS重悬沉淀为诱导后沉淀样品。通过SDS-PAGE鉴定蛋白的表达形式。大量表达:取新鲜培养的菌液以1∶100接种于2 L液体LB培养基中(含100 μg·mL-1氨苄青霉素),37 ℃、180 r·min-1振荡培养3 h后以0.5 mmol·L-1IPTG诱导RuvAMhp重组蛋白表达。16 ℃、120 r·min-1振荡培养18 h后收集菌体。100 mL上柱缓冲液(20 mmol·L-1HEPES pH 8.0,10 mmol·L-1咪唑,300 mmol·L-1NaCl,2%甘油,1% NP-40)重悬菌体于冰上超声破碎40 min,11 000 r·min-1离心30 min收集上清。纯化:利用Histrap HP层析柱纯化RuvAMhp重组蛋白,依次用300 mL清洗缓冲液(20 mmol·L-1HEPES pH 8.0,50 mmol·L-1咪唑,300 mmol·L-1NaCl,2%甘油,1% NP-40)和100 mL洗脱缓冲液(20 mmol·L-1HEPES pH 8.0,250 mmol·L-1咪唑,300 mmol·L-1NaCl,2%甘油)洗脱杂蛋白和目的蛋白。利用SDS-PAGE鉴定纯化后RuvAMhp重组蛋白纯度。储存液(20 mmol·L-1HEPES pH 8.0,100 mmol·L-1NaCl,5%甘油)透析浓缩、Bradford蛋白浓度定量试剂盒测定浓度。
1.2.4 兔抗RuvAMhp多克隆抗体制备 选取经ELISA方法确定Mhp血清抗体阴性的新西兰大白兔进行试验。RuvAMhp重组蛋白与等体积的弗氏完全佐剂混合乳化作为免疫原(2 mg·mL-1),采用背部皮下多点注射法(1 mg·只-1)对所选动物进行首次免疫;RuvAMhp重组蛋白与等体积的弗氏不完全佐剂混合乳化作为免疫原(2 mg·mL-1),以同样的方法依次对免疫后动物进行第二次和第三次免疫。首免、二免、三免间隔两周。三次免疫一周后心脏采血,检测抗体效价。
1.2.5 兔抗RuvAMhp多克隆抗体效价的测定 用RuvAMhp重组蛋白包被ELISA板,包被浓度为1 μg·mL-1。用PBS按1∶1 000~1∶128 000梯度稀释制备的兔抗RuvAMhp多克隆抗体,100 μL·孔-1添加至RuvAMhp包被板中,37 ℃孵育2 h后,PBST(PBS pH 7.4,0.05%吐温20)洗涤3次;5 000倍稀释HRP标记的山羊抗兔IgG,100 μL·孔-1添加至包被板中,37 ℃孵育1 h后,PBST洗涤3次;添加100 μL·孔-1TMB显色液至包被板中,37 ℃显色10 min,再加入50 μL终止液,酶标仪检测OD450 nm。设置免疫前的兔血清为阴性对照,PBS为空白对照,以免疫后血清OD450 nm值/阴性对照血清OD450 nm值≥2.1为阳性判定标准。
1.2.6 兔抗RuvAMhp多克隆抗体Western blot鉴定 RuvAMhp重组蛋白、牛血清蛋白(BSA)、猪肺炎支原体烯醇化酶(Enolase,EnoMhp)、以及诱导后pET21a-RuvAMhp全菌和pET21a空载全菌经12% SDS-PAGE电泳后,利用半干转印仪转印到PVDF膜上,封闭液(PBS pH 7.4,5%脱脂乳)室温封闭2 h;用PBST按2 000稀释制备的兔抗RuvAMhp多克隆抗体作为一抗,4 ℃过夜孵育;PBST洗涤5次,用10 000倍稀释(稀释液:PBST,5%脱脂乳)的山羊抗兔HRP抗体作为二抗,室温震荡孵育2 h;PBST洗涤5次,ECL显影。
1.2.7 DNA底物的设计与构建 设计22 nt(S4-1)和44 nt(S4)的DNA序列用于测定RuvAMhp重组蛋白的DNA结合活性;设计4条44 nt(S1、S2、S3和S4)的DNA序列用于退火构建结构(HJs,臂长22 bp)。退火体系:20 mmol·L-1HEPES pH 8.0,100 mmol·L-1NaCl,各2 μmol·L-1的S1、S2、S3和S4;PCR上95 ℃处理2 min,再以每8 s下降0.1 ℃降至25 ℃。上述DNA序列均由南京金斯瑞生物科技有限公司合成,具体序列见表2。

表2 底物DNA序列Table 2 Substrate DNA sequence
1.2.8 DNA结合活性的鉴定 利用凝胶迁移试验(electrophoretic mobility shift assay,EMSA)体外分析RuvAMhp重组蛋白的DNA结合活性。通过检测RuvAMhp重组蛋白与底物S4-1和S4的结合情况,分析序列长度对RuvAMhpDNA结合活性的影响;通过检测RuvAMhp重组蛋白与四链DNA底物的结合情况鉴定RuvAMhp的HJs结合活性。每10 μL的反应体系含20 mmol·L-1Tris-HCl (pH 7.5)、1 mmol·L-1DTT、1 mmol·L-1EDTA、15 nmol·L-1荧光标记的DNA底物和不同浓度的RuvAMhp重组蛋白;置于冰上孵育10 min后加入4 μL上样缓冲液(50%甘油);经8% Native-PAGE恒压(220V)电泳3 h后,利用Typhoon多功能激光扫描成像仪显影(Cy3激发)。利用表面等离子共振技术(SPR)分析RuvAMhp重组蛋白对四链DNA底物的亲和力。具体操作如下:20 ℃反应条件下,通过链霉亲和素-生物素反应将四链DNA底物固定在传感芯片(SA芯片)表面,将浓度范围为8~256 nmol·L-1的RuvAMhp重组蛋白以恒定流速流过包被芯片表面,实时检测芯片上的互作信号。
1.2.9 寡聚特征的鉴定 利用EMSA结合Western blot体外分析RuvAMhp重组蛋白的寡聚特性。每10 μL的反应体系含20 mmol·L-1Tris-HCl (pH 7.5)、1 mmol·L-1DTT、1 mmol·L-1EDTA、15 nmol·L-1荧光标记的四链DNA底物和不同浓度的RuvAMhp重组蛋白;置于冰上孵育10 min后加入4 μL上样缓冲液;8% Native-PAGE电泳结束后转印至PVDF膜上;参照“1.2.6”中的试验流程进行Western blot检测。
2 结 果
2.1 RuvAMhp基因的扩增及表达载体构建
对构建的pET21a-RuvAMhp重组质粒进行PCR鉴定,获得了单一的特异性扩增条带,片段大小约为672 bp,与RuvAMhp基因长度相符(图1)。利用NdeⅠ和XhoⅠ双酶切鉴定pET21a-RuvAMhp重组质粒,获得大小约672 bp的目的基因片段和5 000 bp左右的载体片段,结果与预期大小相符(图2)。上述结果表明,pET21a-RuvAMhp重组质粒构建成功。
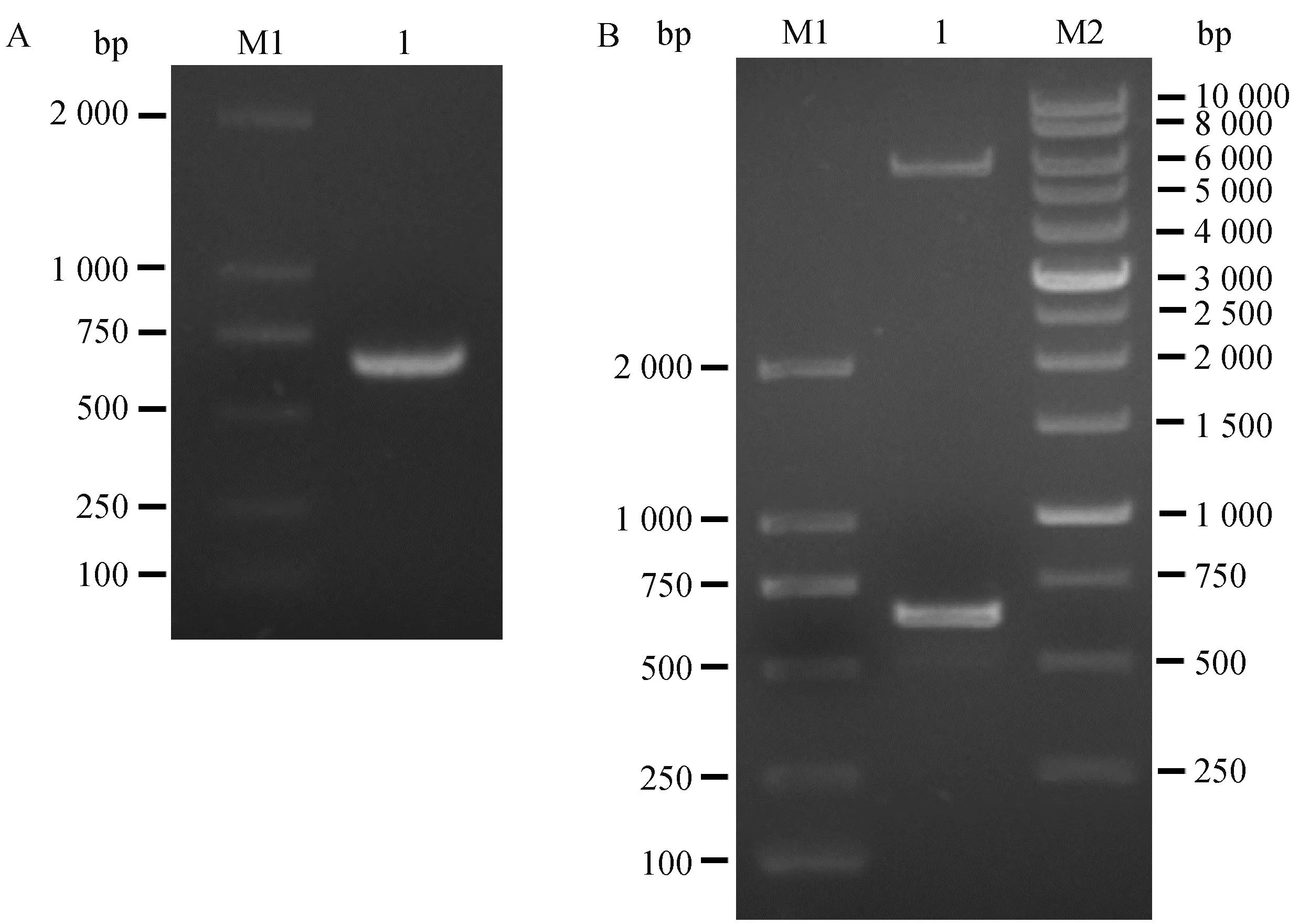
A. RuvAMhp基因的PCR扩增结果(M1. 2000 bp DNA相对分子质量标准;1. pET21a-RuvAMhp重组质粒扩增产物);B. pET21a-RuvAMhp双酶切鉴定结果(M1. 2000 bp DNA分子质量标准;M2. 10000 bp DNA相对分子质量标准;1. pET21a-RuvAMhp重组质粒双酶切产物) A. PCR amplification results of RuvAMhp gene (M1. 2000 bp DNA relative molecular weight standard; 1. pET21a-RuvAMhp recombinant plasmid amplification product); B. Identification results of pET21a-RuvAMhp double enzyme digestion (M1. 2000 bp DNA molecular weight standard; M2. 10000 bp DNA relative molecular weight standard; 1. pET21a-RuvAMhp recombinant plasmid double cut product)图1 pET21a-RuvAMhp重组质粒鉴定Fig.1 Identification of pET21a-RuvAMhp recombinant plasmid
2.2 pET21a-RuvAMhp重组质粒的表达形式鉴定
利用测序正确的pET21a-RuvAMhp重组质粒在E.coliBL21(DE3)中以0.5 mmol·L-1IPTG诱导RuvAMhp重组蛋白表达。设置未添加IPTG的菌液作为未诱导对照。诱导后的菌液经超声破碎,高速离心分别收集上清和沉淀,通过SDS-PAGE鉴定RuvAMhp重组蛋白的表达形式。结果如图2所示,与未诱导对照相比,pET21a-RuvAMhp可经IPTG诱导表达RuvAMhp重组蛋白(泳道1和2);RuvAMhp重组蛋白集中在上清中大量表达(泳道3和4)。
2.3 RuvAMhp重组蛋白的表达纯化
原核表达2 L的 RuvAMhp重组蛋白菌液,经超声破碎收集上清。利用Histrap HP层析柱纯化RuvAMhp重组蛋白,融合His标签的RuvAMhp重组蛋白结合至层析柱上,再经含250 mmol·L-1咪唑的洗脱缓冲液竞争性洗脱。利用SDS-PAGE鉴定纯化后RuvAMhp重组蛋白纯度。结果如图3(A)所示,洗脱液中含有大量相对分子质量约为26 ku、条带单一的重组蛋白,与RuvAMhp预期大小一致。收集图3(A)中4~7泳道的洗脱液,利用Bradford蛋白浓度定量试剂盒测定经透析浓缩后的RuvAMhp重组蛋白,最终获得浓度为12.6 mg·mL-1的RuvAMhp重组蛋白,结果如图3(B)所示。
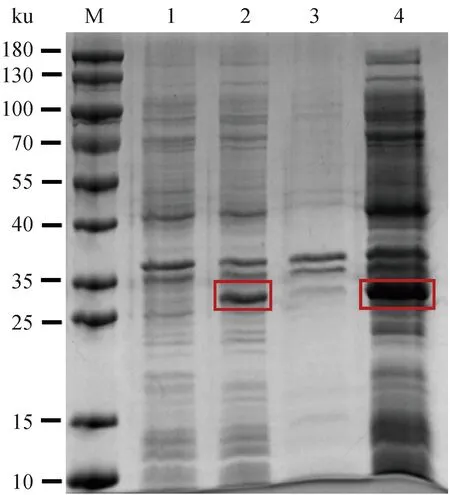
M. 180 ku蛋白相对分子质量标准;1. 未诱导对照;2. 诱导后全菌;3. 诱导后破碎沉淀;4. 诱导后破碎上清;红色方框指示RuvAMhp重组蛋白条带位置 M. 180 ku protein marker; 1. Uninduced control; 2. Induced whole bacteria; 3. Induced crushing and sedimentation; 4. Crush the supernatant after induction; The red box indicates the position of the RuvAMhp recombinant protein band图2 RuvAMhp重组蛋白的表达形式鉴定Fig.2 Expression identification of RuvAMhp recombinant protein
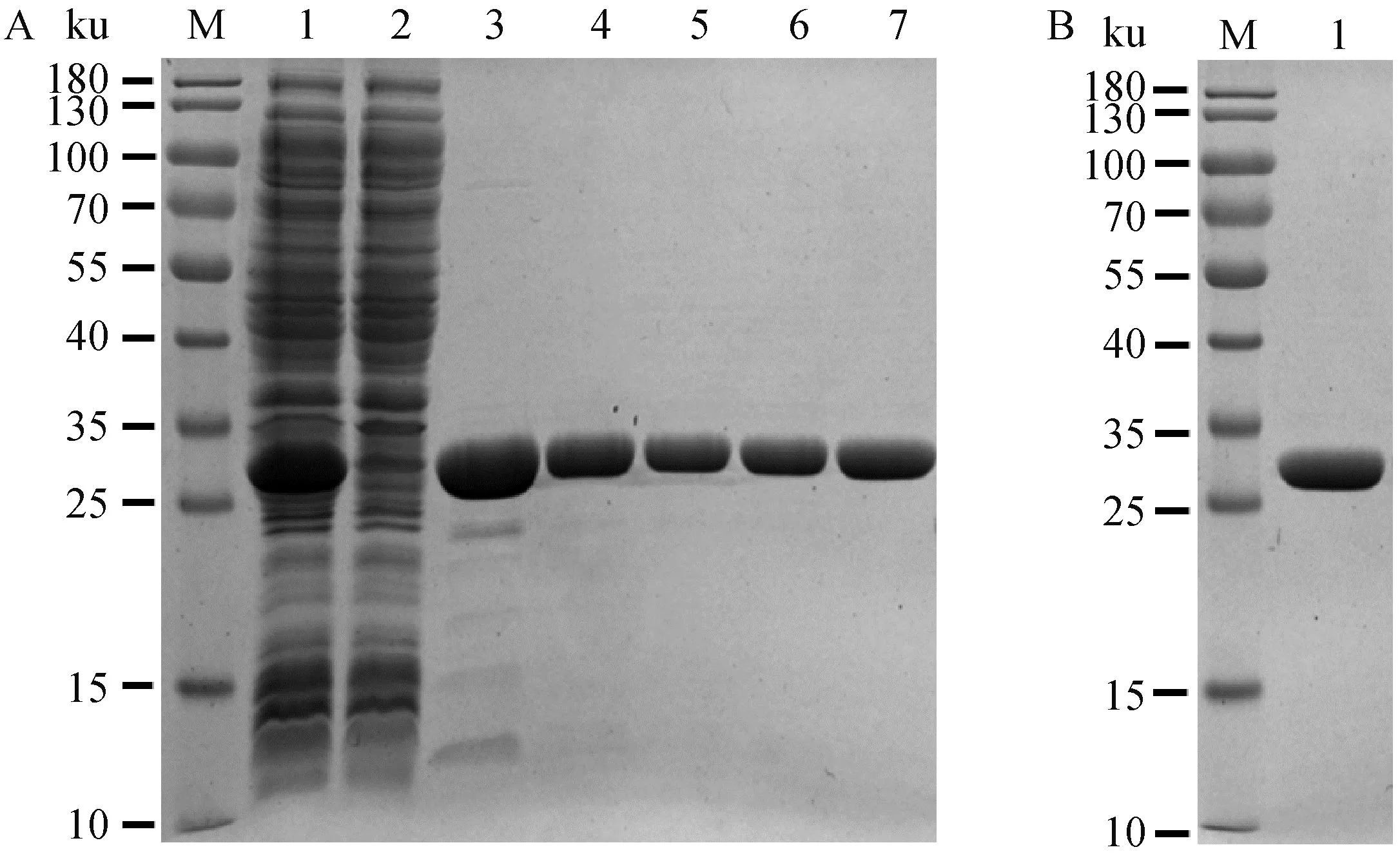
A. RuvAMhp重组蛋白的Histrap HP层析柱纯化结果(M. 180 ku蛋白相对分子质量标准;1. 诱导表达后上清;2. 上清过柱流穿液;3~7. 洗脱液洗脱蛋白);B. RuvAMhp重组蛋白的透析脱盐结果(M. 180 ku蛋白相对分子质量标准;1. RuvAMhp重组蛋白) A. Purification results of RuvAMhp recombinant protein by Histrap HP chromatography column (M. 180 ku protein relative molecular weight Standard; 1. Induce expression in the supernatant; 2. The upper cleaning column flows through the liquid; 3-7. Elution solution for protein elution); B. Dialysis desalination results of RuvAMhp recombinant protein (M. 180 ku protein relative molecular weight standard; 1. RuvAMhp recombinant protein)图3 RuvAMhp重组蛋白的纯化SDS-PAGE结果Fig.3 SDS-PAGE identification of purified RuvAMhp recombinant protein
2.4 兔抗RuvAMhp多克隆抗体的鉴定
在新西兰大白兔完成免疫程序后,获得兔抗RuvAMhp多克隆抗体,采用间接ELISA法检测多克隆抗体效价(表3)。结果表明,制备的兔抗RuvAMhp多克隆抗体效价达到1∶256 000以上。利用Western blot试验验证制备的兔抗RuvAMhp多克隆抗体的特异性,结果如图4所示,仅只有RuvAMhp重组蛋白和pET21a-RuvAMhp诱导后全菌出现单一的特异性免疫条带,兔抗RuvAMhp多克隆抗体与无关蛋白对照BSA和EnoMhp、以及pET21a空载全菌不存在交叉反应。上述结果表明特异性好、效价高的兔抗RuvAMhp多克隆抗体制备成功。
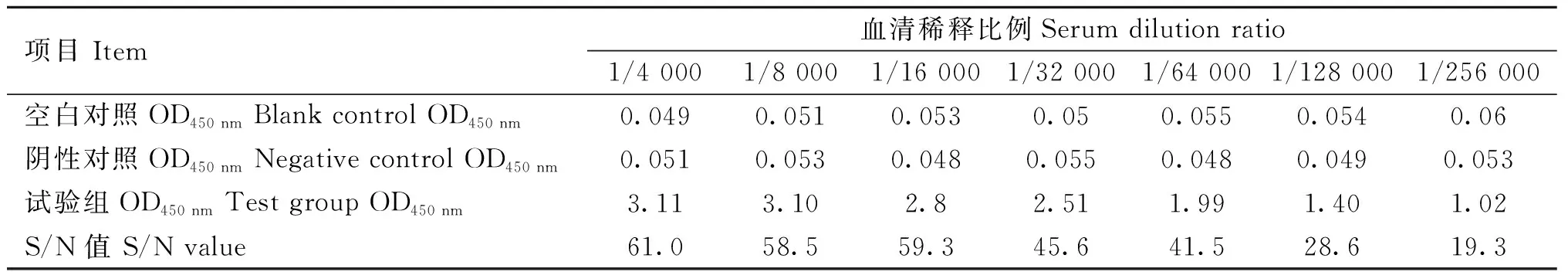
表3 ELISA方法测定兔抗RuvAMhp多克隆抗体效价Table 3 ELISA method for determining the titers of rabbit anti RuvAMhp polyclonal antibodies

M. 180 ku蛋白相对分子质量标准;1. RuvAMhp重组蛋白;2. BSA;3. EnoMhp重组蛋白;4. pET21a空载全菌;5. pET21a-RuvAMhp全菌 M. 180 ku protein marker; 1. RuvAMhp recombinant protein; 2. BSA; 3. EnoMhp recombinant protein; 4. pET21a whole bacteria; 5. pET21a-RuvAMhp whole bacteria图4 Western blot分析兔抗RuvAMhp多克隆抗体的特异性Fig.4 Western blot analysis of the specificity of rabbit polyclonal antibody against RuvAMhp
2.5 RuvAMhp重组蛋白的DNA结合活性分析
利用EMSA体外分析RuvAMhp重组蛋白的DNA结合活性。通过检测RuvAMhp重组蛋白与底物S4和S4-1的结合情况,分析序列长度对RuvAMhpDNA结合活性的影响。结果如图5所示,泳道1为不添加RuvAMhp重组蛋白的空白对照,指示单链DNA的位置;泳道2~9为按照2倍浓度梯度添加RuvAMhp重组蛋白的试验组,可以看出:RuvAMhp与单链DNA形成两种复合物:RuvAMhp-ssDNA-I和RuvAMhp-ssDNA-II;底物S4和底物S4-1与RuvAMhp形成复合物的最低试验浓度分别为4和8 μmol·L-1,并且添加的RuvAMhp浓度越高,形成的高分子量RuvAMhp-ssDNA复合物的产物越多;单链DNA底物长度越长,形成高分子量RuvAMhp-ssDNA复合物的产物也越多。
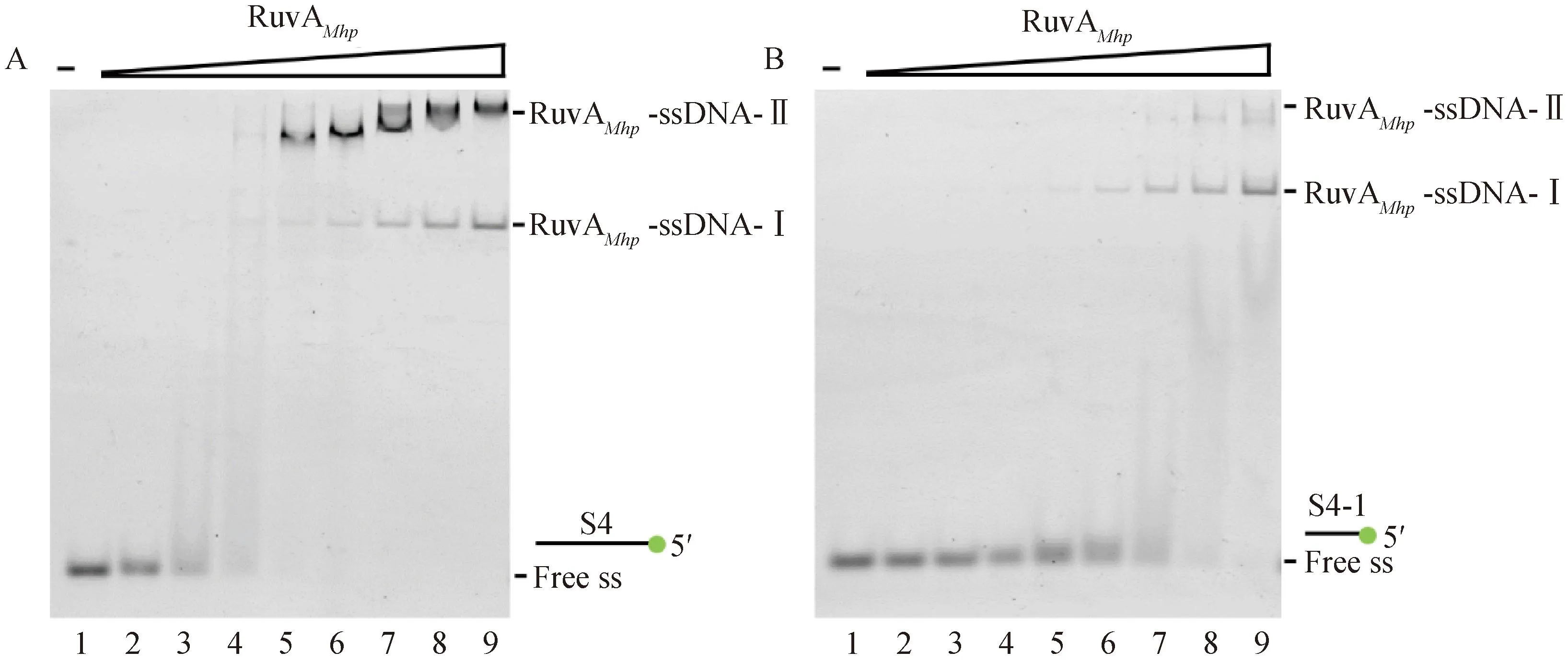
A. RuvAMhp重组蛋白与44 nt单链DNA底物S4互作的EMSA结果;B. RuvAMhp重组蛋白与22 nt单链DNA底物S4-1互作的EMSA结果;1. 未添加RuvAMhp重组蛋白对照;2~9. 添加的RuvAMhp重组蛋白浓度分别为1、2、4、8、16、32、64、128 μmol·L-1 A. EMSA results of the interaction between RuvAMhp and 44 nt single stranded DNA substrate S4; B. EMSA results of the interaction between RuvAMhp and 22 nt single stranded DNA substrate S4-1; 1. No RuvAMhp control; 2-9. The concentrations of added RuvAMhp recombinant proteins are 1, 2, 4, 8, 16, 32, 64, and 128 μmol·L-1, respectively图5 EMSA分析RuvAMhp重组蛋白的DNA结合活性Fig.5 EMSA analysis of DNA binding activity of RuvAMhp recombinant protein
确定了RuvAMhp重组蛋白的DNA活性后,作者再次利用EMSA体外分析了与四链DNA底物的结合情况。该底物模拟了同源重组进程中的关键核酸产物霍利迪连接体(HJs)的结构。结果如图6A所示,泳道1为不添加RuvAMhp重组蛋白的空白对照,指示四链DNA底物的位置;泳道:13为底物95 ℃处理组,指示单链DNA位置;泳道2~12为按照2倍浓度梯度添加RuvAMhp重组蛋白的试验组,可以看出:0.5 μmol·L-1及以上浓度的RuvAMhp重组蛋白即可与四链DNA底物形成一种RuvAMhp-HJs复合物,并且RuvAMhp浓度越高,高分子量RuvAMhp-HJs复合物产量越多。与图5对比可知,RuvAMhp对四链DNA底物的亲和力强于单链DNA。
为了明确RuvAMhp对四链DNA底物的亲和力大小,利用SPR分析了RuvAMhp重组蛋白与四链DNA底物结合动力学曲线。结果如图6B所示,RuvAMhp对四链DNA底物表现出了显着的亲和力,亲和力系数KD值为624.4 pmol·L-1。
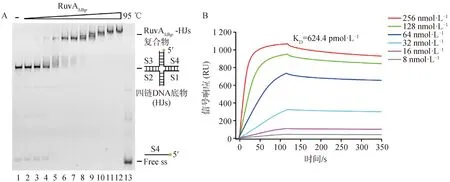
A. RuvAMhp重组蛋白与四链DNA底物互作的EMSA结果(1. 未添加RuvAMhp重组蛋白对照;2~12. 添加的RuvAMhp重组蛋白浓度分别为0.125、0.25、0.5、1、2、4、8、16、32、64、128 μmol·L-1;13. 95 ℃处理对照);B. RuvAMhp重组蛋白与四链DNA底物互作的SPR结果 A. EMSA results of the interaction between RuvAMhp and quadruplex DNA substrate (1. No RuvAMhp control; 2-12. The concentrations of added RuvAMhp were 0.125, 0.25, 0.5, 1, 2, 4, 8, 16, 32, 64, 128 μmol·L-1, respectively; 13. 95 ℃ treatment control); B. SPR results of the Interaction between RuvAMhp and four stranded DNA substrates图6 RuvAMhp重组蛋白的四链DNA底物(HJs)结合活性分析Fig.6 Analysis of four-strand DNA substrate (HJs) binding activity of RuvAMhp recombinant protein
2.6 RuvAMhp重组蛋白的寡聚特性分析
利用EMSA结合Western blot体外分析RuvAMhp重组蛋白的寡聚特性。结果如图7所示,泳道1为不添加RuvAMhp重组蛋白的空白对照;泳道2~3为按照2倍浓度梯度添加RuvAMhp重组蛋白的试验组,最终形成的寡聚产物条带主要集中在200 ku左右,RuvAMhp重组蛋白的分子量约为26 ku(图4),提示RuvAMhp主要以八聚体形式与四链DNA底物形成稳定复合物。
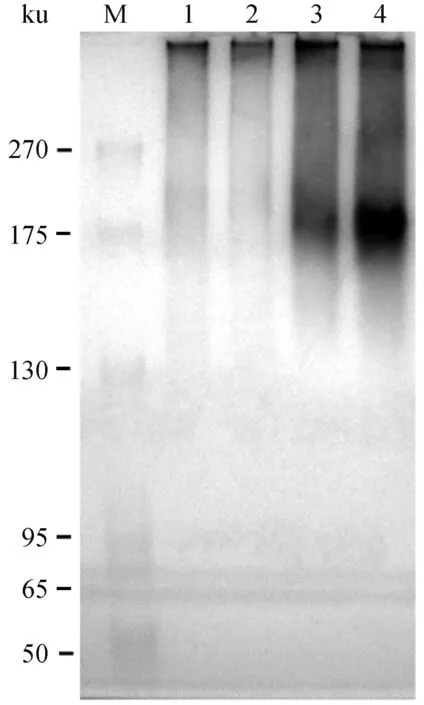
M. 180 ku蛋白相对分子质量标准;1. 未添加RuvAMhp重组蛋白对照;2~4. 添加的RuvAMhp重组蛋白浓度分别为1、2、4 μmol·L-1 M. 180 ku protein marker; 1. No RuvAMhp control; 2-4. The concentrations of added RuvAMhp were 1, 2, 4 μmol·L-1, respectively图7 RuvAMhp重组蛋白的寡聚特征分析Fig.7 Analysis of the oligomerization characteristics of RuvAMhp recombinant protein
3 讨 论
支原体在宿主免疫系统施加的外部压力和抗生素药物的使用下不断进化,导致持续性感染问题频发。普遍认为,病原微生物逃避宿主免疫监测和控制的最常见策略是抗原变异,如支原体、奈瑟菌、螺旋体和流感病毒等[4]。研究发现,猪肺炎支原体中具有DNA重复元件(可变数目串联重复序列,VNTR)的基因会发生序列长度变异[19-20],而同源重组被认为是介导上述变异的诱因之一[7,21]。在原核微生物中,DNA解旋酶RuvA在同源重组中作为连接结合的特异性因子,为其它重组相关蛋白的组装提供支架,并积极参与HJs的分支迁移和解离反应[22]。猪肺炎支原体基因组大小在580~1 350 kb,可编码600多个蛋白,大约为大肠杆菌的1/5~1/4[7]。受限于基因组的含量,猪肺炎支原体仅具备一个基本完整的DNA重组修复系统。目前,在GenBank公布的所有猪肺炎支原体菌株序列中,上述参与原核微生物同源重组的酶仅鉴定出RuvA和RuvB。本研究以RuvAMhp为研究对象,原核表达了全长RuvAMhp重组蛋白,并利用EMSA结合SPR试验和Western blot体外分析了其DNA结合活性与寡聚特征。
本研究建立的RuvAMhp原核表达体系表达量高,经Histrap HP层析柱纯化后产量可达25 mg·L-1(图3)。利用该重组蛋白制备的兔抗RuvAMhp多克隆抗体特异性好,与无关蛋白对照牛血BSA和EnoMhp,以及转化pET21a空载的全菌蛋白不存在交叉反应(图6);效价高,可达1∶256 000以上(表3)。RuvAMhp重组蛋白的DNA结合活性鉴定结果表明,与肺炎支原体RuvAMpn和生殖支原体RuvAMge一样,RuvAMhp对ssDNA和HJs都具有较强的结合活性。不同于RuvAMpn与RuvAE.coli与HJs形成两种复合物,与ssDNA形成一种复合物[16];RuvAMge与ssDNA和HJs均形成一种复合物[16];EMSA结果显示RuvAMhp可与ssDNA形成两种RuvAMhp-ssDNA复合物,而与HJs仅形成一种RuvAMhp-HJs复合物(图5、6)。据报道,RuvAE.coli首先以四聚体或八聚体形式与HJs形成复合物,再招募两个RuvBE.coli六聚体环装载至RuvAE.coli-HJs复合物上;接着,RuvAB利用水解ATP供能催化HJs的分支迁移与解离,通过延展异源双链体区域促进其它重组相关蛋白在HJs复合物上的装载,为最终成熟重组双链DNA分子的形成创造必要条件[22]。RuvAE.coli的两种寡聚形式导致了两种RuvAE.coli-HJs复合物的形成(四聚产物RuvAE.coli-HJs-I和八聚产物RuvAE.coli-HJs-II)。由于RuvAMhp与ssDNA形成的两种复合物在聚丙烯酰胺凝胶中的迁移率与RuvAE.coli和RuvAMpn与HJs形成的两种复合物相似,RuvAMhp-HJs复合物在聚丙烯酰胺凝胶中的迁移率与RuvAMpn-HJs-II复合物相似[16],因此作者推测RuvAMhp以八聚体形式与HJ形成稳定复合物,而与ssDNA则以四聚体和八聚体形式形成两种复合物。这可能归因于RuvAMhp对HJs的亲和力较ssDNA更强,并且符合RuvA在HJ上形成稳定的八聚体结构对其充分发挥酶活至关重要的研究报道[23-25]。RuvAMpn与四链DNA底物结合时的寡聚特征表征试验同样提示RuvAMhp主要以八聚体形式与HJ形成稳定复合物(图7)。此外,不同于RuvAMpn偏好结合单链DNA,RuvAMhp与RuvAMge对HJs表现出了更强的亲和力[16]。无论是ssDNA还是HJs,添加的RuvAMhp浓度越高,形成的高分子量复合物的产物越多(图5、6),提示高分子量聚合形态的RuvAMhp较低寡聚的RuvAMhp与结合DNA结合的更稳定。符合解旋酶的一般特征[26],RuvAMhp的DNA结合活性也表现出了长度依赖性,ssDNA底物长度越长(图5),形成高分子量RuvAMhp-ssDNA复合物的产物也越多。这可能与长度长的底物更利于解旋酶聚合装载有关。
4 结 论
本研究完成了RuvAMhp重组蛋白的原核表达、多克隆抗体制备及活性鉴定。制备了特异性好、效价高(1∶256 000)的兔抗RuvAMhp多克隆抗体;体外证明了RuvAMhp对DNA具有较强的结合活性,尤其是对同源重组四链DNA中间体的亲和力高达624.4 pmol·L-1;鉴定出了RuvAMhp不同于其他支原体来源的DNA结合特征,为进一步探究RuvA调解同源重组介导RuvAMhp抗原变异的分子机制提供了生物学材料并奠定了基础。



