刘悦阳,李梦媛,2,聂雪伊,马亚博,侯雨欣,马伯利,杨 易,徐金瑞*
(1.宁夏大学西部特色生物资源保护与利用教育部重点实验室,银川 750021; 2.宁夏医科大学回医药现代化教育部重点实验室,银川 750010)
2022年WHO全球结核病报告显示,在2021年里全球新发结核病患者数、耐药性结核病患者数及结核病死亡人数较往年相比均有所上升[1]。在全球30个结核病高负担国家中,我国结核病发病数排第三位。结核病(tuberculosis,TB)是一种由结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)引起的慢性人畜共患传染病,具有较强的传染性和危害性[2]。Mtb是一种胞内寄生菌,能够寄生于巨噬细胞中,同时巨噬细胞作为Mtb入侵机体的第一道防线,当Mtb入侵机体时,能够激活驻留在肺组织中的巨噬细胞,活化后的巨噬细胞通过膜内陷、出芽等方式吞噬Mtb,进而参与到抗结核的保护性免疫作用之中[3-4]。尽管如此,Mtb仍具有能够逃脱巨噬细胞捕杀的机制,从而在宿主体内存活。因此,阐明Mtb与巨噬细胞相互作用的机制具有重要意义。细胞自噬是一种重要的生理代谢途径,对细胞内成分的利用及维持细胞稳态具有重要作用[5]。细胞自噬参与Mtb感染的多个环节,包括自噬溶酶体形成、炎症细胞因子分泌、抗原递呈、抗菌肽产生[6]。在细胞饥饿、缺氧、胞内细胞器损伤、微生物感染等多种应激状态下,自噬通常会被激活[7]。多种自噬相关蛋白(autophagy associated proteins)相互协调,共同参与不同阶段的自噬调控。自噬典型的特征是形成双层膜自噬体,并涉及超过35个自噬相关蛋白,包括自噬体标记物LC3(light chain 3)[8-9],在自噬过程中,细胞质LC3-Ⅰ被水解后与脂质磷脂酰乙醇胺结合形成LC3-Ⅱ,LC3-Ⅱ可用于评估自噬的发生程度。研究表明,在Mtb感染过程中,肺泡巨噬细胞启动细胞内自噬、凋亡等多种机制,抑制或清除Mtb[10]。钙结合蛋白S100A4也被称为成纤维细胞特异性蛋白1(fibroblast specific protein1,FSP1),是S100钙结合蛋白家族成员之一,含有101个氨基酸,相对分子质量为12 ku,通常在免疫细胞如中性粒细胞、活化的巨噬细胞和某些T细胞的细胞质中表达。S100A4为同源二聚体结构,这有利于目的蛋白的结合,在胞外通过与蛋白间相互作用从而达到调节细胞活力、血管生成、侵袭的作用。在肿瘤细胞中,S100A4作为一种典型的核定位信号,与肿瘤的发生与转移有关,包括细胞黏附、运动、侵袭和转移[11]。S100A4也被报道参与调控多种细胞自噬,不仅参与肿瘤细胞自噬的调控,在非肿瘤疾病自噬调控过程中也至关重要[12]。在Mtb感染巨噬细胞过程中,S100A4是否对巨噬细胞自噬具有调控作用,尚未见报道。因此,本研究在干扰S100A4基础上,对BCG感染的巨噬细胞自噬相关指标进行检测,旨在阐明S100A4对BCG感染的巨噬细胞自噬的调控作用。
1 材料与方法
1.1 菌种与细胞
牛结核分枝杆菌疫苗株卡介苗(BCG)购自成都生物制品研究所。人单核巨噬细胞(THP-1)由本实验室保存。
1.2 主要试剂与仪器
RPMI Medium 1640培养基、胎牛血清(Gibco,美国);结核分枝杆菌即用型培养液(晶诺生物,中国);佛波酯(Sigma-Aldrich,美国);反转录试剂盒(诺唯赞,中国);qRT-PCR检测试剂盒(全式金,中国);Trizol(Ambion,美国);M-PER、Lipofectamine RNAiMAX试剂(赛默飞,美国);Protease inhibitor Cocktail(Sigma-Aldrich,美国);BCA蛋白定量检测试剂盒(凯基,中国);β-巯基乙醇(索莱宝,中国);S100A4干扰序列(吉玛,中国);β-actin兔源多克隆一抗、HRP偶联的羊抗兔IgG抗体(H+L)二抗、LC3一抗、Beclin-1一抗(Proteintech,美国);S100A4一抗(Cell Signaling Technology,美国);Atg7一抗(Abcam,美国);4%多聚甲醛(百赛生物,中国)。
细胞计数仪(BioRAD公司,美国),Enspire 荧光酶标仪(PerkinElmer公司,美国),光学显微镜(Motic公司,中国);Quantity Studio 5实时荧光定量PCR仪、NanoDrop-8000超微量分光光度计(赛默飞,美国);Amersham Imager600自动化学发光成像仪(General Electric公司,美国);荧光共聚焦显微镜(赛默飞,美国)。
1.3 试验方法
1.3.1 BCG培养 将BCG接种于含结核分枝杆菌即用型培养液的培养瓶中,置于37 ℃,5% CO2培养箱中静置培养,待达到对数生长期时通过分光光度计测定吸光度OD600 nm值,以确定BCG浓度[13-14]。
1.3.2 THP-1细胞培养 THP-1细胞培养于含10%胎牛血清和0.05 mmol·L-1β-巯基乙醇的RPMI Medium 1640培养基中,当细胞生长密度达到80%~90%时,采用半换液法进行传代,传代后将细胞静置于37 ℃,5% CO2细胞培养箱中培养[13-14],按照每孔1×106个接种于6孔板中,每孔加入50 ng·mL-1的佛波酯后,继续培养48 h,将其诱导贴壁,并使其分化为巨噬细胞,更换新鲜培养液继续培养24 h,用于后续试验。
1.3.3 BCG感染 待细胞生长融合度达到80%~90%时,用BCG感染THP-1细胞,感染复数为10∶1,感染时间为2、4、6、12、24 h。确定最佳感染时间点,进行后续试验。
1.3.4 干扰S100A4 将接种于六孔板中的THP-1细胞分别转染siS100A4-1、siS100A4-2以及阴性对照si-NC,干扰序列信息见表1,并按照LipofectamineTM2000说明书要求配制质粒和脂质复合体,转染完成后将六孔板置于37 ℃、5% CO2培养箱中培养24 h,筛选出干扰效果较好的序列用于后续试验。后设置以下4个组:对照组(siNC)、BCG感染组(siNC+BCG)、siS100A4干扰组(siS100A4)和siS100A4+BCG感染组(siS100A4+BCG)。

表1 S100A4干扰序列Table 1 The interference sequence of S100A4
1.3.5 qRT-PCR 按照上述试验设计组处理细胞后,采用Trizol法提取总RNA,根据反转录试剂盒说明书将RNA反转录为cDNA(总反应体系为20 μL;反应条件:42 ℃ 2 min,37 ℃ 15 min,85 ℃ 5 s),将cDNA进行10倍稀释,再根据qRT-PCR试剂盒说明书添加各试剂,后置于PCR仪进行扩增(总反应体系为20 μL,反应过程分两步进行,第一步:94 ℃ 30 s;第二步:94 ℃ 5 s,60 ℃ 30 s,共44个循环),用2-ΔΔCt法计算各基因的相对转录量。所用引物信息见表2。

表2 qRT-PCR 所用引物Table 2 the Primers information of qRT-PCR
1.3.6 总蛋白提取 将不同处理组的THP-1细胞分别用预冷的PBS缓冲液清洗2次,每孔加入100 μL全蛋白裂解液,将装有样品的六孔板置于4 ℃摇床上充分裂解15 min,置于冰上,将细胞刮下,收集至提前加好磁珠的1.5 mL离心管中,涡旋震荡 30 s,置于4 ℃摇床上5 min,重复6次,4 ℃下12 000 r·min-1离心15 min后,吸取上清,根据BCA试剂盒说明书对提取的蛋白进行定量,并加入上样缓冲液,于100 ℃沸水浴中5 min,置-20 ℃冰箱中保存备用。
1.3.7 Western blot检测 取30 μg变性蛋白样品进行上样,通过SDS-PAGE凝胶电泳过后,利用湿转法将蛋白转至提前用甲醇激活的PVDF膜上,提前配制含5%脱脂奶粉的封闭液,待转膜结束后,将PVDF膜转至封闭液中,室温下封闭1 h,分别于4 ℃摇床上过夜孵育β-actin(1∶3 000稀释)、S100A4(1∶1 000稀释)、LC3(1∶1 000稀释)、Atg7(1∶5 000稀释)、Beclin-1(1∶1 000稀释)等蛋白抗体后,用TBST缓冲液洗涤6次,每次5 min,加入HRP偶联的羊抗兔IgG抗体(H+L)二抗(1∶3 000稀释),室温下孵育1.5 h,TBST洗涤3次,每次5 min,TBS洗涤3次,每次5 min,通过化学发光检测仪对蛋白表达量进行检测。
1.3.8 透射电镜观察细胞形态变化 按照透射电镜样本准备说明书要求收集细胞团块,沿管壁缓慢加入0.5%戊二醛固定液,重悬后在4 ℃冰箱中静置10 min,将静置后的细胞悬液转至1.5 mL离心管中,12 000 r·min-1离心10 min,弃上清,再重新加入0.5%戊二醛固定液,低温保存,用透射电镜观察并拍照记录细胞亚显微结构。
1.3.9 自噬双标腺病毒转染细胞观察胞内自噬流 将状态良好且活率超过95%的THP-1细胞以5×105个·孔-1接种于提前放置了玻璃片的六孔板中,置于37 ℃,5% CO2培养箱中培养48 h,待细胞贴壁后,弃培养液,每孔加入1 mL不含双抗的新鲜培养液和10 μL mRFP-GFP-LC3腺病毒,置于37 ℃,5%CO2培养箱中培养12 h,每孔补加1 mL培养液继续培养12 h,按照“1.3.3和1.3.4”的方法先后加入siS100A4和BCG,之后用预冷的PBS缓慢润洗3遍,每次5 min,加入4%多聚甲醛,室温下固定20 min后用PBS润洗3次,每次5 min。在载玻片上滴加1滴抗荧光淬灭剂,取出玻璃片置于载玻片上,用指甲油封片,整个过程需避光。最后将制好的片在荧光显微镜下观察,每组取5个视野观察并拍照,mRFP-GFP-LC3串联的荧光蛋白腺病毒中表达的GFP和mRFP用于标记和追踪LC3,在荧光显微镜下成像,红绿荧光合并后出现的黄色斑点即为自噬小体,红色的斑点即自噬溶酶体。
1.3.10 统计学分析 所有数据均经过3次独立试验的验证,并采用GraphPad Prism8.0.2软件中的T-test或One Way ANOVE进行统计学分析,数据用Tukey:Compare all Pairs of columns柱状图表示,P值<0.05被认为具有统计学意义(*代表差异显着,P<0.05;**代表差异极显着,P<0.01;***代表差异极显着,P<0.001)。
2 结 果
2.1 BCG感染THP-1细胞不同时间S100A4和LC3Ⅱ蛋白的表达
BCG感染THP-1细胞不同时间后,采用Western blot检测S100A4和自噬相关蛋白LC3Ⅱ的表达,结果如图1所示。与未感染组相比,BCG感染THP-1细胞后,S100A4和自噬相关蛋白LC3Ⅱ的表达均呈现先上升后下降的趋势,在12 h时二者均表达最高(图1A~C,P<0.001),LC3Ⅱ的表达在4 h与6 h时无显着差异。以上结果表明,BCG感染THP-1细胞后,S100A4及细胞自噬水平均显着升高,且12 h最高。
2.2 BCG感染THP-1细胞自噬体的数量变化
为了进一步探究BCG感染对THP-1细胞自噬的作用,在BCG感染THP-1细胞12 h后,采用透射电镜观察双层膜的自噬体,并对细胞自噬体的数量进行分析。结果表明,与未感染组相比,BCG感染组中自噬体的数量明显增多(图2红色箭头所示)。
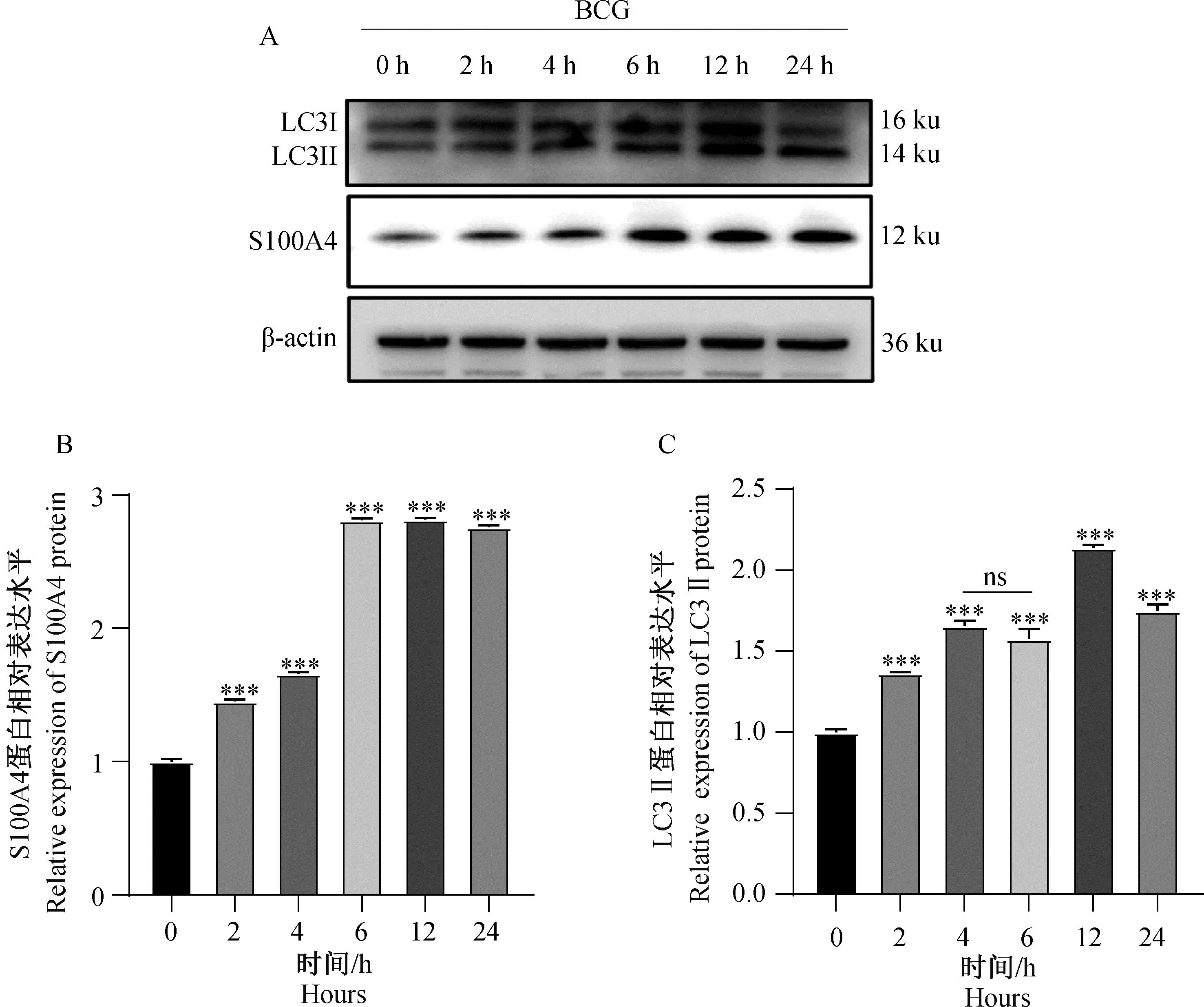
A. Western blot检测S100A4和LC3Ⅱ蛋白表达水平;B、C. S100A4和LC3Ⅱ灰度值分析,均相对于β-actin进行计算。与对照组相比, ns.P>0.05, *. P<0.05,**. P<0.01,***. P<0.001 A. The protein expression of S100A4 and LC3Ⅱ detected by Western blot; B, C. Semi-quantification of S100A4 and LC3Ⅱwere calculated relative to β-actin. Compared with control group, ns.P>0.05, *.P<0.05, **. P<0.01, ***. P<0.001图1 BCG感染THP-1细胞不同时间点S100A4和LC3Ⅱ表达的Western blot检测结果Fig.1 Western blot analysis of protein expression of S100A4 and LC3Ⅱ in BCG infected THP-1 cells at different time points
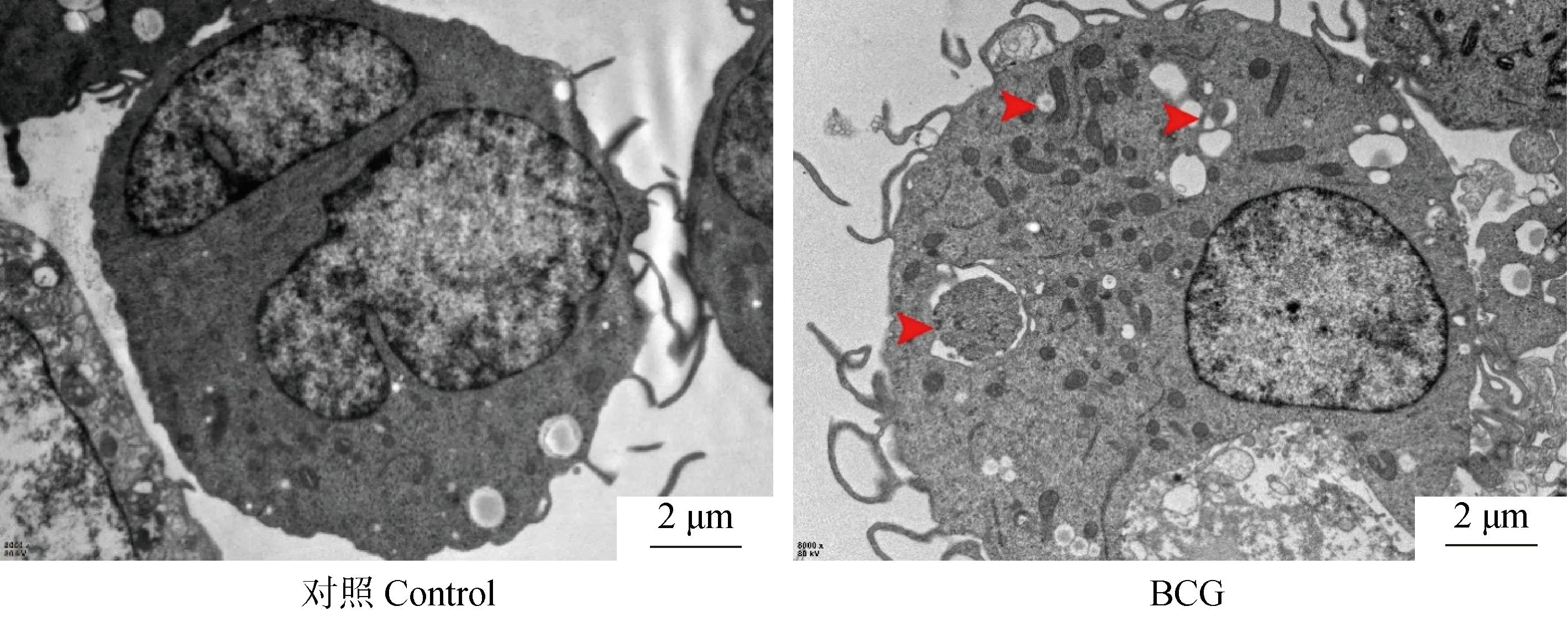
红色箭头所指为自噬体(对照Control) The red arrow shows the autophagosome图2 透射电子显微镜观察细胞内自噬体Fig.2 Intracellular autophagosomes observed by transmission electron microscopy

A. Western blot检测S100A4蛋白表达水平;B. S100A4灰度值分析相对于β-actin进行计算。与对照组相比,***. P<0.001 A. The protein expression of of S100A4 detected by Western blot; B. Semi-quantification of S100A4 was calculated relative to β-actin. Compared with control group, ***. P<0.001图3 S100A4 siRNA的敲减效果验证Fig.3 Verification of knockdown effect of S100A4 siRNA
2.3 S100A4小干扰RNA的筛选
采用小干扰RNA转染THP-1细胞24 h后,Western blot检测S100A4蛋白的表达。结果显示,与siNC转染组相比,siS100A4-2能够极显着干扰S100A4的表达(图3A、B,P<0.001),且较siS100A4-1干扰效果明显。因此,后续试验采用siS100A4-2对THP-1巨噬细胞中的S100A4进行干扰(后续试验采用siS100A4-2处理THP-1细胞)。
2.4 干扰S100A4对BCG感染THP-1细胞自噬相关分子的作用
为了验证S100A4对BCG感染THP-1细胞后自噬的调控作用,使用筛选出的siS100A4-2转染细胞,经BCG感染12 h,采用qRT-PCR和Western blot检测S100A4和自噬相关分子的mRNA转录水平和蛋白表达水平。
由图4可见,在mRNA转录水平上,BCG感染组中S100A4的转录水平显着高于siNC组(图4A,P<0.05),siS100A4+BCG组S100A4转录水平极显着低于siNC+BCG组(图4A,P<0.001);siNC+BCG组中自噬相关因子LC3、Atg7、Beclin-1的转录水平均显着高于未感染组(图4B~D,P<0.05),siS100A4+BCG组中LC3、Atg7的转录水平均极显着低于siNC+BCG组(图4B、4C,P<0.05),Beclin-1的转录水平均显着低于BCG感染组(图4D,P<0.01)。以上结果表明,S100A4能够促进BCG诱导的THP-1细胞自噬。
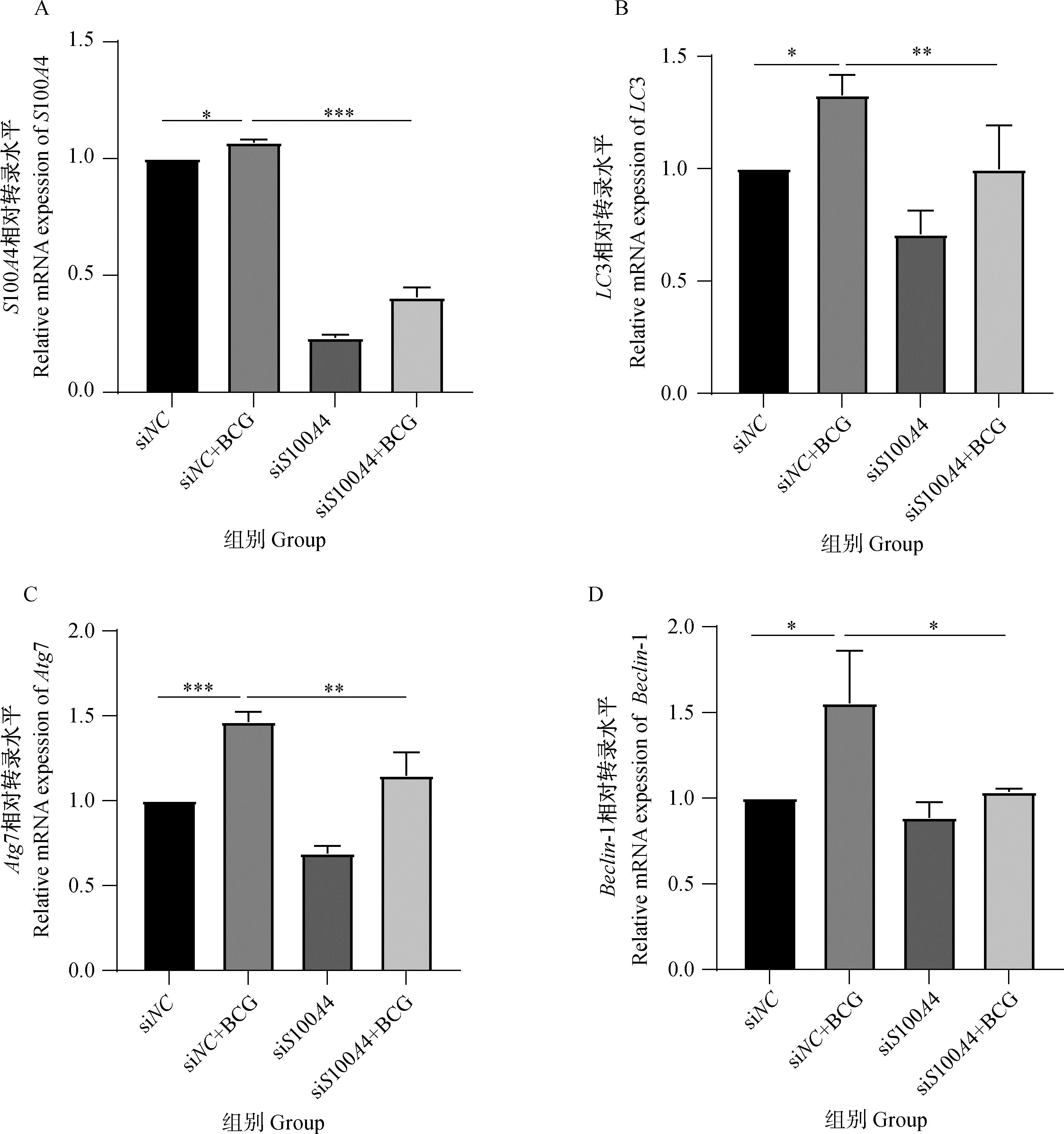
A、B、C、D. q-PCR检测S100A4、LC3、Atg7、Beclin-1 mRNA 表达水平。组间比较,*. P<0.05,**. P<0.01,***. P<0.001 A, B, C, D. The mRNA expression of S100A4, LC3, Atg7, Beclin-1 detected by q-PCR. Comparison among groups, *.P<0.05, **. P<0.01, ***. P<0.001.图4 干扰S100A4经BCG感染THP-1细胞后S100A4及自噬相关因子mRNA水平的表达Fig.4 The mRNA levels of S100A4 and autophagy related factors after BCG infection of S100A4 with THP-1 cells
图5结果显示,在蛋白水平上,与未感染组相比,siNC+BCG感染组中S100A4表达水平极显着上调(图5A、B,P<0.001),与siNC+BCG组相比,siS100A4+BCG组S100A4表达极显着下调(图5A、B,P<0.001);siNC+BCG感染组中自噬相关蛋白LC3Ⅱ、Atg7、Beclin-1表达均显着高于未感染组(图5A、C、D、E,P<0.05),siS100A4+BCG组中LC3Ⅱ、Atg7、Beclin-1表达较siNC+BCG感染组均下调极显着(图5A、C~E,P<0.001)。以上试验结果表明,干扰S100A4的表达能够抑制BCG诱导的THP-1细胞自噬。
2.5 干扰S100A4对BCG 感染THP-1细胞后自噬流的影响
为了进一步明确干扰S100A4对BCG感染THP-1巨噬细胞对自噬的调控作用,采用激光共聚焦显微镜观察自噬流的变化。图6结果显示,BCG感染组中黄色斑点代表的自噬体和由红色斑点代表的自噬溶酶体的数量显着高于未感染组(P<0.01),而siS100A4+BCG组红色和黄色斑点显着低于siNC+BCG感染组(P<0.05)。以上结果表明,干扰S100A4的表达抑制了由BCG诱导的巨噬细胞自噬,与 “2.4” 结果一致。

(图6续 Continued)
3 讨 论
面对结核病死亡人数及新增病例双增加的危机形势,依然没有发现有效的治疗手段,药物仍然是治疗TB的主要方法,但是耐药性的增强使TB的治疗进入停滞期,所以仍会出现炎性反应、氧化应激等生理学过程[15],对结核病的致病机理研究亟需攻克。细胞自噬常常被认为是探究结核病致病机理的重要切入点,自噬作为细胞防御的第一防线,在多年以前人们就已经开始通过这条途径着手开发抗结核药物[16]。Mtb作为一种胞内病原体,当Mtb入侵机体时,巨噬细胞会启动一系列受体相关的信号级联反应引发免疫防御功能,并通过吞噬作用、细胞凋亡和细胞自噬等发挥抗感染作用[17]。陈琪等[18-19]的研究表明,当Mtb入侵机体后,可诱导巨噬细胞活化并激活自噬,当自噬发生时可将包含有Mtb的自噬体运输至溶酶体进行降解[20]。本研究结果显示,BCG感染巨噬细胞后自噬标志性分子的表达呈现上升趋势,表明自噬与结核病的发生机制相关联。
钙结合蛋白S100A4是S100钙结合蛋白家组成员之一,首次在转移细胞和成纤维细胞中发现,同时也是炎症巨噬细胞的特定亚群[21]。S100A4分布广泛,在骨髓、脾、淋巴细胞、巨噬细胞及成纤维细胞中都有被检测到。S100A4作为一种典型的迁移性蛋白,与多种癌症的发生相关,如乳腺癌[22]、结直肠癌[23]、胃癌[24]等。此外,S100A4也会引发类风湿性关节炎[25]、心肌梗死[26]、鼻窦炎[27]等非肿瘤疾病的发生。
本研究首先用BCG感染巨噬细胞不同时间,确定BCG诱导细胞自噬的最适时间。在此基础上,用BCG和siS100A4单独或共处理THP-1细胞,对S100A4的表达及自噬相关指标进行检测,以揭示S100A4对BCG感染巨噬细胞自噬的调控作用。近年来,有学者研究了S100A4介导的细胞自噬在其他疾病中的作用,如Hou等[28]研究表明,S100A4能抑制癌细胞自噬,从而促进癌细胞的增殖,Wang等[12]研究表明,沉默S100A4表达可促进自噬进一步促进碱烧伤后角膜创面的愈合。本研究结果显示,S00A4正向调控BCG诱导的巨噬细胞自噬,与他人的研究结果存在差异,可见S100A4在不同疾病中对自噬的调控作用不同。
此外,S100A4也参与诸多病原体的生命活动,Yang 等[29]研究表明,S100A4+巨噬细胞能够促进寨卡病毒进入生精小管促使其在睾丸中持续复制。此外,细菌在宿主体内的高效清除与S100A4有关,Bian等[30]研究表明,S100A4在体外无杀菌作用,当宿主受到金黄色葡萄球菌感染后,S100A4可调节细菌清除并参与全身或局部炎症反应。由于肠道附着很多菌群,一些疾病的发展与肠道菌群息息相关,Zhang等[31]研究表明S100A4可以增强肠道上皮细胞中枸橼酸杆菌的附着力从而促进肠炎的发展。以上结果表明,S100A4在不同病原微生物感染中的作用不尽一致,或因病原微生物及宿主细胞类型不同所致。上述结果提示,S100A4对结核菌感染的巨噬细胞自噬在结核菌感染中的作用值得深入研究。
大量研究已经表明S100A4能够通过P53[32]、β-catenin[28]、PI3K/AKT/mTOR[12]等信号通路调控肿瘤细胞自噬。因此,S100A4调控BCG诱导巨噬细胞自噬的分子机制有待进一步研究。
4 结 论
BCG感染THP-1细胞导致细胞自噬的发生,干扰S100A4表达对BCG诱导的巨噬细胞自噬具有明显的抑制作用。



